灯盏乙素衍生物代谢性质的快速体外评价
郑 林,胡 杰,曹 旭,黄 勇,董永喜,王永林
(贵阳医学院1.药学院贵州省药物制剂重点实验室,2.民族药与中药开发应用教育部工程研究中心,贵州贵阳 550004)
灯盏乙素(scutellarin)主要来源于菊科飞蓬属植物灯盏细辛(Erigeron breviscapus),是其主要活性成分。临床上已应用灯盏乙素的各种剂型来治疗心脑血管疾病。现代研究发现,灯盏乙素口服后生物利用度极低,而体内真正的吸收与药物发挥作用的形式是灯盏乙素苷元,但是灯盏乙素苷元仍存在代谢稳定性不佳的问题[1]。因此,本实验室以灯盏乙素及其苷元为先导化合物,设计合成了11个衍生物,以期改善灯盏乙素的代谢稳定性。
据统计,在创新药物研发过程中,约35%的候选化合物在临床前研究阶段因体内药代动力学行为不良而停止开发。而进入临床研究后,又有约40%的候选药物因药代动力学参数不佳而遭淘汰[2]。因此,在新药开发的早期阶段,利用体外模型对候选化合物药动学特点进行初筛,以便在研究开发的早期确定该候选化合物是否有继续开发的价值,还可根据筛选的结果对先导化合物进行结构改造或修饰,获得具有良好药动学特性的候选化合物[3]。同时,如果早期就能获知化合物的代谢信息将有助于从药理活性相似的化合物中选择候选化合物。体外筛选实验中,肝微粒体模型由于方便快捷、代谢条件易于控制、重现性好,成为候选化合物代谢稳定性筛选最常用的模型[4]。
目前,应用肝微粒体模型筛选化合物的代谢稳定性并检测活性代谢产物的研究鲜有报道。因此,本实验将通过肝微粒体模型筛选出代谢性质优于灯盏乙素及其苷元的候选化合物,对筛选出的化合物进行酶促动力学研究,并推测可能的代谢产物。
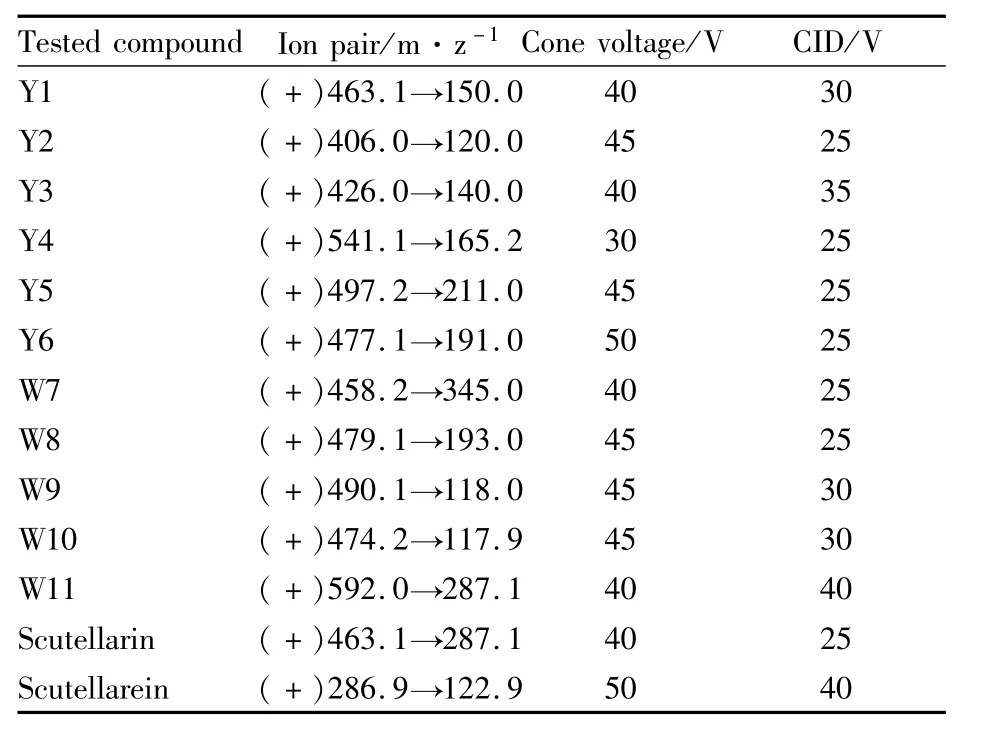
Tab 1 M ass spectrometric parameters
1 材料与方法
1.1 药品与试剂 化合物Y1-Y6、W7-W11由贵阳医学院药学院提供;灯盏乙素苷元(批号201206,纯度≥98%,上海顺勃生物工程有限公司);灯盏乙素(批号110842,纯度≥98%,中国食品药品检定研究院)。NADP+(购于Roche公司);6-磷酸葡萄糖、6-磷酸葡萄糖脱氢酶(均购于Sigma公司);SD大鼠肝微粒体(广州诺嘉生物科技有限公司);其他试剂均为色谱纯。
1.2 仪器 WATERS ACQUITY UPLC超高压液相三重四级杆质谱联用仪(二元梯度泵,真空脱气机,柱温箱,Masslynx 4.1质谱工作站,自动进样器);Allegra 64R低温高速离心机(美国Beckman Coulter公司);AE240十万分之一电子天平(梅特勒-托利多仪器上海有限公司);CS501A超级恒温水浴器(中国重庆银河试验仪器有限公司)。
1.3 色谱条件 色谱柱 Acquity UPLC BEH C18柱(2.1 mm×50 mm,1.7μm);流动相0.1%甲酸乙腈溶液(A)-0.1%甲酸水溶液(B),梯度洗脱(0→2.0 min,A∶B=10∶90→90∶10;2.1→3.0 min,A∶B=10∶90);流速0.35 ml·min-1;柱温 45℃;进样量2μl。
1.4 质谱条件 采用电喷雾(ESI)离子源,在正离子电离模式下选用多反应监测(MRM)的质谱扫描方式进行测定,各参数见Tab 1。
其他具体质谱参数如下:毛细管电压3 KV,离子源温度120℃,去溶剂气(氮气)650 L·h-1,去溶剂气温度350℃,碰撞气(氩气)0.16 ml·min-1。
1.5 化合物的体外筛选
1.5.1 肝微粒体和化合物的孵育方法 终体积为200μl的体外孵育体系,包括大鼠肝微粒体蛋白0.5 g·L-1,6-磷酸葡萄糖 10 mmol·L-1,6-磷酸葡萄糖脱氢酶 0.5 kU·L-1,MgCl24 mmol·L-1,NADP+0.5 mmol·L-1,以及所需量的化合物(筛选时,各化合物浓度均为2μmol·L-1),其余为PBS溶液。37℃预孵3 min,加入底物开始反应。每次加入反应体系中有机溶剂终浓度不超过1% (V/V)。每个样品重复3次。反应完毕后加入一倍体积含1%甲酸的冰甲醇终止反应,-20℃放置30 min后,20 000×g离心10 min,上清液进样分析[5]。
1.5.2 数据处理 采用一点法定量,以反应开始前的浓度为定量标准。消除速率常数ke为自然对数-浓度曲线上零时间和各时间点间直线的斜率,消除半衰期 T1/2=0.693/ke。清除率 CLint(L·min-1·g-1)=693/[T1/2(min)×蛋白浓 度 (g·L-1)][7]。
1.6 W 11和灯盏乙素在大鼠肝微粒体中代谢的酶动力学 取冻存的大鼠肝微粒体,按照“1.5.1”的处理方法,使形成0.2 ml的温孵体系。向0.5 g·L-1肝微粒体温孵液中分别加入系列浓度的W11溶液(W11浓度分别为 0.83、1.65、3.29、6.60、13.21、19.80μmol·L-1)和灯盏乙素(灯盏乙素的浓度分别为 1.11、2.21、3.32、4.42、6.63、8.84、11.05、16.58μmol·L-1),6-磷酸葡萄糖 10 mmol·L-1,6-磷酸葡萄糖脱氢酶0.5 kU·L-1,NADP+0.5 mmol·L-1,DMSO浓度不超过0.5%(V/V)。启动反应后开始计时。温孵100 min,预处理后,进行UPLCMS/MS分析,测定W11和灯盏乙素的剩余浓度。根据Lineweaver-Burk(双倒数作图法)来计算W11和灯盏乙素的酶促动力学参数Km,Vmax及CLint。
2 结果
2.1 待测化合物在SD大鼠肝微粒体中的消除待测化合物与SD大鼠肝微粒体孵育后其代谢稳定性结果见Tab 2。
2.2 化合物W 11与灯盏乙素的酶促动力学参数根据Lineweaver-Burk作图法得到W11的米氏方程(Y=436.73X+97.54,r=0.9982),其Vmax为(10.25±0.93)μmol·min-1·g-1,Km为(4.48±0.10)μmol·L-1,CLint为(2.29±0.23)L·min-1·g-1;灯盏乙素的米氏方程(Y=223.04X+21.92,r=0.9957),其 Vmax为(45.95±9.50)μmol·min-1·g-1,Km为(10.19±1.66)μmol·L-1,CLint为(4.48±0.20)L·min-1·g-1。
2.3 W 11可能的代谢产物 在检测W11原型的同时,也检测了可能的代谢产物,灯盏乙素和M1。M1的质谱条件是母、子离子对的质荷比分别为:(+)578.0→287.1,锥孔电压30V,碰撞电压30eV,其他条件同“1.4质谱条件”。
由于没有标准品对M1进行定量分析,因此使用峰面积表示代谢产物生成情况。以W11的加入量为横坐标,代谢产物(M1和灯盏乙素)的峰面积为纵坐标作图(Fig 1),结果孵育100min时,随W11的浓度升高,M1的生成量呈线性增加,其回归方程为 Y=249.40X +222.63(r=0.9972);灯盏乙素的生成量也呈线性增加,其回归方程为Y=53.21X+73.76(r=0.9873),并且在同一检测条件下,其出峰时间和灯盏乙素标准品一致。由此推断,W11在孵育体系中可能先脱甲基代谢生成M1,然后酯键水解释放出活性代谢产物灯盏乙素(Fig 2)。
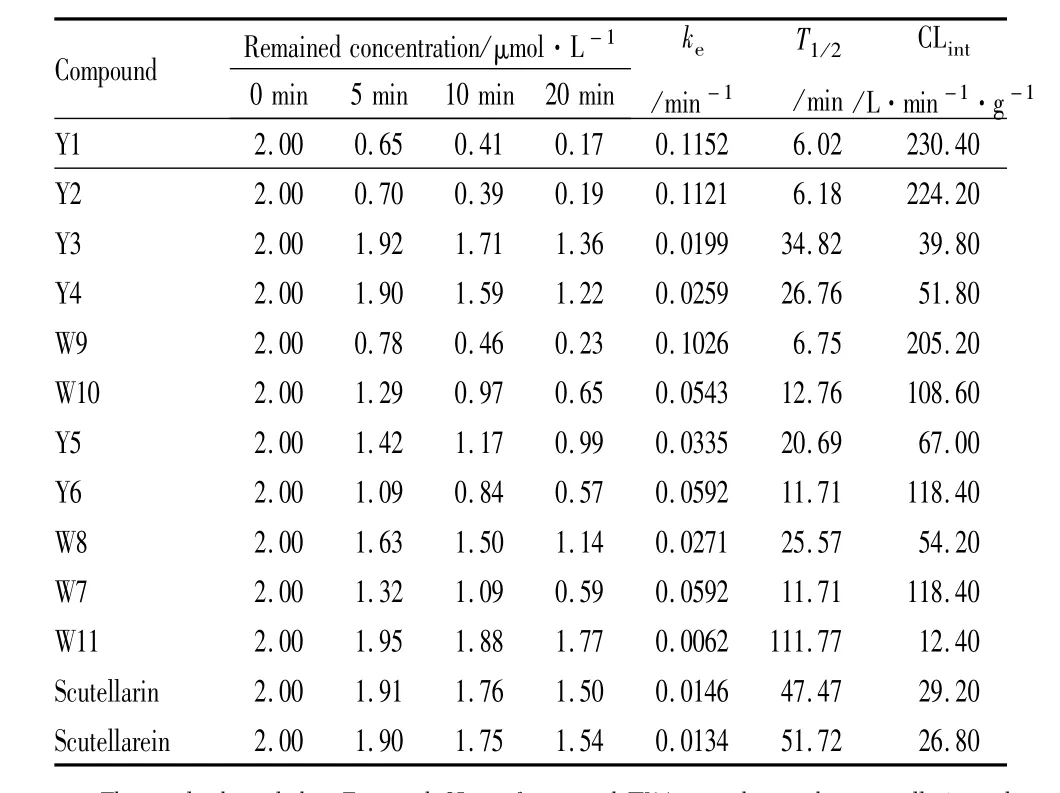
Tab 2 M etabolic elim ination and corresponding parameters of tested compounds in SD rat liver m icrosomes
3 讨论
本研究应用肝微粒体模型筛选出代谢性质较灯盏乙素及其苷元有所改善的候选化合物W11。针对筛选的化合物W11,进行酶促动力学以及可能的代谢产物研究。结果表明,候选化合物W11可能具有优于灯盏乙素的代谢性质,并能释放活性代谢产物灯盏乙素。
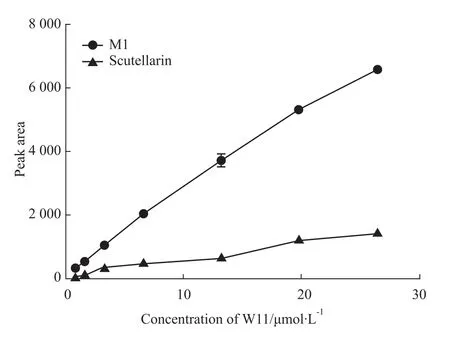
Fig 1 Peak area of M 1 and scutellarin
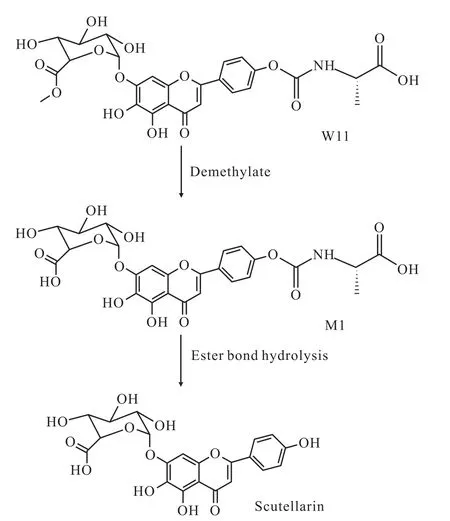
Fig 2 M etabolic pathways of W 11
该研究检测结果中,由于化合物W11和M1的分子质量相差14,根据W11的结构特征,推测W11在孵育体系中可能先脱甲基代谢生成M1,然后酯键水解释放出活性代谢产物灯盏乙素。该结论尚需通过高分辨质谱获得M1的精确分子质量和二级质谱碎片离子信息,以此确认可能的分子结构。
药动学的体内筛选和体外筛选是相辅相成的,药动学的体内筛选可以对体外筛选的结果加以验证;而体外筛选模型可以通过快速筛选对大量的候选化合物进行初筛,并对候选化合物的药动学特性做出初步的评价,以缩小体内筛选的范围[2]。本实验采用体外肝微粒体转运法快速初筛出代谢性质较佳,又可释放活性代谢产物的W11,缩小体内筛选的范围。但体外实验难以完全模拟药物在动物体内的药动学行为,因此尚需通过体内药动学实验加以验证,以期解决灯盏乙素和灯盏乙素苷元代谢稳定性不佳的问题,为新药开发奠定基础。
参考文献:
[1] 车庆明,潘丽怡,陈 颖,等.灯盏花乙素苷元的药动学研究[J].中国药学杂志,2007,42(18):1418-21.
[1] Che Q M,Pan L Y,Chen Y,et al.Study on pharmacokinetics of scutellarein[J].Chin Pharm J,2007,42(18):1418-21.
[2] 董晓娜.体内外方法高通量筛选系列化合物药动学性质[D].沈阳药科大学,2009.
[2] Dong X N.Rapid pharmacokinetics screening of drug candidates in vitro and in vivo[D].Shenyang Pharmaceutical University,2009.
[3] 陈 燕,柳晓泉,王广基.创新药物药动学高通量筛选[J].中国药科大学学报,2003,34(4):291-5.
[3] Chen Y,Liu X Q,Wang G J.High-throughput screening approaches for new drug metabolism and pharmacokinetics[J].China Pharm Univ,2003,34(4):291-5.
[4] 黄 勇,陆 苑,郑 林,等.灯盏乙素苷元在大鼠肝微粒体中酶促反应动力学和对CYP3A的影响[J].中国药理学通报,2013,29(11):1623-4.
[4] Huang Y,Lu Y,Zheng L,etal.Enzyme kinetics of scutellarein aglycone in rat livermicrosome and effects of scurellarein aglycone on rats CYP3A activity in vitro[J].Chin Pharmacal Bull,2013,29(11):1623-4.
[5] 温彬宇,李 豪,王 岚,等.Beagle犬肝微粒体中葛根素的HPLC-ESI-MS测定及代谢动力学研究[J].中国中药杂志,2008,33(23):2834-7.
[5] Weng B Y,Li H,Wang L,et al.Metabolic kinetic of puerarin in beagle livermicrosomal by HPLC-ESI-MS[J].Chin J Chin Mat Med,2008,33(23):2834-7.
[6] 曾 苏.药物代谢学[M].杭州:浙江大学出版社,2008:234.
[6] Zeng S.Drug metabolism[M].Hangzhou:Zhejiang University Press,2008:234.
[7] Baranczewski P,Stanczak A,Sundberg K,et al.Introduction to in vitro estimation ofmetabolic stability and drug interactions of new chemical entities in drug discovery and development[J].Pharmacol Rep,2006,58(4):453-72.