三种小鼠骨质疏松模型骨组织形态计量学观察与评价
司徒永立,柯 行,刘 义,吕思敏,钟月春,崔 燎,吴 铁
(1.广东医学院病原生物学与免疫学研究所,2.广东医学院药理学教研室,3.广东天然药物研究与开发重点实验室,广东湛江 524023)
骨质疏松是一种以骨量减少和骨微结构退变为特征,致使骨脆性和骨折危险性增加的系统性骨骼疾病[1]。绝经后骨质疏松主要是由于随着年龄的增长,女性绝经后雌激素缺乏所引起,它是绝经后妇女常见病、多发病。目前骨质疏松动物模型的建立有多种方法,如去卵巢致骨质疏松动物模型、糖皮质激素性骨质疏松动物模型、环磷酰胺诱导骨质疏松动物模型等,各种骨质疏松动物模型都有其特点,可用于相应骨质疏松症的研究,但其不足之处我们必须引起重视。
D-半乳糖常用于衰老动物模型的建立,近年来,D-半乳糖对小鼠骨组织的研究已有一些报道,但研究发现D-半乳糖对小鼠骨量的影响结果不一,覃冬云等[2]研究发现D-半乳糖能导致♀小鼠发生骨质疏松;但罗红梅等[3]研究发现D-半乳糖可提高♀小鼠矿化程度。本研究旨在探讨D-半乳糖对♀小鼠是否会产生骨质疏松,这种骨质疏松与去卵巢导致的骨质疏松有何异同?去卵巢后再加上D-半乳糖是否会加速加重骨质疏松的进展?补充雌激素对这些骨质疏松是否有预防作用?
1 材料与方法
1.1 药物与试剂 己烯雌酚片:合肥久联有限公司,批号:20100920;D-半乳糖:天津市光复精细化工研究所,批号:20090921;钙黄绿素、盐酸四环素:美国Sigma公司。
1.2 动物分组、给药及实验方法 60只2月龄SPF级昆明♀小鼠,由广东医学院实验动物中心提供,动物合格证号:SCXK(粤)2008-0008。动物适应性喂养1周后,按体重随机分成6组,分别为假手术组(S)、D-半乳糖组(D)、去卵巢组(O)、去卵巢 +D-半乳糖组(O+D)、去卵巢+D-半乳糖+己烯雌酚组(O+D+d)和D-半乳糖+己烯雌酚组(D+d)。O组、O+D组、O+D+d组进行双侧去卵巢手术,其余组做假手术对照,休养2 d后给药。D组和O+D组皮下注射D-半乳糖120 mg·kg-1·d-1,O+D+d组和D+d组皮下注射D-半乳糖120 mg·kg-1·d-1,灌胃给予己烯雌酚 0.038 mg·kg-1·d-1,其余组皮下注射、灌胃给予等量蒸馏水,所有小鼠于处死前d 10~11和d 3~4分别皮下注射盐酸四环素35 mg·kg-1、钙黄绿素7.5 mg·kg-1,进行荧光标记,全程自由饮食,每周称重1次,实验周期为70 d。实验结束当天,颈椎脱臼处死小鼠,右胫骨按文献[4]步骤,进行不脱钙包埋切片、染色,并以生长板下0.5 mm到2 mm为测量范围,对上述范围的松质骨进行测量、计算和分析。
1.3 统计学处理 使用SPSS 16.0软件进行ANOVA单因素方差分析,所有数据以¯x±s表示。
2 结果
2.1 各组小鼠体重观察 各组小鼠体重见Fig 1,由Fig 1可见:与D组比较,D+d组第3、5、8周体重降低(P<0.05)。与O+D组比较,O+D+d组第7、8、9周体重降低(P<0.01)。

Fig 1 Body weight in m ice(±s,n=10)*P<0.05,**P<0.01 vs S group,#P<0.05,##P<0.01 vs D group;ΔP<0.05;ΔΔP<0.01 vs O+D group
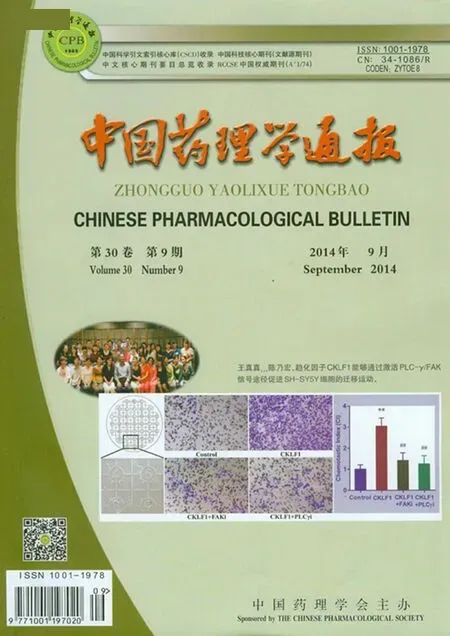
2.2 各组小鼠胫骨上段骨小梁面积与骨小梁形态观察 从Fig 2可见,S组骨小梁结构紧密、粗而均匀,连续性好,数量多;D组骨小梁结构稀疏,变细、断裂,不连续,数量减少;O组只剩下一小部分的断裂骨小梁,出现大量无骨小梁骨髓区;O+D组也只剩下一小部分的断裂骨小梁,出现大量无骨小梁骨髓区;O+D+d组较O+D组骨小梁面积有所增大,数量有所增加,但结构较稀疏;D+d组骨小梁较D组结构紧密,明显增粗、增大,连续性较好,数量明显增加。
2.3 各组小鼠胫骨上段骨形态计量学静态指标观察 从Tab 1可见:与S组比较,O组骨小梁面积百分数(%Tb.Ar)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)分别降低了50.4%、25.4%、50.9%(P<0.01),骨小梁分离度(Tb.Sp)升高了169.4%(P<0.05)。O+D组%Tb.Ar、Tb.N、Tb.Th分别减低了46.2%(P<0.01)、48.6%(P<0.01)、21.0%(P<0.05),Tb.Sp升高了131.7%(P<0.05)。与 O+D组比较,O+D+d组%Tb.Ar、Tb.N、Tb.Th分别升高了 122.3%(P<0.01)、79.1%(P<0.01)、27.5%(P<0.05),Tb.Sp降低了 54.2%(P<0.05)。与 D组比较,D+d组%Tb.Ar、Tb.N分别升高了108.8%(P<0.01)、68.4%(P<0.05),Tb.Sp降低了57.5%(P<0.01)。
Tab 1 Static parameters of bonemorphology in tibia(±s,n=10)

Tab 1 Static parameters of bonemorphology in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs D group;ΔP<0.05,ΔΔP<0.01 vs O+Dgroup
G r o u p %T b.A r/%T b.T h/μ m T b.N/n o.·m m-1 T b.S p/μ m S 7.1 6±1.9 9 4 3.3±8.2 8 2.1 4±0.5 7 2 4 5 4±1 2 2 D 4.9 8±1.9 2 4 2.4±1 0.1 1.5 5±0.9 3 5 8 8 1±4 8 9 O 3.5 5±1.8 7**3 2.3±6.0 0**1.0 5±0.4 5 8** 1 2 2 3±7 6 4*O+D 3.8 5±1.5 8**3 4.2±5.0 4* 1.1 0±0.3 6 1**1 0 5 2±5 7 3*O+D+d 8.5 6±3.4 7 ΔΔ 4 3.6±8.1 4 Δ 1.9 7±0.7 8 3 ΔΔ 4 8 2±1 7 4 Δ D+d 1 0.4±3.3 5## 3 9.8±6.7 8 2.6 1±0.7 0 5# 3 7 4±1 1 4##
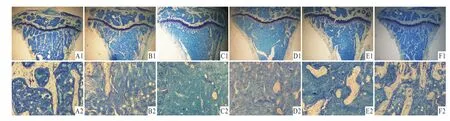
Fig 2 Trabecular area and trabecular morphology in tibiaSgroup:A1,A2;D group:B1,B2;O group:C1,C2;O+D group:D1,D2;O+D+d group:E1,E2;D+d group:F1,F2;Toluidine blue staining,A1~F1:4×,A2~F2:20×
2.4 各组小鼠胫骨上段破骨细胞形态及骨吸收静态指标观察
2.4.1 各组小鼠胫骨上段破骨细胞形态观察 从Fig 3可见,S组破骨细胞附着骨表面,未发生极化现象,并未开始侵蚀骨小梁。D组破骨细胞已附着骨表面,与骨表面处较模糊,出现极化、皱褶缘或伪足,开始侵蚀骨小梁。O组破骨细胞位于Howship陷窝的骨表面,与骨表面处模糊不清,出现极化、皱褶缘或伪足,较深地侵蚀骨表面。O+D组破骨细胞位于Howship陷窝的骨表面,与骨表面处模糊不清,出现极化、皱褶缘或伪足,较深地侵蚀骨表面。O+D+d组破骨细胞附着骨表面,形成Howship陷窝不明显,极化、皱褶缘或伪足迹象较弱。D+d组破骨细胞附着骨表面,形成Howship陷窝不明显,极化、皱褶缘或伪足迹象较弱。
2.4.2 各组小鼠胫骨上段骨吸收的静态指标观察各组小鼠胫骨上段骨吸收的静态指标见Tab 2,由Tab 2可见:与S组比较,D组破骨细胞周长(Oc.Pm)、破骨细胞数(Oc.No.)、破骨细胞周长百分数(%Oc.S)、每毫米破骨细胞数(Oc.N/mm)分别升高了 105.7%(P<0.01)、109.2%(P<0.05)、125.8%(P<0.05)、139.2%(P<0.05)。O组 Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm 分 别 升 高 了204.3%、248.7%、389.6%、508.4%(P<0.01)。O+D组 Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm分别升高了 227.2%、327.4%、268.7%、410.2%(P<0.01)。与D组比较,O组Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm分别升高了47.9%(P<0.01)、66.7%(P<0.01),116.8%(P<0.05)、154.4%(P<0.05)。O+D组Oc.Pm升高了59.1%(P<0.05)。D+d组 Oc.Pm、%Oc.S、Oc.N/mm分别降低了57.5%、79.9%、66.2%(P<0.01)。与O+D组比较,O+D+d组 Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm分别降低了59.1%、47.4%、74.2%、65.6%(P<0.01)。
Fig 3 M orphology of osteoclast in tibiaSgroup:A;D group:B;O group:C;O+D group:D;O+D+d group:E;D+d group:F;Toluidine blue staining(20×)
Tab 2 Static parameters of bone resorption in tibia(±s,n=10)
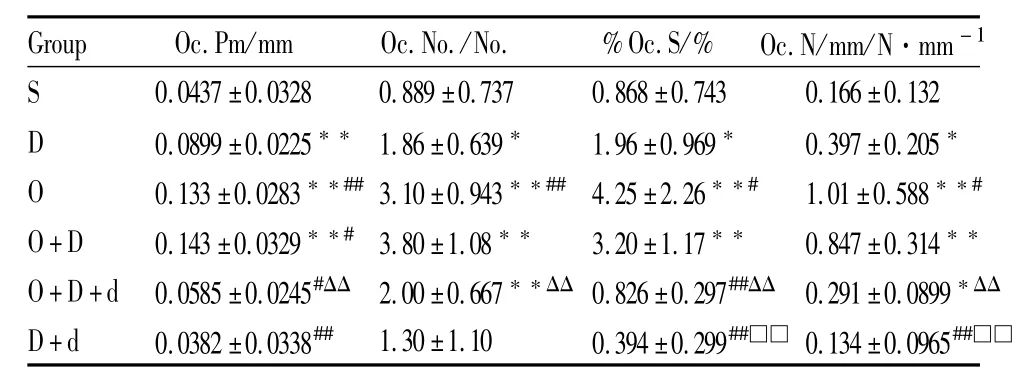
Tab 2 Static parameters of bone resorption in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs Dgroup;ΔΔP<0.01 vs O+D group;□□P<0.01 vs O+D+d group.
G r o u p O c.P m/m m O c.N o./N o. %O c.S/% O c.N/m m/N·m m-1 S 0.0 4 3 7±0.0 3 2 8 0.8 8 9±0.7 3 7 0.8 6 8±0.7 4 3 0.1 6 6±0.1 3 2 D 0.0 8 9 9±0.0 2 2 5**1.8 6±0.6 3 9* 1.9 6±0.9 6 9* 0.3 9 7±0.2 0 5*O 0.1 3 3±0.0 2 8 3**##3.1 0±0.9 4 3**## 4.2 5±2.2 6**# 1.0 1±0.5 8 8**#O+D 0.1 4 3±0.0 3 2 9**# 3.8 0±1.0 8** 3.2 0±1.1 7** 0.8 4 7±0.3 1 4**O+D+d 0.0 5 8 5±0.0 2 4 5#ΔΔ 2.0 0±0.6 6 7**ΔΔ 0.8 2 6±0.2 9 7##ΔΔ 0.2 9 1±0.0 8 9 9*ΔΔ D+d 0.0 3 8 2±0.0 3 3 8## 1.3 0±1.1 0 0.3 9 4±0.2 9 9##□□ 0.1 3 4±0.0 9 6 5##□□
2.5 各组小鼠胫骨上段成骨细胞形态观察 各组小鼠胫骨上段成骨细胞形态见Fig 4,由Fig 4可见,S组成骨细胞在骨表面排列紧密,呈圆柱形,其下面贴近骨表面处可见一层较厚嗜酸性的类骨质。D组成骨细胞在骨表面排列稀疏,呈扁平状,其分泌嗜酸性类骨质较少。O组成骨细胞在骨表面排列稀疏,呈扁平状,其分泌嗜酸性类骨质少。O+D组成骨细胞在骨表面排列稀疏,呈扁平状,其分泌嗜酸性类骨质少。O+D+d组成骨细胞在骨小梁表面排列较紧密,呈圆柱形,其分泌嗜酸性类骨质较多。D+d组成骨细胞在骨小梁表面排列较紧密,呈圆柱形,其分泌嗜酸性类骨质较多。

Fig 4 M orphology of osteoblast in tibiaSgroup:A;D group:B;O group:C;O+D group:D;O+D+d group:E;D+d group:F;Toluidine blue staining(20×)
2.6 各组小鼠胫骨上段骨形成动态指标观察 与S组比较,O组单标记周长(sL.Pm)、双标记周长(dL.Pm)、双标记间距(Ir.L.Wi)、标记周长百分数(%L.Pm)分别降低了 77.3%、91.7%、68.9%、73.4%(P<0.01)。O+D组 sL.Pm、dL.Pm、Ir.L.Wi、%L.Pm分别降低了 56.6%、74.2%、34.4%、46.1%(P<0.05)。与D组比较,O组 sL.Pm、dL.Pm、Ir.L.Wi、%L.Pm分别降低了 64.5%(P<0.01)、68.8%(P<0.01)、59.2%(P<0.01)、59.5%(P<0.05)。O+D组sL.Pm降低了32.1%(P<0.05),D+d组 sL.Pm、dL.Pm分别升高了104.7(P<0.01)、99.0%(P<0.05)。与 O+D组比较,O+D+d组 sL.Pm、dL.Pm、Ir.L.Wi、%L.Pm分别升高了 118.0%(P<0.01)、106.4%(P<0.01)、46.6%(P<0.05)、49.4%(P<0.05),见Tab 3。
Tab 3 Dynam ic parameters of bone formation in tibia(±s,n=10)
Tab 3 Dynam ic parameters of bone formation in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs Dgroup;ΔP<0.05,ΔΔP<0.01 vs O+Dgroup;□□P<0.01 vs O+D+d group.
Group sL.Pm/mm dL.Pm/mm Ir.L.Wi/μm %L.Pm/%S 0.871±0.561 0.361±0.337 16.21±5.381 11.9±6.77 D 0.557±0.163 0.096±0.041 12.37±5.569 7.82±3.86 O 0.198±0.185**##0.030±0.026**## 5.05±4.234**## 3.17±3.02**#O+D 0.378±0.132*# 0.093±0.043* 10.79±3.607* 6.42±2.64*O+D+d 0.824±0.173##ΔΔ 0.192±0.054##ΔΔ 15.82±3.871Δ 9.59±3.57Δ D+d 1.14±0.277##□□ 0.191±0.085#15.82±4.430 8.36±1.45
2.7 各组小鼠胫骨上段骨形成荧光及动态指标观察
2.7.1 各组小鼠胫骨上段骨形成荧光观察 S组荧光多、亮,双荧光间距较大。D组荧光少,比较暗淡,只见单荧光。O组和O+D组荧光少且弱。O+D+d组较O+D组荧光有所改善,双荧光间距较小,但比较模糊、暗淡。D+d组较D-半乳糖组有所改善,可见双荧光且间距较大,但还是比较模糊、暗淡,见 Fig 5。
2.7.2 各组小鼠胫骨上段骨生长的动态指标观察与S组比较,D组骨矿化沉积率(MAR)、骨形成率(BFR/TV、BFR/BV、BFR/BS)分别降低了44.4%、77.0%、78.2%、74.6%(P<0.05)。O组MAR、BFR/TV、BFR/BV、BFR/BS分别降低了73.2%、95.7%、93.5%、94.1%(P<0.01)。O+D组 MAR、BFR/TV、BFR/BV、BFR/BS分别降低了40.1%(P<0.05)、79.0%(P<0.01)、73.0%(P<0.05)、63.6%(P<0.01)。与D组比较,O组MAR、BFR/TV、BFR/BV、BFR/BS分别降低了 51.9%(P<0.05)、81.1%(P<0.05)、70.3%(P<0.01)、76.7%(P<0.01)。D+d组 MAR、BFR/TV、BFR/BV、BFR/BS分 别 升 高 了 75.2%、416.1%、195.8%、174.8%(P<0.01)。与 O+D组比较,O+D+d组 MAR、BFR/TV、BFR/BV、BFR/BS分别升高了 62.6%(P<0.01)、287.6%(P<0.01)、217.1%(P<0.05)、120.1%(P<0.05),见 Tab 4。
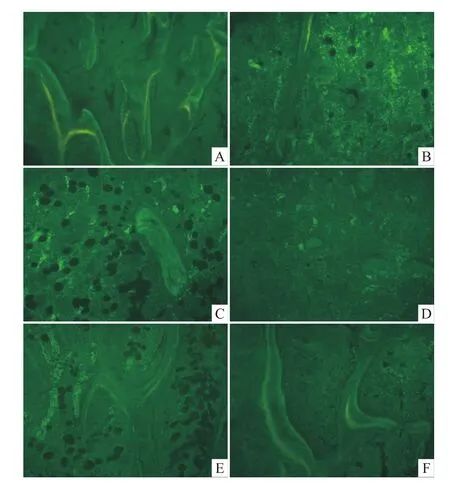
Fig 5 Fluorescent of bone formation in tibiaSgroup:A;D group:B;O group:C;O+D group:D;O+D+d group:E;D+d group:F;Thick slices with fluorescence photographs without staining(20×)
Tab 4 Dynam ic parameters of bone formation in tibia(±s,n=10)

Tab 4 Dynam ic parameters of bone formation in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs D group;ΔP<0.05,ΔΔP<0.01 vs O+Dgroup
Group MAR/μm·d-1 BFR/TV/%·yr-1 BFR/BV/%·yr-1 BFR/BS/%·yr-1 S 2.32±0.769 26.9±18.9 455±320 10.0±5.79 D 1.29±0.274* 6.20±5.32* 99.4±27.4* 2.54±0.867*O 0.621±0.553**# 1.17±1.17**# 29.5±29.1**## 0.593±0.590**##O+D 1.39±0.673* 5.65±3.07** 123±97.4* 3.64±2.93**O+D+d 2.26±0.553##ΔΔ 21.9±8.27##ΔΔ 390±269#Δ 8.01±3.86##Δ D+d 2.26±0.633## 32.0±13.9## 294±104## 6.98±2.52##
3 讨论
3.1 小鼠去卵巢骨质疏松模型的骨形态学特点与S组比较,O组骨小梁数量与面积明显减少,结构断裂、稀疏,出现大片骨小梁缺失的骨髓区域,%Tb.Ar、Tb.Th、Tb.N降低,Tb.Sp升高,说明去卵巢致小鼠骨量丢失严重,骨小梁密度降低,分离度增加,呈现典型的骨质疏松形态学特点。破骨细胞较深地侵蚀骨表面,骨吸收参数升高,表明破骨细胞活性和数量增加,骨吸收功能活跃。成骨细胞在骨表面排列稀疏,呈扁平状,分泌嗜酸性类骨质少,荧光少且弱,骨形成参数降低,表明成骨细胞数量少,功能不活跃、骨形成功能降低。综上所述,本实验去卵巢模型骨形成降低,骨吸收增加,符合低转换型骨质疏松,与张延娇等[5]研究发现不一致,这可能与实验周期有关,张延娇等实验周期为42 d,本实验周期为70 d,去卵巢属于快速骨丢失,破骨细胞活性增加,骨吸收功能活跃,可能越到后期骨量丢失越多,本实验发现O组骨量丢失严重,破骨细胞数量多、活性强,荧光标记部分的骨表面被破骨细胞快速侵蚀,导致骨量明显减少。这些结果提示,去卵巢初期成骨细胞的功能是活跃的,表现为高转换型骨质疏松,随着成骨细胞功能的衰退,后期则出现低转换型的骨质疏松,对此有待进一步观察。
去卵巢致骨质疏松的发生是一个相当复杂的过程,有多种刺激因素的作用和众多调节因子参与了骨质疏松的发病机制,在这些因素的相互作用和共同影响下最终导致骨质疏松的发生,其中氧化应激是绝经期妇女骨质疏松的一个重要发病机制[6]。近年来研究表明,去卵巢导致骨质疏松的发生的机制与OPG/RANKL/RANK系统密切相关[7]。Wnt/β-catenin信号通路也参与了去卵巢致骨质疏松的发生过程,通过调节成骨细胞的功能,从而间接调节骨形成[8]。
3.2 小鼠D-半乳糖骨质疏松模型的骨形态学特点及雌激素的影响 与S组比较,D组%Tb.Ar、Tb.Th、Tb.N有减少的趋势,Tb.Sp有增加的趋势,但均无统计学意义。虽然从Fig 2-B1、B2中可以看出骨小梁结构稀疏、变细、断裂等变化,但并不能呈现出典型的骨质疏松形态学改变。破骨细胞在骨表面开始侵蚀骨小梁,骨吸收参数升高,表明破骨细胞数量和活性增加,骨吸收功能活跃。成骨细胞在骨表面排列稀疏,呈扁平状,分泌嗜酸性类骨质较少,荧光少、暗淡,只见单荧光,骨形成参数降低,说明成骨细胞功能不活跃,骨形成功能降低。综上所述,D-半乳糖属于低转换型骨丢失,与罗红梅等[9]研究发现一致。与O组比较,骨吸收参数降低,说明D组骨吸收功能较O组弱,而骨形成参数升高,说明D组比O组骨形成功能强。给予雌激素后,D+d组骨小梁数量明显增加,连续性较好,骨小梁分离度减少,破骨细胞数量减少,骨吸收活性降低,成骨细胞活性和骨形成功能增强,并降低该模型体重。
D-半乳糖是一种还原性单糖,在细胞醛糖还原酶的作用下,转化为不能被机体进一步代谢的半乳糖醇,堆积在细胞内,导致细胞肿胀、功能障碍、代谢紊乱,短时间内引起机体衰老。实验动物长期注射D-半乳糖会产生一系列与自然衰老相似的病理变化,有研究表明[10]男性骨质疏松不仅与雄性激素减少有关,与衰老的发生过程也有关,是一种低转换的骨丢失,与本实验研究结果一致,故D-半乳糖对研究老年性骨质疏松可能有重要意义。虽然D-半乳糖对雌性小鼠骨量的影响存在不一致的结果,作者认为该结果与剂量、给药时间和年龄有关。罗红梅等[3]D-半乳糖剂量为 600 mg·kg-1和 1200 mg·kg-1,给药2个月,发现D-半乳糖提高♀小鼠骨矿程度。覃冬云等[11]D-半乳糖剂量为 1000 mg·kg-1,给药42 d,发现 D-半乳糖对3月龄♀小鼠发生骨质丢失,而对1月龄♀小鼠无影响。本实验给药剂量为120mg·kg-1,给药时间70 d,发现♀小鼠胫骨上段骨吸收活跃,骨形成降低,如果适当延长给药时间,应该可以造成典型老年性骨质疏松模型。有研究报道[9],D-半乳糖致骨质疏松机制可能与因脑老化导致脑-垂体-性腺功能紊乱有关。本实验研究表明,雌激素对半乳糖致小鼠骨质疏松具有预防作用,故D-半乳糖致骨质疏松机制可能与引起体内激素水平下降有关。
3.3 小鼠去卵巢加D-半乳糖骨质疏松模型的特点及雌激素的影响 与S组比较,O+D组骨小梁大量丢失,骨小梁间隙增大,%Tb.Ar、Tb.N、Tb.Th降低,Tb.Sp升高,说明骨量丢失严重,骨微结构破损,骨小梁厚度和数量降低,分离度增加。破骨细胞较深地侵蚀骨表面,骨吸收参数升高,表明破骨细胞数量增加,骨吸收功能活跃。成骨细胞在骨表面排列稀疏,呈扁平状,其分泌嗜酸性类骨质少,荧光少且弱,骨形成参数降低,表明成骨细胞功能不活跃,骨形成降低。与O组比较,O+D组骨吸收与骨形成参数没有统计学意义,可知去卵巢后再给予D-半乳糖并不能加重骨质疏松的进程,其原因可能是小鼠去卵巢70 d后,两组小鼠骨量已经丢失很严重,D组比O组骨吸收弱,而骨形成比去卵巢强,其骨量减少程度远不如去卵巢,故即使去卵巢联合D-半乳糖也不能得到明显的统计学意义。或者70 d这不是最适合观察时间点,因为这时两组骨量都已经严重丢失。与D组比较,O+D组小鼠骨形态计量学参数均无统计学意义,说明两组骨量变化无明显差异。补充雌激素后,骨量、骨小梁厚度、数量增加,分离度降低,破骨细胞骨吸收功能降低,数量减少,成骨细胞活性增加,促进骨形成,降低该模型体重。
去卵巢加D-半乳糖致小鼠骨质疏松模型目前未见研究报道,本课题组为模拟正常妇女绝经期与衰老同时发生的生理过程来更好地模拟骨质疏松的发生过程,利用D-半乳糖所致衰老与去卵巢模拟绝经期雌激素缺乏的基本原理来联合制模。本实验研究发现去卵巢合并D-半乳糖确实能明显地减低小鼠胫骨上段骨量,可以作为一种新的骨质疏松动物模型。本实验研究发现己烯雌酚能改善该模型的骨丢失。其抗骨质疏松机制可能与以下几点有关。(1)通过诱导破骨细胞的凋亡,抑制成骨细胞的凋亡[12]。(2)直接作用成骨细胞,促进骨形成[13]。(3)提高机体抗氧化能力[14]。
去卵巢、D-半乳糖、去卵巢联合D-半乳糖均能建立小鼠骨质疏松模型,相对去卵巢小鼠骨质疏松模型而言,D-半乳糖小鼠骨质疏松模型骨形成活性较高,骨吸收活性较低,雌激素能有效预防D-半乳糖和去卵巢联合D-半乳糖致小鼠骨质疏松模型的骨丢失,可作为研究抗骨质疏松药物的阳性对照药。
参考文献:
[1] Brown JP,Fortier M,Frame H,et al.Canadian consensus conference on osteoporosis[J].JObstet Gynaecol Can,2006,28:95-112.
[2] 覃冬云,吴 铁,崔 燎,等.D-半乳糖导致小鼠骨丢失及其机制初探[J].中国药理学通报,2003,19(9):1017-9.
[2] Qin D Y,Wu T,Cui L,et al.The effect of D-galactose on bone metabolism inmice and itsmechanism[J].Chin Pharmacol Bull,2003,19(9):1017-9.
[3] 罗红梅,崔 燎,吴 铁.D-半乳糖对不同性别小鼠骨的影响[J].微量元素与健康研究,2012,29(1):4-7.
[3] Luo H M,Wu T,Cui L.Effectof D-galactose on bone of different gendermouse[J].Stud Trace Elements Health,2012,29(1):4-7.
[4] 崔 燎,吴 铁.骨质疏松药理学-动物实验与图谱[M].北京:科学出版社,2011:43-4.
[4] Cui L,Wu T.Pharmacological studiesof anti-Osteoporosisand the atlas[M].Beijing:Science Press,2011:43-4.
[5] 张延娇,李绍新,陈 博.哌嗪雌酚酮对生长期去卵巢小鼠胫骨骨形态计量学的影响[J].广东医学院学报,2010,28(2):125-8.
[5] Zhang Y J,Li SX,Chen B.The effect of piperazinyl estrone on bone histomorphometry of tibia in developing OVX mice[J].J Guangdong Med Coll,2010,28(2):125-8.
[6] Yin H,Shi ZG,Yu Y S,etal.Protection againstosteoporosis by statins is linked to a reduction of oxidative stress and restoration of nitric oxide formation in aged and ovariectomized rats[J].Eur J Pharmacol,2012,674:200-6.
[7] Roggia C,Gao Y,Cenci S,etal.Up-regulation of TNF-producing T cells in the bone marrow:a key mechanism by which estrogen deficiency induces bone loss in vivo[J].Proc Natl Acad Sci USA,2001,98:13960-5.
[8] Bodine P V,Komm B S.Wnt signaling and osteoblastogenesis[J].Rev Endocr Metab Disord,2006,7(1-2):33-9.
[9] 罗红梅,崔 燎,吴 铁,等.D-半乳糖致雄性大鼠的骨丢失[J].中国组织工程研究与临床康复,2011,15(7):1146-9.
[9] Luo H M,Cui L,Wu T.D-galactose induced bone loss in male rats[J].JClin Rehab Tissue Engin Res,2011,15(7):1146-9.
[10]Drake M T,Khosla S.Male osteoporosis[J].Endocrinol Metab Clin North Am,2012,41(3):629-41.
[11]覃冬云,吴 铁,崔 燎.D-半乳糖对不同月龄雌性小鼠骨代谢的影响[J].中国骨质疏松杂志,2004,10(1):27-9.
[11]Qin D Y,Wu T,Cui L.The effectof D-galactose on bonemetabolism in different-month-old mice[J].Chin J Osteoporos,2004,10(1):27-9.
[12]Kameda T,Mano H,Yuasa T,et al.Estrogen inhibits bone resorption by directly inducing apoptosisof the bone-resorbing osteoclasts[J].JExp Med,1997,186:489-95.
[13]Ikegami A,Inoue S,Hosoi T,et al.Immunohistochemical detection and northern blot analysis of estrogen receptor in osteoblastic cells[J].JBone Miner Res,1993,8:1103-9.
[14]Tang X L,Liu X J,Tian Q,et al.Dynamic oxidative stress and DNA damage induced by oestrogen deficiency and protective effects of puerarin and 17β-oestradiol in ovariectomized rats[J].Basic Clin Pharmacol Toxicol,2012,111(2):87-91.