新型益脑双联体防治阿尔采末病作用及机制研究进展
苏 玮,朱龙军,许大平,崔 巍,3,张在军,3,胡胜全,3,麦成雄,3,韩怡凡,3
(1.香港理工大学应用生物与化学技术学系,香港;2.暨南大学新药研究所,广东广州 510632;3.香港理工大学深圳研究院,广东深圳 518057)
阿尔采末病(Alzheimer’s disease,AD)是由脑病变损害导致患者记忆、思维和行为障碍的慢性神经退行性疾病。大多数AD患者的年龄超过65岁。据统计AD患病率约占老年人10%,85岁以上人群的发病率更接近50%。随着人口的持续老龄化,AD已成为继心脑血管疾病、恶性肿瘤之后的第三大杀手。现今全世界AD患病人数超过2 500万,我国估计已达700万[1]。美国每年用于AD患者的护理和药费支出高达1100亿美元,超过了心脑血管疾病和恶性肿瘤 。因此,AD已成当代社会和家庭的沉重负担,它不仅是一个重大的医学问题,更是一个社会问题。
AD典型病理特征是老年斑(senile plaques)、神经纤维缠结(neurofibrillary tangles)以及与学习记忆密切相关的皮层神经细胞进行性凋亡。虽然AD发生、发展的分子机制尚不明了,但学界普遍认可AD是多因素、多环节机制介导的复杂疾病,并提出胆碱能学说、β-淀粉样蛋白(β-amyloid,Aβ)毒性学说、神经兴奋性毒性学说、细胞凋亡学说、自由基损伤学说等多种学说,从不同角度阐述AD的分子机制和病理变化。这些学说对深入理解AD发病机制和开发有效防治药物有重要指导意义[2]。
Aβ毒性学说在众多学说中尤其受到关注。AD相关遗传、环境因素可诱导β-淀粉样前体蛋白(APP)过度表达,提高β-和γ-分泌酶活性,降低α-分泌酶的活性,促进Aβ分泌。Aβ存在单体、寡聚体、纤维等不同聚集形式。其中,可溶性Aβ寡聚体具有极高神经毒性,可抑制长时程增强(long-term potentiation,LTP)形成、并诱导神经细胞凋亡。AD患者脑中可溶性Aβ寡聚体浓度与认知能力降低呈因果相关[3]。这些证据提示可溶性Aβ寡聚体是AD的主要致病分子,立足于对抗Aβ神经毒性的“对因治疗”方案是突破AD治疗瓶颈的关键。
临床治疗AD严重依赖“一药一靶位”(one-drug-singletarget)的乙酰胆碱酯酶(acetylcholinesterase,AChE)抑制剂和 N-甲 基-D-天 冬 氨 酸 (N-methyl-D-aspartic acid receptor,NMDA)受体拮抗剂。但“一药一靶位”药物治疗AD在本质上存在不足。AD发病与多基因、多环节相关,“一药一靶位”药物仅能缓解AD病症,无法产生“对因治疗”效果。此外,许多AD靶标具有生理功能,过分抑制容易导致副作用。临床数据也显示,“一药一靶位”药物疗效非常有限,仅能改善部分AD患者症状。
“一药多靶位”(one-drug-multiple-target)药物可能是防治AD最有前途的方向。首先,Aβ、AChE、NMDA受体、神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)等已被证实是防治AD的重要靶标。其次,部分AChE抑制剂也被发现能同时作用多个靶位。此外,“一药多靶位”药物在临床治疗学上也有明显优势,能克服联合用药的缺陷,提高AD患者的顺应性。
近10余年,本研究小组致力“一药多靶位”防治AD药物的研究,并成功研制了一系列包含他克林(tacrine,Cognex®)和石杉碱甲(huperzine A)片段的新型高活性抗AD双联体(Fig 1)[4]。这些双联体合成步骤简单,成本低廉,且已在众多AD细胞、动物模型展示了优于临床AD药物的疗效,精巧地体现了中西药物的最优化组合,展示了传统中药现代化进程中的崭新趋势。本文综述其中具代表性的新型益脑双联体(Bis(n)-Cognitin,又称 Bis(n)-tacrine)防治 AD的药理作用及其分子机制的研究进展。
1 Bis(n)-Cognitin同时结合AChE两个活性中心、选择性抑制AChE
Sussman等[5]应用X射线-单晶衍射技术解析了AChE的晶体结构,发现AChE具有催化阴离子位点(catalytic anionic site)和外周阴离子位点(peripheral anionic site,)两个活性中心,分别发挥催化乙酰胆碱(acetylcholine)水解和调节酶活性的作用。他克林是临床用于AD治疗的AChE抑制剂。Pang等[6]应用计算机辅助分子对接技术发现他克林能结合AChE的两个活性中心,因此提出通过桥联基团将双分子他克林链接,以期获得能同时结合AChE两个活性中心、具有更高抑制活性的Bis(n)-Cognitin(Fig 2)。另一方面,由于丁酰胆碱酯酶(butyrylcholinesterase,BuChE)不具备外周阴离子位点,因此,Bis(n)-Cognitin有望选择性抑制AChE。
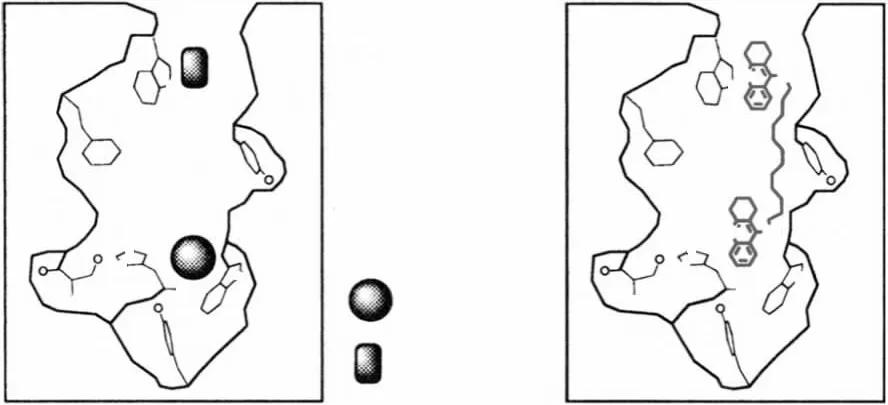
Fig 2 Structure-based rational drug design for Bis(n)-Cognitin(adapted from Pang et al.[6])
Pang等[6]合成了不同链长的 Bis(n)-Cognitin,并测试其体外AChE抑制活性和选择性,结果显示:Bis(n)-Cognitin可明显抑制AChE,其中Bis(7)-Cognitin(7个亚甲基连接的双联体)的活性最高,其半抑制浓度(IC50)达到1.6 nmol·L-1。与他克林相比,Bis(7)-Cognitin的AChE抑制活性强了1 000倍,选择性强了10 000倍。酶动力学研究发现:Bis(7)-Cognitin对AChE抑制模式为混合型,表观动力学常数(Ki)为 1.4~2.8 nmol·L-1,证实了 Bis(n)-Cognitin通过同时结合催化位点和外周位点抑制AChE。Yu等[7]测试了Bis(n)-Cognitin在体AChE抑制活性,结果显示:口服或腹腔注射Bis(7)-Cognitin均能明显抑制大鼠脑内AChE,且抑制活性和选择性均高于他克林。这些研究结果证实Bis(n)-Cognitin能同时结合 AChE两个活性中心,选择性抑制AChE。
2 Bis(n)-Cognitin多靶点抑制Aβ神经毒性
Aβ构成的老年斑是AD的主要病理特征,可溶性Aβ寡聚体是AD的主要致病分子。对抗Aβ神经毒性是“对因治疗”AD的主要目标。Fu等[8]应用转染APP的N2a细胞模型,发现Bis(7)-Cognitin可阻止细胞分泌Aβ,进一步研究发现,Bis(7)-Cognitin是通过激活蛋白激酶 C(protein kinase C)、增强α-分泌酶活性实现上述作用的。Fu等[8]还发现Bis(7)-Cognitin可直接抑制重组人源β-分泌酶,其半抑制浓度为7.5μmol·L-1,提示 Bis(7)-Cognitin可能通过同时抑制β-分泌酶、提高α-分泌酶活性,阻止 Aβ分泌。此外,Fu等[9]发现 Bis(7)-Cognitin可预防 Aβ25-35纤维、Aβ1-42纤维以及可溶性Aβ1-42寡聚体诱导的神经细胞凋亡。进一步研究表明:Bis(7)-Cognitin是通过拮抗L-型钙离子通道对抗Aβ神经毒性的。另外,本研究小组初步研究还发现Bis(7)-Cognitin能提高高频电刺激诱发的LTP、逆转可溶性Aβ寡聚体诱导的LTP抑制。这些研究证实Bis(n)-Cognitin能多靶点抑制Aβ神经毒性,提示Bis(n)-Cognitin可能“对因治疗”AD。
3 Bis(n)-Cognitin通过同时抑制NMDA受体及nNOS阻断神经兴奋性毒性
谷氨酸(glutamate)诱导的神经兴奋性毒性是AD中神经细胞死亡的“最后通路”。阻断神经兴奋性毒性是治疗AD的重要手段。Li等[10]发现 Bis(7)-Cognitin可在大鼠小脑颗粒神经细胞预防谷氨酸诱导的神经兴奋性毒性。Luo等[11]应用同一模型发现,Bis(3)-Cognitin也有类似的神经保护作用。进一步电生理学研究显示:Bis(7)-Cognitin和Bis(3)-Cognitin可抑制NMDA诱发电流,其半抑制浓度分别为0.19和0.52μmol·L-1,效价分别是美金刚的9倍和3倍,证实Bis(n)-Cognitin是NMDA受体拮抗剂,可通过拮抗NMDA受体对抗神经兴奋性毒性。此外,Luo等[11]发现Bis(n)-Cognitin拮抗NMDA受体具有电压依赖、反竞争、快速解离等特性,可特异抑制病理条件下激活的NMDA受体,而对NMDA正常功能几无影响,提示Bis(n)-Cognitin临床副作用可能较小。
nNOS是神经兴奋性毒性的重要中介分子,NMDA受体兴奋后活化nNOS,产生一氧化氮(NO),促进神经细胞凋亡。Li等[12]应用谷氨酸诱导的神经兴奋性毒性模型,发现Bis(7)-Cognitin能降低细胞内NO水平。体外放射性酶活实验显示:Bis(7)-Cognitin可竞争性抑制重组人源 nNOS,其半抑制浓度为2.9μmol·L-1,提示 Bis(7)-Cognitin可能通过同时抑制NMDA受体、nNOS,对抗神经兴奋性毒性。这些研究证实,Bis(n)-Cognitin是“一药多靶位”化合物,可能多靶点阻止神经兴奋性毒性。
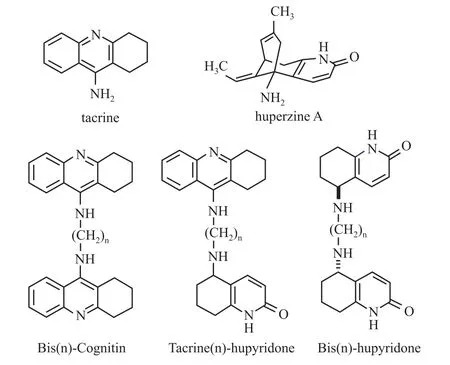
Fig 1 Chem ical structures of Bis(n)-Cognitin,Tacrine(n)-hupyridone and Bis(n)-hupyridone
4 Bis(n)-Cognitin对抗氧化应激和线粒体损伤
氧化应激和线粒体功能障碍在AD发生、发展中有重要影响。Xiao等[13]研究发现,Bis(7)-Cognitin对 H2O2诱导的PC12细胞氧化应激损伤有明显保护作用。H2O2可明显降低细胞存活率、减少谷胱甘肽过氧化物酶(glutathione peroxidase)和过氧化氢酶(catalase)活性、增加细胞内丙二醛(malondialdehyde)积累,而Bis(7)-Cognitin预处理可逆转上述变化。此外,Fu等[14]通过蛋白质组学技术研究发现:Bis(7)-Cognitin可增加抗增殖蛋白(prohibitin)、电压敏感性阴离子通道蛋白 1(voltage-dependent anion channel 1 protein)、热休克蛋白90(heat shock protein 90)、14-3-3β蛋白在线粒体的表达,挽救谷氨酸诱导的线粒体膜电位下降,证明Bis(n)-Cognitin有抗线粒体损伤作用,可能用于AD治疗。
5 Bis(n)-Cognitin调控信号通路预防细胞凋亡
AD神经细胞凋亡机制复杂,涉及磷脂酰肌醇-3激酶(phosphoinositide 3-kinase,PI3-K)/蛋白激酶 B(Akt)、细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)、p38等众多信号通路[15]。Hu等[16]发现 Bis(3)-Cognitin在大鼠小脑颗粒神经细胞可预防撤钾诱导的细胞凋亡,其机制与Bis(3)-Cognitin激活血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)及下游 PI3-K/Akt信号通路有关。Yao等[17]发现 Bis(3)-Cognitin激活PI3-K/Akt信号通路后可提高下游肌细胞增强因子-2D(myocyte enhancer factor-2D,MEF2D)的转录活性,预防1-甲基-4-苯基吡啶(MPP+)以及 α-突触核蛋白(α-synuclein)诱导的多巴胺能神经细胞凋亡。此外,Li等[10]发现Bis(7)-Cognitin可通过同时抑制 ERK、p38信号通路,预防谷氨酸诱导的大鼠小脑颗粒神经细胞凋亡。Hu等[18]发现Bis(3)-Cognitin可通过激活 PI3-K/Akt、抑制 ERK信号通路,对抗神经兴奋性毒性。这些研究证实Bis(n)-Cognitin可通过调控信号通路,阻止细胞凋亡,提示Bis(n)-Cognitin可能预防AD等神经退行性疾病。
6 Bis(n)-Cognitin拮抗离子通道型受体缓解AD症状
AD病程中,患者脑内神经递质会发生改变。因此,可望通过综合调节神经递质系统缓解AD症状,改善患者情绪、认知。Li等[19]发现 Bis(n)-Cognitin可抑制 γ-氨基丁酸(γaminobutyric acid,GABA)诱发电流。其中,Bis(2)-Cognitin的半抑制浓度为0.48μmol·L-1,效价是荷包牡丹碱的11倍,证明 Bis(n)-Cognitin是极强的 γ-氨基丁酸 A受体(GABAAreceptor)拮抗剂。Ros等[20]等发现 Bis(7)-Cognitin可抑制乙酰胆碱诱发电流,其半抑制浓度为0.16μmol·L-1,显示 Bis(n)-Cognitin对烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor)也有拮抗作用。此外,Luo等[21]发现Bis(7)-Cognitin还可抑制 5-羟色胺(5-hydroxytryptamine)诱发电流,其半抑制浓度为 2.0μmol·L-1,表明 Bis(n)-Cognitin是5-羟色胺3型离子通道受体(5-HT3receptor)拮抗剂。以上研究证实,Bis(n)-Cognitin是优秀的“一药多靶标”化合物,能够拮抗多种离子通道型受体,调节神经递质系统,可望在“对因治疗”AD的同时缓解AD症状。
7 Bis(n)-Cognitin明显改善动物学习记忆能力
AD患者的学习记忆能力进行性衰退,治疗AD的首要任务是恢复患者学习记忆能力。Wang等[22]通过东茛菪碱致大鼠痴呆模型,发现腹腔注射Bis(7)-Cognitin能明显缩短动物在Morris水迷宫实验的寻台潜伏期,其效价是他克林的12倍。Pan等[23]应用同一模型,发现腹腔注射 Bis(7)-Cognitin能减少动物避暗实验的错误次数,其效价是他克林的5倍。Han等[24]发现腹腔注射 Bis(3)-Cognitin和 Bis(7)-Cognitin均可明显提高腹腔注射东茛菪碱小鼠的新物体认知能力和空间记忆能力,其效价分别是他克林的5倍和20倍。另外,Liu等[25]通过脑室注射胆碱能神经毒素AF64A的大鼠模型,发现腹腔注射Bis(7)-Cognitin对动物空间认知能力下降有明显改善作用。这些结果均证实Bis(n)-Cognitin能明显改善动物学习记忆能力损伤,可用于AD治疗。
8 Bis(n)-Cognitin在多种动物模型阻止神经细胞凋亡
在体阻止神经细胞凋亡是治疗神经退行性疾病的主要途径[26]。Zhao等[27]研究发现:Bis(7)-Cognitin和 Bis(3)-Cognitin可明显降低大鼠大脑中动脉缺血/再灌注诱导的梗死灶面积。Shu等[28]在老龄大鼠双侧颈总动脉永久结扎模型中发现,Bis(7)-Cognitin能改善缺血引起的动物认知能力损伤,其机制与海马CA1区神经细胞凋亡减少有关。Li等[29]通过大鼠视网膜缺血/再灌注模型研究发现 Bis(7)-Cognitin可对抗缺血引起的视网膜神经节细胞凋亡。最近,Yao等[17]还发现 Bis(3)-Cognitin能保护小鼠中脑多巴胺能神经细胞,对抗 1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)引起的动物行为能力损伤。以上研究结果均显示Bis(n)-Cognitin具有极强的神经保护活性,不仅可能“对因治疗”AD,还能有助于血管性痴呆、帕金森病、青光眼等神经退行性疾病的治疗。
9 小结与展望
综上所述,Bis(n)-Cognitin可同时作用 AChE、β-分泌酶、NMDA受体、nNOS等多个AD重要靶标,抑制Aβ神经毒性、阻断神经兴奋性毒性、降低氧化应激和线粒体损伤。此外,Bis(n)-Cognitin还能阻止神经细胞凋亡、改善动物认知障碍。作为优秀的“一药多靶位”化合物,Bis(n)-Cognitin极有可能成为未来防治AD,甚至其他神经退行性疾病的高效药物。
但要将Bis(n)-Cognitin开发成药,研究还需考虑多方面问题。如AD动物模型不能完全模拟人类AD发病全部特征,因此需要验证Bis(n)-Cognitin在多个AD动物模型,尤其是转基因小鼠的疗效。另外,Bis(n)-Cognitin的安全性及临床疗效也需进一步研究。
参考文献:
[1] Chan K Y,WangW,Wu JJ,etal.Epidemiology of Alzheimer′s disease and other forms of dementia in China,1990-2010:a systematic review and analysis[J].Lancet,2013,381(9882):2016-23.
[2] 骆 静,吴 镭.NSFC资助下的阿尔采末病药物作用靶点的研究[J].中国药理学通报,2005,21(15):1423-8.
[2] Luo J,Wu L.Advances in the research on targets for drug discovery for Alzheimer′s disease supported by NSFC[J].Chin Pharmacol Bull,2005,21(15):1423-8.
[3] 刘 明,辛现良,周瑞宇,等.Aβ寡聚体与阿尔采末病及其靶点药物研究进展[J].中国药理学通报,2008,24(12):1554-7.
[3] Liu M,Xin X L,Zhou R Y,et al.Progress in soluble Aβoligomers in Alzheimer′s disease and drugs targeting Aβoligomers[J].Chin Pharmacol Bull,2008,24(12):1554-7.
[4] Koch H,Rosch W,Fruhmorgen P,et al.Diagnosis of acute gastrointestinal hemorrhages[J].MMW Munch Med Wochenschr,1979,121(29-30):975-6.
[5] Sussman JL,Harel M,Frolow F,et al.Atomic structure of acetylcholinesterase from Torpedo californica:a prototypic acetylcholine-binding protein[J].Science,1991,253(5022):872-9.
[6] Pang Y P,Quiram P,Jelacic T,et al.Highly potent,selective,and low cost bis-tetrahydroaminacrine inhibitors of acetylcholinesterase.Steps toward novel drugs for treating Alzheimer′s disease[J].JBiol Chem,1996,271(39):23646-9.
[7] Yu H,LiW M,Kan K K,et al.The physicochemical properties and the in vivo AChE inhibition of two potential anti-Alzheimer agents,bis(12)-hupyridone and bis(7)-tacrine[J].J Pharm Biomed Anal,2008,46(1):75-81.
[8] Fu H,Dou J,LiW,et al.Promisingmultifunctional anti-Alzheimer′s dimer bis(7)-Cognitin acting as an activator of protein kinase C regulates activities of alpha-secretase and BACE-1 concurrently[J].Eur JPharmacol,2009,623(1-3):14-21.
[9] Fu H,LiW,Lao Y,et al.Bis(7)-tacrine attenuates beta amyloid-induced neuronal apoptosis by regulating L-type calcium channels[J].JNeurochem,2006,98(5):1400-10.
[10]LiW,Pi R,Chan H H,et al.Novel dimeric acetylcholinesterase inhibitor bis7-tacrine,but not donepezil,prevents glutamate-induced neuronal apoptosis by blocking N-methyl-D-aspartate receptors[J].JBiol Chem,2005,280(18):18179-88.
[11]Luo J,LiW,Zhao Y,etal.Pathologically activated neuroprotection via uncompetitive blockade of N-methyl-D-aspartate receptors with fast off-rate by novelmultifunctional dimer bis(propyl)-cognitin[J].JBiol Chem,2010,285(26):19947-58.
[12]Li W,Xue J,Niu C,et al.Synergistic neuroprotection by bis(7)-tacrine via concurrent blockade of N-methyl-D-aspartate receptors and neuronal nitric-oxide synthase[J].Mol Pharmacol,2007,71(5):1258-67.
[13]Xiao X Q,Lee N T,Carlier PR,et al.Bis(7)-tacrine,a promising anti-Alzheimer′s agent,reduces hydrogen peroxide-induced injury in rat pheochromocytoma cells:comparison with tacrine[J].Neurosci Lett,2000,290(3):197-200.
[14]Fu H,LiW,Liu Y,et al.Mitochondrial proteomic analysis and characterization of the intracellular mechanisms of bis(7)-tacrine in protecting against glutamate-induced excitotoxicity in primary cultured neurons[J].JProteome Res,2007,6(7):2435-46.
[15]李 宁,刘耕陶.糖原合成激酶3:一个治疗阿尔采末病潜在的药物新靶点[J].中国药理学通报,2007,23(12):1544-8.
[15]LiN,Liu G T.Glycogen synthase kinase-3:an emerging therapeutic target for Alzheimers disease[J].Chin Pharmacol Bull,2007,23(12):1544-8.
[16]Hu SQ,CuiW,Xu D P,et al.Substantial neuroprotection against K(+)deprivation-induced apoptosis in primary cerebellar granule neurons by novel dimer bis(propyl)-cognitin via the activation of VEGFR-2 signaling pathway[J].CNS Neurosci Ther,2013,19(10):764-72.
[17]Yao L,Li W,She H,et al.Activation of transcription factor MEF2D by bis(3)-cognitin protects dopaminergic neurons and ameliorates Parkinsonian motor defects[J].J Biol Chem,2012,287(41):34246-55.
[18]Hu S,Cui W,Mak S,et al.Bis(propyl)-cognitin protects againstglutamate-induced neuro-excitotoxicity via concurrent regulation of NO,MAPK/ERK and PI3-K/Akt/GSK3beta pathways[J].Neurochem Int,2013,62(4):468-77.
[19]Li C,Carlier PR,Ren H,et al.Alkylene tether-length dependent gamma-aminobutyric acid type A receptor competitive antagonism by tacrine dimers[J].Neuropharmacology,2007,52(2):436-43.
[20]Ros E,Aleu J,Gomez de Aranda I,et al.Effects of bis(7)-tacrine on spontaneous synaptic activity and on the nicotinic ACh receptor of Torpedo electric organ[J].J Neurophysiol,2001,86(1):183-9.
[21]Luo JL,Zhang J,Guan B C,et al.Inhibition by bis(7)-tacrine of 5-HT-activated current in rat TG neurons[J].Neuroreport,2004,15(8):1335-8.
[22]Wang H,Carlier P R,Ho W L,et al.Attenuation of scopolamine-induced deficits in navigationalmemory performance in rats by bis(7)-tacrine,a novel dimeric AChE inhibitor[J].Zhongguo Yao Li Xue Bao,1999,20(3):211-7.
[23]Pan SY,Yu Z L,Xiang C J,etal.Comparison studies of tacrine and bis7-tacrine on the suppression of scopolamine-induced behavioral changes and inhibition of acetylcholinesterase inmice[J].Pharmacology,2009,83(5):294-300.
[24]Han RW,Zhang R S,Chang M,et al.Reversal of scopolamineinduced spatial and recognition memory deficits in mice by novel multifunctional dimers bis-cognitins[J].Brain Res,2012,1470:59-68.
[25]Liu J,HoW,Lee N T,et al.Bis(7)-tacrine,a novel acetylcholinesterase inhibitor,reverses AF64A-induced deficits in navigationalmemory in rats[J].Neurosci Lett,2000,282(3):165-8.
[26]雷 慧,王晓良,彭 英.线粒体损伤与阿尔采末病[J].中国药理学通报,2013,29(10):1337-41.
[26]Lei H,Wang X L,Peng Y.Mitochondrialdysfunction and Alzheimer′s disease[J].Chin Pharmacol Bull,2013,29(10):1337-41.
[27]Zhao Y,LiW,Chow PC,etal.Bis(7)-tacrine,a promising anti-Alzheimer′s dimer,affords dose-and time-dependent neuroprotection against transient focal cerebral ischemia[J].Neurosci Lett,2008,439(2):160-4.
[28]Shu X J,Liu W,Zhang L,etal.Effectof bis(7)-tacrine on cognition in rats with chronic cerebral ischemia[J].Neurosci Lett,2012,512(2):103-8.
[29]Li JB,Lu ZG,Xu L,et al.Neuroprotective effects of Bis(7)-tacrine in a rat model of pressure-induced retinal ischemia[J].Cell Biochem Biophys,2014,68(2):275-82.