硫化氢对大鼠局灶性脑缺血/再灌注损伤的保护作用及其机制
李新娟,魏林郁,李超堃,卢 娜,王国红,赵红岗,李东亮
(河南省新乡医学院生理学与神经生物学教研室,河南新乡 453003)
缺血性脑血管疾病以其高发病率、高死亡率、高致残率而严重危害人类健康,目前对其尚无完全有效的治疗手段。近年来的研究表明,硫化氢(hydrogen sulfide,H2S)是继NO和CO之后发现的第3种具有生物活性的内源性气体信号分子,H2S不借助任何特殊的运输工具就能快速通过细胞膜,对一系列生物靶点产生影响。越来越多的证据表明,H2S对多种组织的在体或离体缺血/再灌注损伤模型具有细胞保护作用[1-3]。本实验室前期研究发现,H2S供体化合物硫氢化钠(sodium hydrosulfide,NaHS)对脑缺血/再灌注引起的神经元损伤有保护作用[4],但其保护机制尚不完全清楚。另有研究表明,P2X7受体在脑缺血损伤的病理生理过程中扮演着重要的角色[5],而目前关于H2S对缺血/再灌注脑组织中P2X7受体表达的影响国内外尚未见报道,本实验通过制备大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,观察H2S对局灶性脑缺血/再灌注损伤大鼠脑组织中P2X7受体蛋白表达的影响,探讨H2S对缺血/再灌注损伤脑保护作用的可能机制,为更好地预防与治疗缺血性脑血管疾病提供理论和实验依据。
1 材料与方法
1.1 药品与试剂 NaHS购自Sigma公司。2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)购自北京生化制药厂。兔抗鼠P2X7多克隆抗体(sc-25698)购自 Santa Cruz。Cy3标记羊抗兔IgG、DAPI、抗荧光淬灭封片液均购自碧云天生物技术研究所。MCAO栓线购自北京沙东生物技术有限公司。
1.2 动物分组与给药方法 Sprague-Dawley(SD)大鼠♂,合格证号:SCXK(豫)2010-0002,体质量200~240 g,随机分为3组:假手术组、脑缺血/再灌注(I/R)组、NaHS+I/R组,如有动物死亡,随机选取大鼠补足每组16只。NaHS+I/R组于插入栓线后10 min按25μmol·kg-1的剂量腹腔注射现配置的NaHS生理盐水溶液,假手术组和I/R组在相同时间点腹腔注射等容积生理盐水。
1.3 动物模型的制备[6-7]参照Longa等方法,略做改进制备大鼠左侧大脑中动脉栓塞模型。100 g·L-1水合氯醛(350 mg·kg-1,ip)麻醉动物,颈部备皮,正中剪开皮肤,钝性分离腺体和筋膜,依次分离左侧颈总动脉、颈外动脉和颈内动脉。在颈内和颈外动脉分叉处结扎颈外动脉,同时结扎颈总动脉,动脉夹夹闭颈内动脉远心端,在颈总动脉结扎线上方穿线打松结备用,颈总动脉结扎线上方斜剪一小口,将AA级2432的栓线由此插入动脉,将栓线慢慢插入颈内动脉,去除动脉夹,当栓线进入距颈内和颈外动脉分叉处约18~19 mm有阻挡感时停止插入栓线,用颈总动脉上穿的备用线固定栓线,缝合皮肤。将动物放回笼中,置于室温26℃的室内。缺血2 h,乙醚吸入麻醉动物后,将栓线轻轻拔至有阻力时提示栓线头端已至颈总动脉切口处。假手术组仅分离动脉。
1.4 大鼠死亡率计算、神经功能缺陷评分[7]统计各组大鼠的死亡情况,死亡率以各组死亡大鼠数量/各组样本量×100%计算;大鼠脑缺血2 h,再灌注24 h,参照Longa 5分制评分标准,对实验大鼠进行神经功能行为评分,0分:无神经功能缺失症状;1分:轻度局灶性神经功能缺失(不能完全伸展对侧前肢);2分:中度局灶性神经功能缺失(向对侧转圈);3分:重度局灶性神经功能缺失(向对侧倾倒);4分:不能自发行走,意识水平降低。
1.5 大鼠脑组织切片TTC染色测定脑梗死体积[8]大鼠脑缺血 2 h,再灌注 24 h,迅速断头取脑,将鼠脑-20℃冻10 min后在冰盘上进行冠状切片,在视交叉切第1刀,在视交叉前3 mm切第2刀,在视交叉后3 mm切第3刀,在第3刀后3 mm切第4刀,将5片脑组织放入质量浓度为20 g·L-1的TTC磷酸盐缓冲液(pH 7.4)中,37℃避光恒温孵育30 min,40 g·L-1多聚甲醛磷酸盐缓冲液固定24 h后拍照。使用Image-Pro Plus 6.0图像分析软件计算脑梗死体积。梗死体积百分率/%=(正常侧大脑半球体积-梗死侧非梗死区脑组织体积)/正常侧大脑半球体积×100%。
1.6 免疫荧光检测P2X7受体蛋白表达 大鼠脑缺血2 h,再灌注24 h,常规麻醉动物,开胸暴露心脏,经左心室插灌注管至升主动脉并固定,同时右心耳剪一小洞放血,先快速灌注生理盐水200 m l冲去全身血液,然后灌注4℃40 g·L-1多聚甲醛磷酸盐缓冲液固定(pH 7.4),待大鼠全身僵硬后,断头取脑,将脑组织置于40 g·L-1多聚甲醛磷酸盐缓冲液(pH 7.4),4℃后固定过夜,150、300 g·L-1蔗糖溶液脱水后,厚20μm冰冻切片,附于防脱载玻片上。1 ml·L-1Triton X-100磷酸盐溶液洗5 min,微波修复15 min,山羊血清封闭20 min,兔抗鼠P2X7多克隆抗体(1∶150)4℃过夜,阴性对照用PBS代替一抗,Cy3标记羊抗兔 IgG(1∶500)室温2 h,DAPI复染核3 min,抗荧光淬灭封片液封片。荧光显微镜观察并拍照,每只动物取3张脑片,随机观察损伤侧大脑皮质和海马CA1区,分别在400倍镜下数阳性细胞数目,求各平均值,分别代表该动物损伤侧大脑皮质和海马CA1区P2X7受体蛋白阳性表达细胞数。
1.7 统计学处理 采用SPSS13.0统计软件分析,计量资料用¯x±s表示,多组之间显著性检验用单因素方差分析;两两均数比较采用LSD检验,分类资料采用非参数检验中的Mann-Whitney U法。
2 结果
2.1 NaHS对脑缺血/再灌注损伤大鼠死亡率、神经功能缺陷评分的影响 NaHS+I/R组共用22只大鼠,死亡6只;I/R组共用28只大鼠,死亡12只;NaHS+I/R组大鼠死亡率(27.27%)明显低于I/R组(42.86%)。I/R组大鼠神经功能缺陷评分明显高于假手术组(P<0.01),NaHS+I/R组大鼠神经功能缺陷评分明显低于I/R组(P<0.05),见Tab 1。
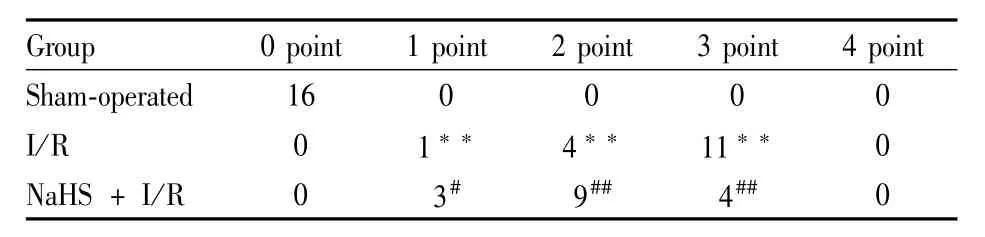
Tab 1 The neurological impairment scores of rat in different groups
2.2 NaHS对脑缺血/再灌注损伤大鼠脑梗死体积的影响 TTC染色脑片显示,假手术组两侧大脑半球呈均匀红染,I/R组和NaHS+I/R组正常脑组织染色为红色,左侧脑梗死组织呈苍白色,且NaHS+I/R组脑梗死体积百分率(21.88%±3.53%)明显小于I/R组(36.71% ±3.73%)(P<0.01),见Fig 1。
2.3 NaHS对脑缺血/再灌注损伤大鼠大脑皮质、海马CA1区P2X7受体蛋白表达的影响 荧光显微镜下观察,各组大鼠大脑皮质和海马区均可见P2X7受体免疫阳性细胞,阳性细胞胞膜和胞质呈红色。与假手术组相比,I/R组损伤侧大脑皮质、海马CA1区P2X7阳性表达细胞数明显增多(P<0.01);与I/R组相比,NaHS+I/R组损伤侧大脑皮质、海马CA1区P2X7阳性表达细胞数明显减少(P<0.01),见 Fig 2、3
3 讨论
脑缺血是导致老年人死亡和残疾的最常见的一种疾病,且随着人口老龄化,其发病率还有增加的趋势。目前治疗脑缺血最有效的方法是尽快恢复大脑的血液供应,临床上常采用药物或者介入手段改善脑血液循环,但在脑血流灌注恢复的过程中,由于钙超载、氧自由基过饱和等产生的兴奋性毒性作用会进一步加重脑组织的损伤,称为脑缺血/再灌注(ischemia/reperfusion,I/R)损伤。所以脑缺血治疗的研究不应只局限于如何恢复脑组织血液供给,也应该针对I/R损伤的机制采取措施。

Fig 1 Effects of NaHS on the volume percentage of cerebral infarction after cerebral ischem ia/reperfusion injury in rat(¯x±s,n=6)A:Brain sliceswith TTC staining;B:The volume percentage of cerebral infarction of rat in different groups.**P<0.01 vs sham-operated group;##P<0.01 vs I/R group.
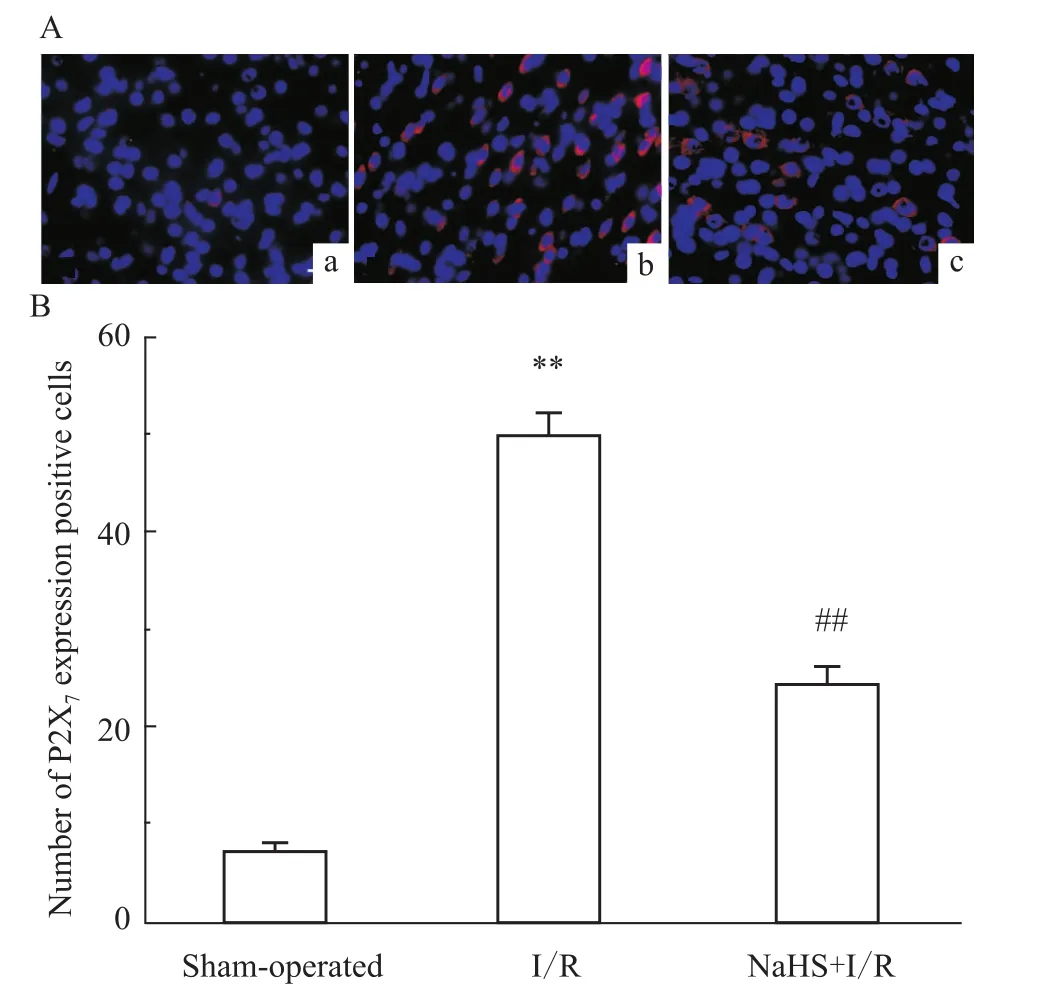
Fig 2 Effects of NaHS on expression of P2X7 receptor protein in cerebral cortex after cerebral ischem ia/reperfusion injury in rats(¯x±s,n=10)Cy3/DAPIdouble stained(×400,Scale bar=30μm)a:Shamoperated group;b:I/R group;c:NaHS(25μmol·kg-1) + I/R.**P<0.01 vs sham-operated group;##P<0.01 vs I/R group.

Fig 3 Effects of NaHS on expression of P2X7 receptor protein in the hippocampal CA1 area after cerebral ischem ia/reperfusion injury in rats(±s,n=10)Cy3/DAPIdouble stained(×400,Scale bar=30μm)a:Shamoperated group;b:I/R group;c:NaHS(25μmol·kg-1)+I/R.**P<0.01 vs sham-operated group;##P<0.01 vs I/R group.
P2X7受体是嘌呤能受体P2X家族中非常独特的一个亚型,是三磷酸腺苷(adenosine triphosphate,ATP)门控的阳离子通道,广泛分布于神经细胞。在正常情况下,胞外微摩尔水平的ATP可激活P2X7受体,选择性地引起Ca2+、Na+内流,细胞去极化,神经细胞产生正常的兴奋活动;然而脑缺血损伤时,损伤周围细胞外出现高浓度(数个毫摩尔水平)ATP聚集[5],P2X7受体在高浓度的细胞外ATP反复持久刺激下,可由阳离子通道转变为非选择性膜孔,其通透性明显增强,分子质量较大的有机阳离子均可通过,进而激发NO、钙超载、活性氧及炎性体的生成,导致细胞二次损伤甚至死亡[9],因此,认为P2X7受体可能在脑缺血后继发性损伤中起关键作用。本研究通过建立短暂性大脑中动脉栓塞模型,发现脑缺血2 h,再灌注24 h损伤侧脑皮质和海马CA1区P2X7受体蛋白表达明显高于假手术组,与王丽雁等[10]建立新生大鼠缺氧缺血性脑损伤的研究结果相一致,同时本实验还发现脑缺血2 h,再灌注24 h时可出现明显的神经功能缺陷和损伤侧脑组织的梗死灶,与王春燕等[11]研究结果一致,这些提示脑I/R损伤后P2X7受体蛋白的高表达,可能造成细胞稳态的改变,导致细胞二次损伤甚至死亡,这或许是引发脑I/R后神经功能缺陷和脑组织损伤的原因之一。另有研究发现,应用P2X7受体拮抗剂亮蓝G可明显降低氧糖剥夺引起的神经元死亡和MCAO后脑梗死体积[12]。因此,如何抑制P2X7受体的表达成为脑I/R损伤治疗的研究热点。
近年来的研究发现,哺乳类动物的许多细胞和组织都能产生H2S,它主要在胱硫醚-β-合成酶(cystathionineβ-synthase,CBS)、3-巯基丙酮酸转硫酶(3-mercaptopyruvate sulfurtransferase,3MST)和胱硫醚-γ-裂解酶(cystathionineγ-lyase,CSE)的作用下生成,CBS和CES主要以半胱氨酸为底物,通过转硫作用生成H2S,3MST可与半胱胺酸转氨酶共同作用,以L-半胱氨酸和α-酮戊二酸为底物生成H2S,其中CBS和3MST在神经系统中有表达,可使神经系统产生内源性H2S[13]。H2S在体内发挥着广泛的生物学效应,已有的研究表明,给予外源性H2S可对抗多种组织细胞的损伤而发挥保护作用[1-3],本实验室前期的研究发现,大鼠脑I/R 12 h大鼠海马、前脑皮质组织中H2S含量、CBS活性、CBSmRNA及CBS蛋白表达均明显高于假手术组,而脑I/R 24 h则均明显低于假手术组,脑I/R 48 h硫化氢含量恢复到正常水平;且H2S供体化合物NaHS(25 μmol·kg-1)对脑I/R引起的神经元损伤有保护作用[4]。本实验进一步观察了外源性H2S对脑缺血2 h,再灌注24 h时死亡率、神经功能缺陷评分、脑梗死体积及脑组织中P2X7受体蛋白表达的影响,结果发现NaHS+I/R组大鼠死亡率、神经功能缺陷评分及脑梗死体积明显低于I/R组,提示在脑I/R 24 h H2S/CBS体系下调的情况下,给予外源性H2S能明显减轻脑I/R损伤的程度;并且本实验还发现大鼠脑缺血2 h,再灌注24 h时,NaHS+I/R组损伤侧脑皮质和海马CA1区P2X7受体蛋白表达明显低于I/R组,这些提示H2S可能通过下调脑I/R损伤大鼠脑皮质和海马CA1区P2X7受体蛋白的表达,减轻脑I/R损伤,从而改善脑I/R损伤后大鼠的死亡率、神经功能缺陷评分和脑梗死体积,这可能是H2S发挥脑保护作用的机制之一,而这种保护机制是否通过调节脑I/R损伤后P2X7-Ca2+信号途径而起作用?这值得进一步研究。
参考文献:
[1] 孟金兰,陈雅嘉,陈 红,等.PI3K/Akt信号通路在硫化氢保护PC12细胞对抗化学性缺氧损伤的作用[J].中国药理学通报,2013,29(2):257-61.
[1] Meng JL,Chen Y J,Chen H,etal.Role of PI3K/Akt in protective effect of hydrogen sulfide against PC12 cells injuries induced by chemical hypoxia[J].Chin Pharmacol Bull,2013,29(2):257-61.
[2] 张可璇,毛洪雅,孟 雪,等.PI3K/Akt调节线粒体Cx43蛋白表达在H2S后处理离体大鼠心肌中的保护作用[J].中国药理学通报,2013,29(2):248-53.
[2] Zhang K X,Mao H Y,Meng X,et al.Cardioprotective effect of connexin 43 expression regulated by PI3K/Akton hydrogen sulfide postconditioning in isolated ischemic and reperfused rathearts[J].Chin Pharmacol Bull,2013,29(2):248-53.
[3] 张建新,丁艳艳,李兰芳,等.硫化氢对急性缺血所致心肌细胞凋亡的影响[J].中国药理学通报,2012,28(11):1602-7.
[3] Zhang JX,Ding Y Y,Li L F,et al.Effects of hydrogen sulfide on cardiomyocyte apoptosis induced by acutemyocardial ischemia in rats[J].Chin Pharmacol Bull,2012,28(11):1602-7.
[4] Ren C L,Du A L,Li D L,et al.Dynamic change of hydrogen sulfide during global cerebral ischemia-reperfusion and its effect in rats[J].Brain Res,2010,1345:197-205.
[5] Bai H Y,Li A P.P2X(7)receptors in cerebral ischemia[J].Neurosci Bull,2013,29(3):390-8.
[6] 方 芳,李 珍,王烈成,等.白藜芦醇预处理对局灶性脑缺血/再灌注大鼠海马CA1区神经元凋亡的保护作用和机制[J].中国药理学通报,2012,28(11):1544-8.
[6] Fang F,Li Z,Wang LC,etal.Protective effectsof preconditioning with resveratrol on focal cerebral ischemia/reperfusion induced neuronal apoptosis in rathippocampal CA1 region[J].Chin Pharmacol Bull,2012,28(11):1544-8.
[7] 陶 莉,望运玲,武双婵,等.丁香酚对大鼠局灶性脑缺血/再灌注神经保护作用的研究[J].中国药理学通报,2013,29(8):1146-50.
[7] Tao L,Wang Y L,Wu SC,etal.Neuroprotectiveeffectsofeugenol on cerebralischemia/reperfusion injury in rats[J].Chin Phar-macol Bull,2013,29(8):1146-50.
[8] 程 钢,秦媛媛,程 迪,等.氧化苦参碱对大鼠局灶性脑缺血损伤的保护作用及其抑制凋亡的作用机制[J].中国药理学通报,2013,29(3):387-92.
[8] Cheng G,Qin Y Y,Cheng D,et al.Protection of oxymatrine on focal crerebral ischemic injury in rats and itsmechanism of inhibition of opoptosis[J].Chin Pharmacol Bull,2013,29(3):387-92.
[9] Skaper SD,Debetto P,Giusti P.The P2X7purinergic receptor:from physiology to neurological disorders[J].FASEB J,2010,24(2):337-45.
[10]王丽雁,蔡文琴,陈鹏慧.P2X7受体在新生大鼠缺氧缺血性脑损伤后表达下调[J].第三军医大学学报,2009,31(22):2171-4.
[10]Wang L Y,CaiW Q,Chen PH.Downregulation of P2X7receptor expression in neonatal rats after hypoxic-ischemic brain damage[J].J Third Mil Med Univ,2009,31(22):2171-4.
[11]王春艳,黄 萍,张朕华.3β-双水杨酰薯蓣皂苷元对脑缺血/再灌注损伤大鼠的梗死体积及P13K/Akt信号通路的影响[J].中国药理学通报,2013,29(12):1672-5.
[11]Wang C Y,Huang P,Zhang Z H.Effects of 3β-double salicyloyl diosgenin on infarct volume and PI3K/Akt signal path in rats with focal cerebral ischemia/reperfusion injury[J].Chin Pharmacol Bull,2013,29(12):1672-5.
[12]Arbeloa J,Pérez-Samartín A,Gottlieb M,Matute C.P2X7receptor blockade prevents ATP excitotoxicity in neurons and reduces brain damage after ischemia[J].Neurobiol Dis,2012,45(3):954-61.
[13]Bucci M,Vellecco V,Cantalupo A,et al.Hydrogen sulfide accounts for the peripheral vascular effects of zofenopril independently of ACE inhibition[J].Cardiovasc Res,2014,102(1):138-47.