α突触核蛋白作用核苷酸序列的体外筛选研究
马开利,宋连昆,苑玉和,张 莹,李 莉,杨金玲,朱 平,陈乃宏
(1.中国医学科学院·北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,新药作用机制研究与药效评价北京市重点实验室,药理学研究室,北京 100050;2.中国医学科学院·北京协和医学院医学生物学研究所,云南昆明 650118)
α突触核蛋白(α-synuclein,α-syn)最早发现其定位于突触前末端及细胞核[1],随后的大量研究表明,α-syn的核定位存在于包括培养的细胞[2-3]、αsyn转基因果蝇[4]及小鼠[5]在内的各种实验系统内。近来的研究表明,α-syn的核定位可能在帕金森病的发病中发挥重要作用。Zhou等[6]的研究表明,α-syn的核转位增加能够引起多巴胺能细胞对氧化应激的敏感性增加。Boyer等[7]的进一步研究表明,α-syn引起的核聚集能够导致大鼠可卡因相关的行为发生变化。因此,α-syn的核转位可能是共核蛋白病的致病机制。
我们前期的研究表明,α-syn可同时存在于胞核和胞质中,进一步研究发现,α-syn能够在核输入蛋白importinα的介导下进入细胞核,通过影响细胞周期而发挥毒性作用[8]。为了进一步弄清α-syn在胞核内的作用,本研究拟从核内的核苷酸序列角度出发,应用圆二色谱(circular dichroism,CD)分析的方法,在体外筛选可能被α-syn作用的核苷酸序列,为阐明α-syn核内的作用机制奠定基础。
1 材料与方法
1.1 核苷酸序列合成 核苷酸序列(Tab 1)由Invitrogen公司合成,并溶解于CD缓冲液(40 mmol·L-1citrate pH 5.6,100 mmol·L-1NaCl,1 mmol·L-1EDTA),终浓度为100μmol·L-1。

Tab 1 O ligonucleotide sequence
1.2 圆二色谱分析 首先测定蛋白质和核苷酸序列的紫外(ultraviolet,UV)光谱,计算出储存液浓度,然后测定缓冲液相对于比色皿的UV吸收谱。综合分析得到数据,确定本实验中所用的蛋白和核苷酸序列的浓度。圆二色谱仪完成升温后,取干净比色皿加入缓冲液,放入仪器扫描基线值(波长范围230~410 nm),重复扫描两次,取平均值以降低噪声。基线扫描完成后,在相同条件下向比色皿中加入核苷酸序列溶液并进行色谱扫描。完成后,在相同条件下将蛋白与核苷酸序列的混合液注入比色皿,并进行色谱扫描。
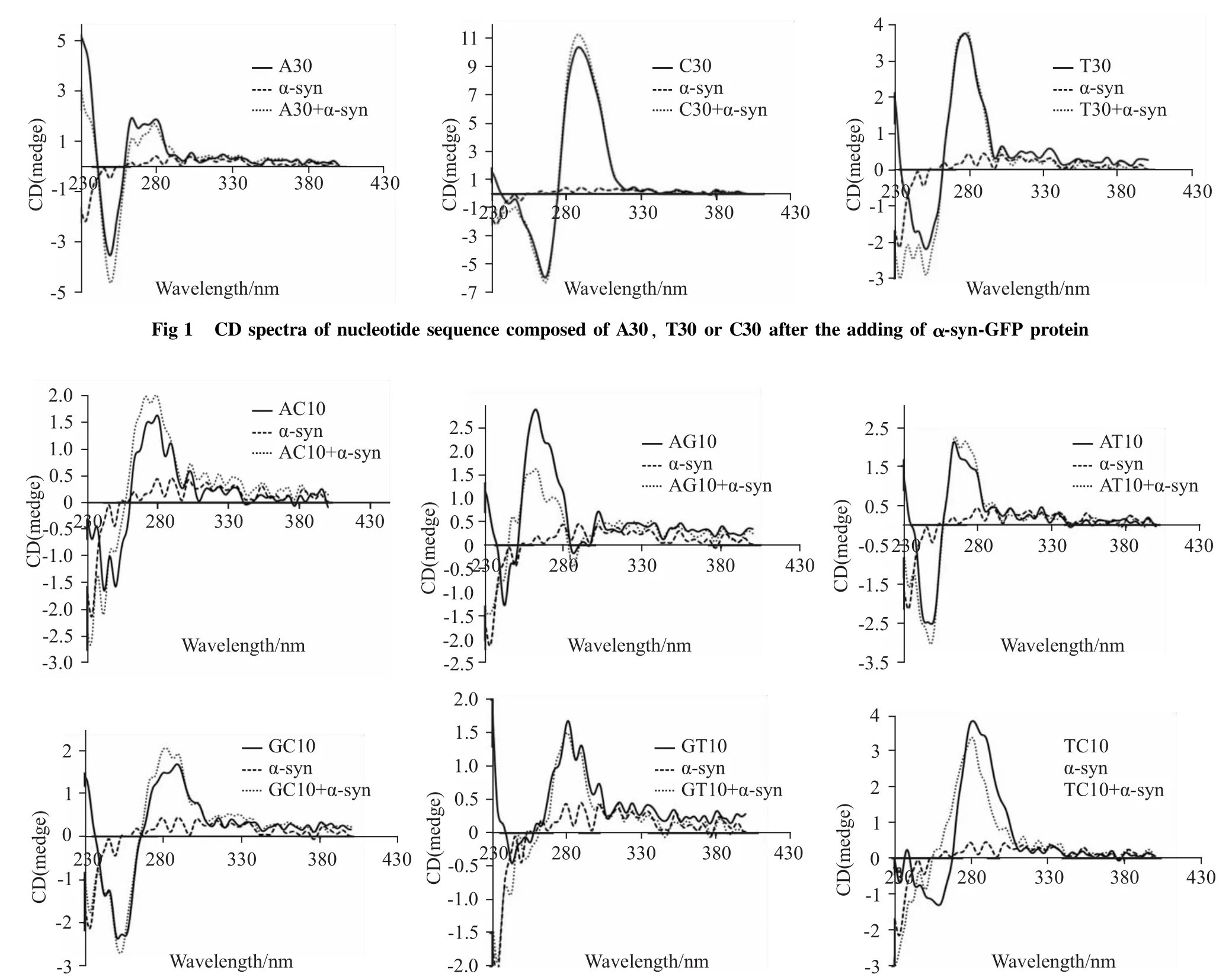
Fig 2 CD spectra of nucleotide sequence composed of AC10,AG10,AT10,GC10,GT10 or TC10 after the adding ofα-syn-GFP protein
2 结果
2.1 α-syn-GFP蛋白对含碱基A的序列有较强作用 从Fig 1可以看出,对于含碱基A的序列而言,α-syn-GFP蛋白的加入能够引起260~290 nm之间的色谱峰强度降低,而250 nm左右的色谱峰强度增加。因此,α-syn-GFP蛋白对含碱基A的序列有较强作用。而α-syn-GFP蛋白的加入仅使含碱基T的序列230~260 nm间的色谱峰稍有增加、含碱基C的序列290 nm左右的色谱峰稍有增加。因此,相对于含碱基A的序列来说,α-syn-GFP蛋白对分别含碱基T和C的序列的作用较弱。
2.2 α-syn-GFP蛋白对分别含碱基AG、TC的序列有较强作用 从Fig 2可以看出,对于含碱基AT、AC、GC和TC的序列而言,α-syn-GFP蛋白的加入,并未对色谱峰产生明显的影响,而α-syn-GFP蛋白的加入对分别含碱基AG、TC的序列的色谱峰有较大的影响。α-syn-GFP蛋白的加入导致含碱基AG的序列色谱峰在250~280 nm之间出现明显的降低,并且整个峰发生了蓝移。同样,对于含碱基TC的序列而言,α-syn-GFP的加入导致整个色谱峰亦发生了蓝移,且260~280 nm之间的峰强度有所降低。因此,α-syn-GFP蛋白与分别含碱基AG、TC的序列有较强作用。
2.3 α-syn-GFP蛋白对Kazak序列无明显作用从Fig 3可以看出,无论是Kazak1序列、Kazak2序列,还是它们之间相互组合所形成的序列,α-syn-GFP蛋白的加入均未对色谱峰产生明显影响,仅表现出小幅度的变化。
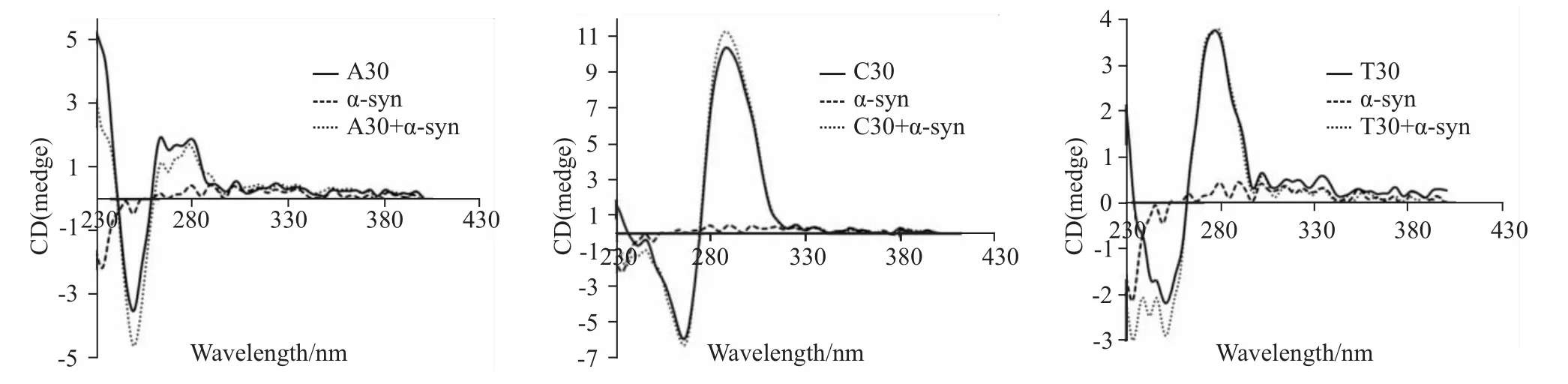
Fig 1 CD spectra of nucleotide sequence composed of A30,T30 or C30 after the adding ofα-syn-GFP protein
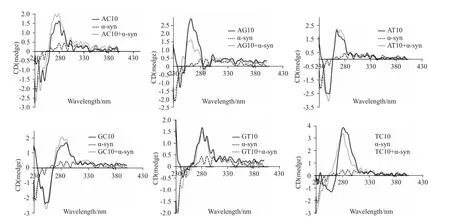
Fig 2 CD spectra of nucleotide sequence composed of AC10,AG10,AT10,GC10,GT10 or TC10 after the adding ofα-syn-GFP protein
2.4 α-syn-GFP蛋白对GC-box样序列有较强作用从Fig 4可以看出,α-syn-GFP蛋白的加入对CAAT-box及增强子样序列的作用亦较弱,而α-syn-GFP蛋白加入可导致GC-box样序列色谱峰270 nm处峰强度明显增加,推测可能是α-syn-GFP与GC-box样序列发生特异作用,引起GC-box样序列结构发生明显变化的结果。
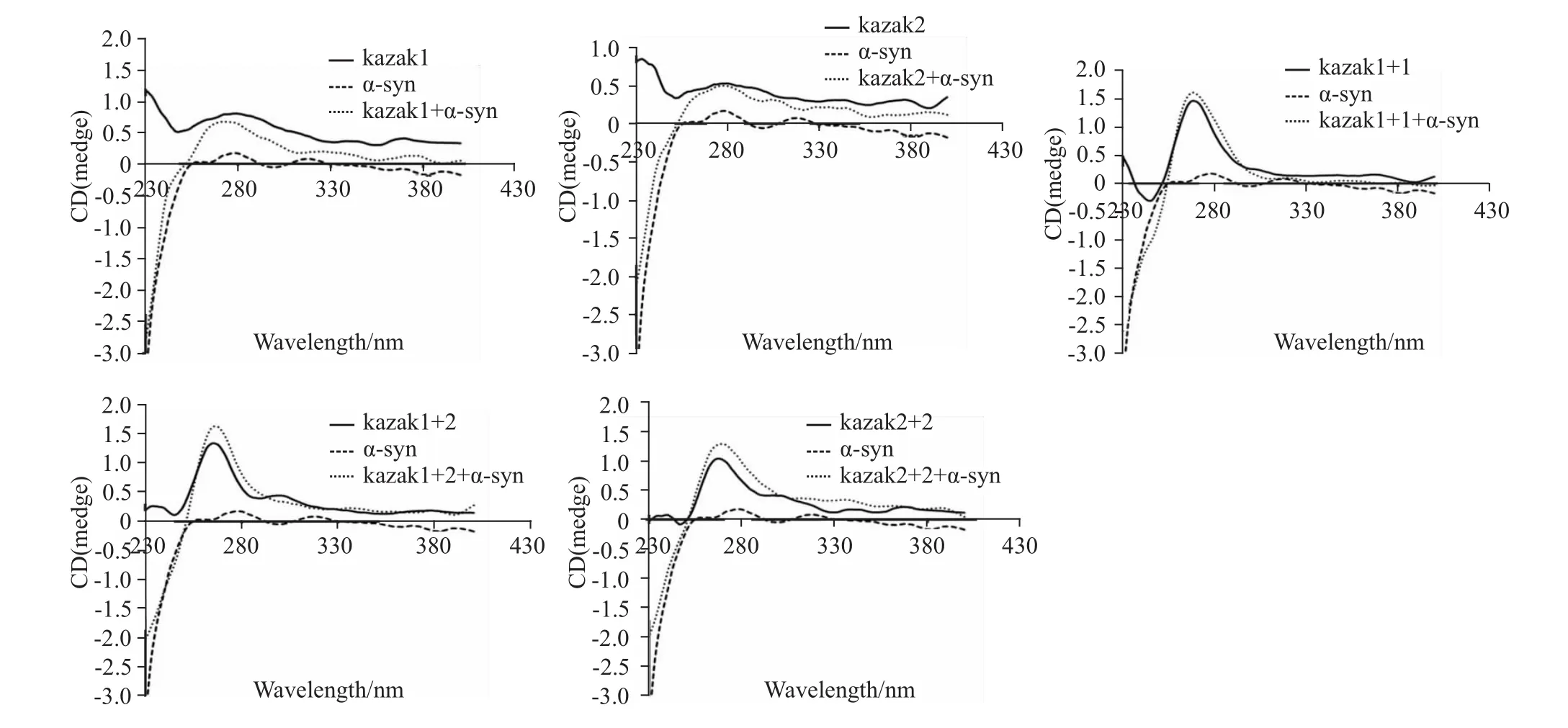
Fig 3 CD spectra of nucleotide sequence composed of Kazak1,Kazak2,Kazak1+1,Kazak1+2 or Kazak2+2 after the adding ofα-syn-GFP protein
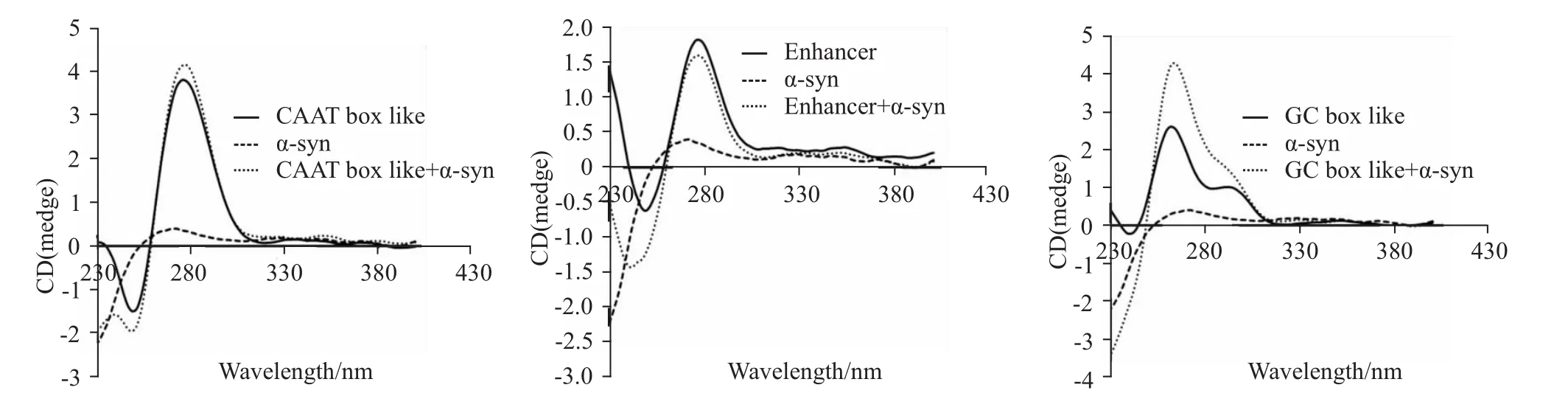
Fig 4 CD spectra of nucleotide sequence com posed of CAAT-box like,GC-box like or Enhancer after the adding ofα-syn-GFP protein
3 讨论
α-syn广泛分布于大脑神经元的细胞核内[1-2,5,9-10]。我们前期的研究表明,α-syn能够在importinα的介导下进入细胞核,并干扰细胞周期。因此,我们推测α-syn可能作用于细胞核内的某些核苷酸序列,从而对细胞周期产生了影响。在此我们主要从体外角度出发,寻找可能被α-syn作用的核苷酸序列的特征,由于前期α-syn核输入机制及功能的研究所用的α-syn蛋白均为与GFP融合的蛋白[8],我们已有研究表明,GFP蛋白的引入几乎不影响α-syn对核苷酸序列的作用。因此,为保证实验体系的一致性和研究的连续性,本研究选用经酵母表达并进行纯化的α-syn-GFP蛋白进行。
圆二色谱已被广泛应用于蛋白质的二级结构预测分析[11-12]。正常生理条件下,细胞内存在的核酸通常呈现出多种不同的构象[13]。近来的研究表明,核酸的结构参数与它们的圆二色谱峰之间存在相互关联的关系[14-15],核酸和蛋白紫外吸收谱的重叠可用于研究核酸-蛋白质间的相互作用。事实上,250~300 nm间的圆二色谱峰是由核酸的结构来决定的,因为在此波长范围内,相对于核酸而言,蛋白质芳香发射基团的作用是相对较弱的[16]。因此,本研究选择波长范围在250~300 nm间的圆二色谱峰的强度进行研究。
为了寻找可能被α-syn作用的核苷酸序列的特点,我们根据核酸组成及现有的相关顺式作用元件的特点,合成了一系列的单链核苷酸序列,应用圆二色谱分析α-syn蛋白对序列的影响,从中发现可能被α-syn作用的核苷酸序列的序列特点。
首先,我们分别合成了含30个碱基的序列,与α-syn-GFP蛋白混合后,用圆二色谱分析α-syn-GFP蛋白对序列的影响。由于核酸的结构变化主要表现为波长范围250~290 nm内色谱峰的变化,因此,我们把α-syn-GFP蛋白加入后250~290 nm范围内色谱峰的变化情况作为主要的观察范围。结果表明,对于含碱基A的核苷酸序列而言,色谱峰上270 nm左右的峰强度出现降低,而250 nm左右的峰强度则表现为增加。另外,α-syn-GFP对分别含碱基C或T的核苷酸序列的影响较弱,仅表现为290 nm或250 nm左右的峰强度稍有增加。因此,α-syn-GFP蛋白可能更倾向于影响含碱基A的核苷酸序列。
为了进一步获得可能被α-syn作用的核苷酸序列的特征,我们增加了核苷酸序列组合的复杂性,以两两碱基组合的方式合成了分别含有10对碱基AT、AG、AC、GT、GC、TC的核苷酸序列。圆二色谱分析结果表明,对于含AG的核苷酸序列而言,αsyn-GFP加入后色谱峰在270 nm左右的峰强度明显降低,而250 nm左右的峰强度则增加,并且整个峰出现了蓝移。同样,α-syn-GFP蛋白的加入也使含TC的核苷酸序列的色谱峰270 nm和250 nm左右的峰强度都有所降低,整个峰也出现了蓝移。因此,α-syn-GFP蛋白对分别含碱基AG或TC的序列有较强作用。然而,对于其余组合的核苷酸序列而言,色谱峰并无明显变化。
综合分析上述研究所得出的可能被α-syn-GFP作用的核苷酸序列的特点,我们推测CAAT-box样序列、Kozak序列、GC-box样序列、增强子序列等序列可能是α-syn-GFP主要作用的核苷酸序列。因此,我们分别合成了这些序列,并应用圆二色谱进行分析。结果表明,无论是Kozak1、Kozak2,还是这两种序列的组合,圆二色谱峰仅在波长270 nm时峰强度稍微有所增加。因此,α-syn-GFP对Kozak序列的作用不明显。对CAAT-box及增强子样序列而言,αsyn-GFP蛋白的加入亦未对其色谱峰产生明显影响,而α-syn-GFP蛋白的加入却导致GC-box样序列的色谱峰发生强烈的变化,表现为波长270 nm处峰强度明显增加,推测可能是α-syn-GFP与CAAT-box样序列发生了特异作用,从而导致GC-box样序列结构发生明显变化的结果。
综上所述,α-syn转位进入细胞核后可能通过作用于GC-box样序列,参与细胞核内的基因表达调控,从而发挥生理或病理作用。
参考文献:
[1] Maroteaux L,Campanelli JT,Scheller R H.Synuclein:a neuronspecific protein localized to the nucleus and presynaptic nerve terminal[J].JNeurosci,1988,8(8):2804-15.
[2] McLean P J,Ribich S,Hyman B T.Subcellular localization of alpha-synuclein in primary neuronal cultures:effect ofmissensemutations[J].JNeural Transm Suppl,2000,(58):53-63.
[3] Specht C G,Tigaret CM,RastG F,etal.Subcellular localisation of recombinant alpha-and gamma-synuclein[J].Mol Cell Neurosci,2005,28(2):326-34.
[4] Takahashi M,Kanuka H,Fujiwara H,et al.Phosphorylation of alpha-synuclein characteristic of synucleinopathy lesions is recapitulated in alpha-synuclein transgenic Drosophila[J].Neurosci Lett,2003,336(3):155-8.
[5] Goers J,Manning-Bog A B,McCormack A L,et al.Nuclear localization of alpha-synuclein and its interaction with histones[J].Biochemistry,2003,42(28):8465-71.
[6] Zhou M,Xu S,Mi J,et al.Nuclear translocation of alpha-synuclein increases susceptibility of MES23.5 cells to oxidative stress[J].Brain Res,2013,1500:19-27.
[7] Boyer F,Dreyer J L.Alpha-synuclein in the nucleus accumbens induces changes in cocaine behaviour in rats[J].Eur JNeurosci,2007,26(10):2764-76.
[8] Ma K L,Song LK,Yuan Y H,etal.The nuclear accumulation of alpha-synuclein ismediated by importin alpha and promotes neurotoxicity by accelerating the cell cycle[J].Neuropharmacology,2014,82:132-42.
[9] Gomez-Tortosa E,Newell K,Irizarry M C,et al.alpha-Synuclein immunoreactivity in dementia with Lewy bodies:morphological staging and comparison with ubiquitin immunostaining[J].Acta Neuropathol,2000,99(4):352-7.
[10]Zhang L,Zhang C,Zhu Y,et al.Semi-quantitative analysis of alpha-synuclein in subcellular pools of rat brain neurons:an immunogold electronmicroscopic study using a C-terminal specificmonoclonal antibody[J].Brain Res,2008,1244:40-52.
[11]Compton LA and Johnson W C,Jr.Analysis of protein circular dichroism spectra for secondary structure using a simplematrixmultiplication[J].Anal Biochem,1986,155(1):155-67.
[12]Lees JG,Miles A J,Wien F,et al.A reference database for circular dichroism spectroscopy covering fold and secondary structure space[J].Bioinformatics,2006,22(16):1955-62.
[13]Rich A.DNA comes in many forms[J].Gene,1993,135(1-2):99-109.
[14]Basham B,Schroth G P,Ho PS.An A-DNA triplet code:thermodynamic rules for predicting A-and B-DNA[J].Proc Natl Acad Sci USA,1995,92(14):6464-8.
[15]Scarlett G P,Elgar S J,Cary PD,et al.Intact RNA-binding domains are necessary for structure-specific DNA binding and transcription control by CBTF122 during Xenopus development[J].J Biol Chem,2004,279(50):52447-55.
[16]Cary PD,Kneale G G.Circular dichroism for the analysis of protein-DNA interactions[J].Methods Mol Biol,2009,543:613-24.