NDV 江苏分离株F基因的克隆与序列分析
王善辉,谢金文,王文秀,成子强
(1.江苏省徐州生物工程职业技学院,江苏 徐州; 2.山东省农业大学动物医学院,山东 泰安;3.山东省滨州畜牧兽医研究院重点实验室,山东 滨州 256600)
新城疫是由新城疫病毒(NDV)引起的禽类烈性传染病,可导致鸡群大量发病和死亡,世界动物卫生组织(OIE)将ND列为法定报告传染病。NDV是副黏病毒科,禽腮腺炎病毒属的成员,为有囊膜的单股、负链RNA病毒[1]。病毒基因组全长15 kb,编码6种蛋白,其中F蛋白是NDV主要糖蛋白之一,具有良好的免疫原性,能提供免疫保护作用。NDV复制时,病毒粒子产生无活性前体蛋白(F0),在宿主细胞蛋白酶作用下,F0前体裂解成两个由二硫键相连的多肽F1和F2[2],使子代病毒有感染性。F0裂解位点的氨基酸顺序直接影响其裂解能力,从而表现毒力的强弱[3-5]。为此,本研究对江苏省不同地区分离的NDV分离株JSXZ、JSSZ、JSLYG和JSHA株的F蛋白基因进行克隆测序,与国内外常见疫苗株进行核苷酸、氨基酸同源性比较,并绘制进化树,旨在进一步从分子水平上探索 NDV分离株与疫苗株和国内外毒株之间存在的遗传性关系,以进一步了解病毒的演化规律。
1 材料与方法
1.1 病毒、菌种和载体 所用NDV分离株JSXZ、JSSZ、JSLYG和JSHA株系分离于该地区的某鸡场产蛋鸡;大肠杆菌DH5α由本室保存;pMD18-T戴体购自Takara 公司。
1.2 主要试剂 Ex Taq DNA聚合酶、各种限制性内切酶、AMV反转录酶、RNA酶抑制剂、DNA Marker、dNTP、RNasin、DNA纯化回收试剂盒等购自宝生物工程(大连)有限公司;无特定病原体(SPF)鸡胚,购自山东省农业科学院家禽研究所;Trizol试剂、DEPC(焦碳酸二乙酯)购自上海生物工程有限公司。
1.3 引物设计与合成 根据国内外已发表的NDV F基因核苷酸序列,应用DNAMAN软件设计一对引物,在其易发生变异位点合成简并碱基。引物序列分别为:
P1:5'-ATGGGCTCY(C/T)AR(A/G)ATCTTCTACC-3’
P2:5'-CGTTCATR(G/A)CTY(C/T)TTGTR (A/G)GTGGCTCTC-3’
1.4 病毒增殖 取10日龄SPF鸡胚,尿囊腔接种病毒(每枚接种1000倍稀释病毒液100µL),37℃温箱孵育。收集接毒24h后死亡鸡胚的尿囊液,并测定其血凝效价,具体操作见文献[5]。
1.5 病毒RNA提取 分别取NDV分离株尿囊液各400µL,以10000r/min离心10min,取上清,加入等体积Trizol液,根据Trizol RNA提取试剂说明书提取病毒基因组。
1.6 F基因的RT-PCR扩增 将提取的RNA溶于DEPC水,加入引物P1,按AMV使用说明书进行反转录,灭活后进行PCR扩增,条件为:95℃预变性5 min; 95℃变性40 s,59℃退火40 s,72℃延伸2 min,30个循环扩增。
1.7 F基因的纯化和克隆 电泳后切胶回收PCR产物,具体操作见DNA纯化回收试剂盒说明书。然后与pMD18-T载体于16℃连接2h,转化后培养,PCR鉴定阳性克隆,摇菌提取质粒,酶切鉴定无误后送上海生工测序。
1.8 F基因序列测定与氨基酸序列分析 应用DNAMAN对所测得NDV地方株F基因序列与国内外有代表性参考毒株相应的核苷酸和氨基酸序列进行同源性比较和分析,应用DNAStar软件绘制遗传系统发育进化树。
2 结 果
2.1 分离株F基因cDNA 的RT-PCR扩增
从新城疫病毒分离株JSXZ、JSSZ、JSLYG和JSHA尿囊液中提取的RNA用RT-PCR方法进行扩增,经1%琼脂糖凝胶电泳分析,结果4株NDV分离株均扩增出一条约1662bp的特异性条带,与预期设计的扩增片段大小相符(图1)。
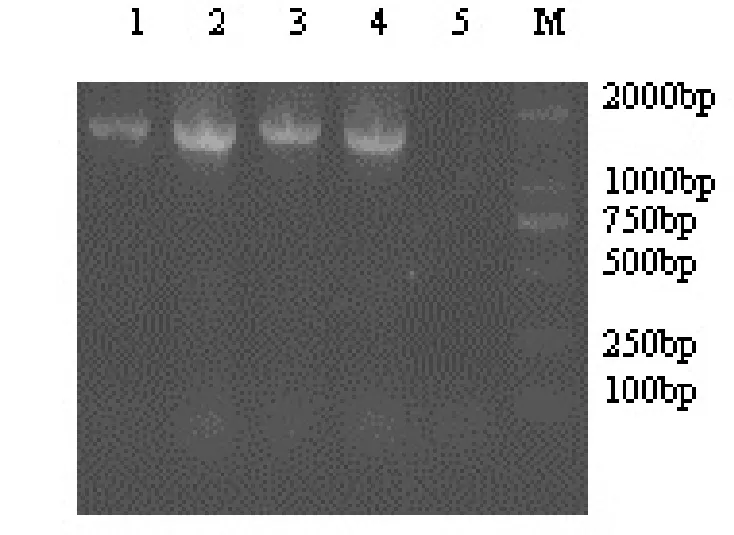
图1 NDV分离株F基因RT-PCR结果
2.2 分离株F基因重组质粒的鉴定
将重组质粒进行PCR鉴定,电泳结果显示扩增出一1662bp的片段,与RT-PCR的结果相一致(图2);将PCR鉴定大小相符的重组质粒再经BamHⅠ和Hind Ⅲ双酶切,可见两条大小分别为1662bp和2692bp左右的条带,与预期结果相一致,表明所扩增的F基因片段均已经定向克隆入载体中(图3)。

图2 NDV分离株F基因连T载体菌落PCR鉴定结果
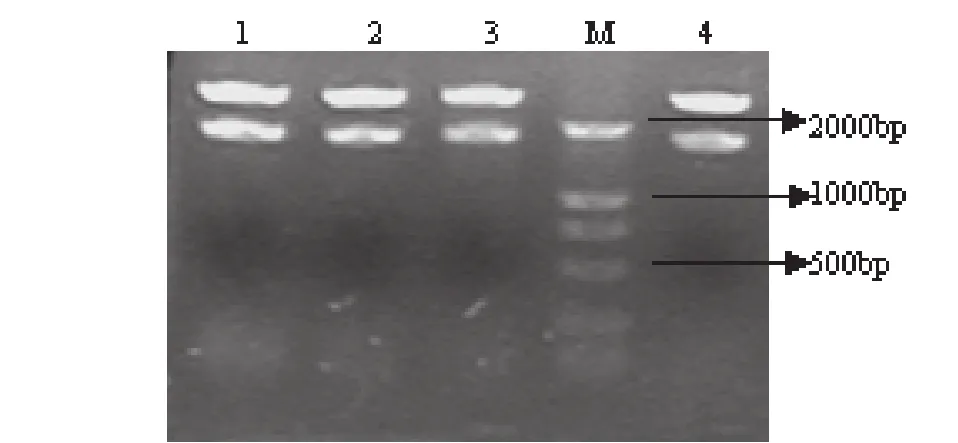
图3 NDV分离株F基因连T载体双酶切鉴定结果
2.3 F基因序列测定与氨基酸序列推导
重组质粒测序结果表明,4个分离株F基因均包含了完整的开放阅读框,共1662bp,编码553个氨基酸。应用DNAMAN软件推导出相应的氨基酸序列,发现在JSSZ和JSXZ 两个分离株在其裂解位点的氨基酸序列为112-R-R-Q-K-R-F-117,符合强毒株裂解区氨基酸组成的特征;而JSHA和JSLYG两个分离株的112至117位氨基酸序列与强毒株的征性氨基酸序列不相符,且与MDT和ICPI的测定结果相吻合。
2.4 F基因核苷酸及氨基酸序列同源性比较
4个NDV分离株F基因之间的核苷酸序列同源性不高,为73.3%~94.9%(平均87.65%);氨基酸同源性为74.2%~100%(平均85.96%);4个NDV分离株F基因与国内标准强毒株F 48E9株之间的核苷酸序列同源性较低,为57.3%~68.4%(平均64.83%),但氨基酸同源性稍高,为79.7%~83.9%(平均81.73%);4个NDV分离株F基因与常见疫苗株 LaSota株之间的核苷酸序列同源性也不高,为69.3%~80.8%(平均75.03%)。氨基酸同源性较差别较大,其中JSLYG株与LaSota株的氨基酸同源性较高,为98.3%;JSSZ株和JSHA株与LaSota株的氨基酸同源性分别为92.4%和92.7%;JSXZ株与LaSota株的氨基酸同源性最低,为78.2%。
2.5 F基因系统发育进化树分析
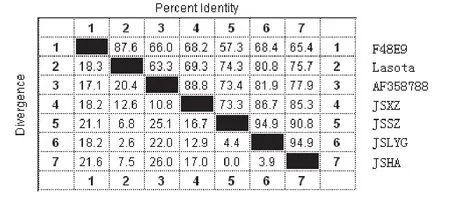
图4 NDV F基因核苷酸同源性比较

图5 NDV F基因氨基酸同源性比较

图6 NDV各分离株在系统发育进化树中的地位
应用DNA Star分析软件将获得的4株NDV分离株以及其他几十株国内外有代表性的 NDV毒株的F基因,均截为374bp(从ATG起~374bp)长度,绘制NDV F基因系统发育进化树(图6)。从进化树的结果来看,NDV可分为9个基因型(Ⅰ~Ⅸ),所克隆的4个分离株中,JSXZ株与登录号为AF358788的台湾分离株位于同一个分枝上, 与JSSZ株遗传关系最近,为基因Ⅷ型;JSLYG与JSHA株同在一个分支上,与Clone-30株遗传关系最近,为基因 Ⅸ 型,也是国内流行的基因型。
3 讨论
NDV F基因的遗传变异与NDV的变异和流行密切相关,是NDV分子流行病学研究的首选基因。F蛋白是构成NDV致病性的分子基础,NDV复制时,病毒粒子产生无活性前体蛋白(F0),在宿主细胞蛋白酶作用下,F0前体裂解成两个由二硫键相连的多肽F1和F2,使子代病毒有感染性。F蛋白能否被裂解取决于F蛋白的裂解位点区(112-117)处氨基酸组成和宿主细胞的特性,F0裂解位点碱性氨基酸残基的多少与病毒的毒力相关,由于强、弱毒株裂解位点的差异,使其对酶裂解的敏感性不同。本研究成功克隆了NDV JSXZ、JSSZ、JSLYG和JSHA毒株的F基因,将其克隆至pMD18 T载体中,并进行测序和遗传进化树分析。为从分子生物学角度分析江苏省新城疫病毒变异情况打下良好的基础,同时也为新城疫的诊断与防治方法的研究打下坚实的基础,为控制本病的蔓延提供了可靠的理论依据。从4个毒株的F基因测序结果,发现在JSSZ和JSXZ 2个分离株在其裂解位点的氨基酸序列为112-R-R-Q-K-R-F-117,符合强毒株裂解区氨基酸组成的特征;而JSHA和JSLYG两个分离株的112至117位氨基酸序列与强毒株的征性氨基酸序列不相符,且与MDT和ICPI的测定结果相吻合。
对所分离NDV的4个江苏分离毒株的F基因序列比对分析结果表明,4个毒株之间的核苷酸序列同源性不高,为73.3%~94.9%;4个毒株与常用国内标准强毒株F48E9株之间的核苷酸序列同源性较低,为57.3%~68.4%,说明分离毒株与标准强毒株F48E9株存在致病性差异;与常用疫苗株LaSota株之间核苷酸序列同源性也只有69.3%~80.8%,这揭示我国不同年代、不同省区分离的NDV毒株之间以及与疫苗毒株之间在基因水平存在较大差异,这种差异对氨基酸及蛋白质的结构和功能有一定影响,很可能是造成弱毒株免疫效果不确实的一个重要原因。
最初,研究者根据NDV F基因全长序列分析绘制系统发育进化树,随着研究的深入,人们发现F基因的1~374位的核苷酸序列具有很好的代表性,根据其绘制的进化树和全长序列绘制的完全一致,并且与当地的流行病学资料符合性很好,是进行ND分子流行病学研究的良好材料[6-8]。所以本研究以分离的4个NDV江苏毒株F基因的1~374bp的核苷酸序列绘制系统发育树,从进化树的结果来看,NDV可分为9个基因型(Ⅰ~Ⅸ),所克隆的4个分离株中,JSXZ株与AF358788的台湾分离株在同一个分支上,和JSSZ株遗传关系最近,为基因Ⅷ型[9];JSLYG与JSHA株同在一个分支上,与Clone-30株遗传关系最近,为基因 Ⅸ 型,也是国内流行的基因型。
[1]殷震,刘景华.动物病毒学[M]2版.北京:科学出版社,1997:737-741.
[2]袁萍,闫丽辉,成进,等.新城疫病毒分离株F基因的克隆与序列分析[J].动物医学进展,2009,30(3):50-54.
[3]Meng C, Qiu X, Jin S, et al.Whole genome sequencing and biological charac- terization of Duck/JS/10, a new lentogenic class I Newcastle disease virus[J].Arch Virol,2012,157(5):869-880.
[4]Tirumurugaan K G, Kapgate S, Vinupriya M K, et al.Genotypic and Pathotypic Characterization of Newcastle Disease Viruses from India[J].PLoS One,2011,6(12):1-6.
[5]曹殿军.我国部分地区NDV的分子流行病学研究[J].中国预防兽医学报,2001,23(1):29-32.
[6]黄小波.新城疫病毒强弱毒株鉴别方法的研究进展[J].中国兽医科技,2002,32(10):20-21.
[7]管宇,沈志强,刘吉山,等.NDV sdbz-99分离株的生物学特性及其基因的克隆与序列分析[J].中国预防兽医学报,2002,24(6):13-15.
[8]程相朝,李祥瑞,吴志明,等.不同时期NDV地方株F基因的克隆及序列分析与基因型研究[J].中国兽医学报,2006,26(5):491-494.
[9]肖跃强,沈志强,刘吉山,等.新城疫病毒SDWF2003株F基因的克隆与分子特征分析[J].中国预防兽医学报,2008,30(1):14-16.

