雪胆素乙诱导刀豆蛋白A刺激的小鼠淋巴细胞凋亡及其机制的研究*
胡 波, 施资坚, 王 遥, 刘坤鹏, 潘 浩, 尹良红△
(暨南大学1附属第一医院肾内科,2生命科学技术学院免疫生物学系,广东广州 510632)
雪胆素乙诱导刀豆蛋白A刺激的小鼠淋巴细胞凋亡及其机制的研究*
胡 波1, 施资坚1, 王 遥2, 刘坤鹏2, 潘 浩2, 尹良红1△
(暨南大学1附属第一医院肾内科,2生命科学技术学院免疫生物学系,广东广州 510632)
目的:分析雪胆素乙(CuIIb)对刀豆蛋白A(Con A)刺激的小鼠淋巴细胞体外凋亡的影响,并探讨其作用机制。方法:以Annexin V染色结合流式细胞术分析小鼠淋巴细胞凋亡情况;利用JC-1染色分析淋巴细胞线粒体膜电位变化;Western blotting检测凋亡相关蛋白变化。结果:CuIIb处理后,早期和中期凋亡细胞比例明显增加,淋巴细胞线粒体膜电位降低。同时,CuIIb以剂量依赖方式激活caspase-3凋亡通路并明显降低抗凋亡蛋白survivin的表达。结论:CuIIb诱导淋巴细胞凋亡,其机制可能与其降低线粒体膜电位、激活caspase-3凋亡通路有关。
雪胆素乙;淋巴细胞;刀豆蛋白A
雪胆素乙(cucurbitacin II b,CuIIb)是从葫芦科雪胆属植物雪胆(Hemsleya amalils Diels)中提取的一种四环三萜类化合物,是葫芦素家族的一个成员,化学名为23,24-双氢葫芦素F[1]。自古以来,我国西南各民族用雪胆治疗菌痢、肠炎、支气管炎、急性扁桃体炎等炎症相关疾病。作为民族药,其具有清热解毒、抗菌消炎的功效[2-3]。雪胆块根中提取物制备为雪胆素片(含雪胆素甲和乙)已在临床用于治疗菌痢和肠炎等疾病,但其抗炎作用的机制尚不清楚。前文以刀豆蛋白A(concanavalin A,Con A)激活的小鼠淋巴细胞为模型[4],发现CuIIb能有效影响淋巴细胞体外活化、增殖以及炎症因子的表达,但分子机制仍有待进一步研究。本研究以体外活化的小鼠淋巴细胞为模型,分析了CuIIb对活化小鼠淋巴细胞凋亡的影响,探讨其作用机制。
材料和方法
1 材料
清洁级BALB/c小鼠,雌性,6~8周龄,体质量(20±2)g,购自南方医科大学实验动物中心。CuIIb (纯度98%),购自上海顺勃生物技术公司。Con A和二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma-Aldrich。RPMI-1640、胎牛血清(fetal bovine serum,FBS)、L-谷氨酰胺和β-巯基乙醇购自 Gibco/Invitrogen。5,5',6,6'-tetrachloro-1,1',3,3'-tetraethyl-benzimidazolcarbocyanine iodide(JC-1)和 RNase A购自Carlsbad。Annexin V-PE凋亡检测试剂盒购自Becton Dickinson。CuⅡb用DMSO配制成0.02 mol/L的储存液,-20℃保存待用。半胱氨酸天冬氨酸蛋白酶3(caspase-3)、DNA双键断裂标志物H2AX(γ-H2AX)、多聚腺苷酸二磷酸核糖聚合酶[poly-(ADP-ribose)polymerase,PARP]、Bcl-2、survivin等抗体均购自Cell Signaling。
2 方法
2.1 小鼠淋巴细胞分离培养 颈髓脱臼处死小鼠,无菌分离小鼠颈部、腋下以及腹股沟淋巴结,置于盛有预冷的PBS的无菌平皿中,除去被膜,以200目尼龙网滤过,收集的细胞用PBS洗涤2遍(1 500 r/min离心5 min),用RPMI-1640完全培养基(25 mmol/L L-谷氨酰胺、1×105U/L青霉素、100 mg/L链霉素、50 μmol/L β-巯基乙醇和10%FBS)调整细胞密度为2×109/L,接种于24孔板中(每孔500 μL)在37℃、5%CO2条件下培养。
2.2 Annexin V-PE染色 收集不同浓度CuIIb处理24 h的淋巴细胞,用冷PBS洗2次,将细胞重悬于100 μL 1×结合缓冲液,加入5 μL Annexin V-PE和5 μL 7-AAD,25℃ 避光放置15 min,再加入300 μL的结合缓冲液,立即上机分析。
2.3 JC-1染色检测线粒体膜电位 各实验组培养24和48 h后,离心收集细胞,弃上清,用500 μL培养基重悬细胞,加入500 μL JC-1工作液,JC-1终浓度为2.5 mg/L,细胞培养箱中37℃ 避光孵育20 min,离心,弃上清,冷 PBS洗涤2次,再加入冷PBS 300 μL,重悬细胞,上流式细胞仪检测。
2.4 免疫印迹 收集 CuIIb(5和10 μmol/L)处理24 h的小鼠淋巴细胞,用RIPA裂解细胞获得总蛋白[5],随后取适量样品应用BCA试剂盒测量蛋白浓度。配制SDS-PAGE胶,每个样品上样40 μg蛋白,电泳后转移蛋白至PVDF膜。将膜转置5%脱脂牛奶室温封闭1~2 h,TBS+Tween洗膜3×5 min。加入以5%BSA稀释的I抗,置4℃摇床过夜。洗膜后再分别与相应的II抗(5% 脱脂牛奶稀释)室温孵育1 h,洗膜3次。最后用BeyoECL Plus化学发光试剂盒(碧云天)显色,X光片感光显影,FluorChem 800 (Alpha Innotech)成像仪记录结果并以Alpha EASE FC软件分析结果。
3 统计学处理
数据以均数±标准差(mean±SD),用GraphPad Prism 4.0软件进行单因素方差分析,组间比较采用Newman-Keuls检验,以P<0.05为差异有统计学意义。
结果
1 CuIIb引起活化的淋巴细胞凋亡
流式细胞术分析结果见图1,Con A刺激组凋亡细胞比例为39.92%,明显低于对照组;而2.5、5和10 μmol/L CuIIb均能明显增加凋亡细胞比例,与Con A组相比差异明显,并具有剂量依赖性。
2 CuIIb对小鼠淋巴细胞线粒体膜电位的影响
线粒体膜电位结果见图2,CoA组线粒体膜电位明显低于对照组(P<0.01);而与 Con A 组(37.96%)相比,Con A+10 μmol/L CuIIb组线粒体膜电位(45.29%)显著上升 (P<0.05),而CuIIb浓度度为2.5和5 μmol/L时线粒体膜电位与CoA组差异不显著。
3 CuIIb促进小鼠淋巴细胞caspase-3的活化
免疫印迹结果表明(图3),药物作用24 h后,10 μmol/L CuIIb能够明显促进caspase-3活化(即产生cleaved caspase-3)和γ-H2AX水平升高,表明在激活的淋巴细胞内,雪胆素乙诱导了DNA损伤。另外,PARP上升幅度不高,抗凋亡蛋白Bcl-2未受雪胆素乙处理的影响,而细胞周期调控的凋亡抑制蛋白survivin水平显著下调。这些结果表明,雪胆素乙通过诱导DNA损伤、抑制survivin表达来促进细胞凋亡。
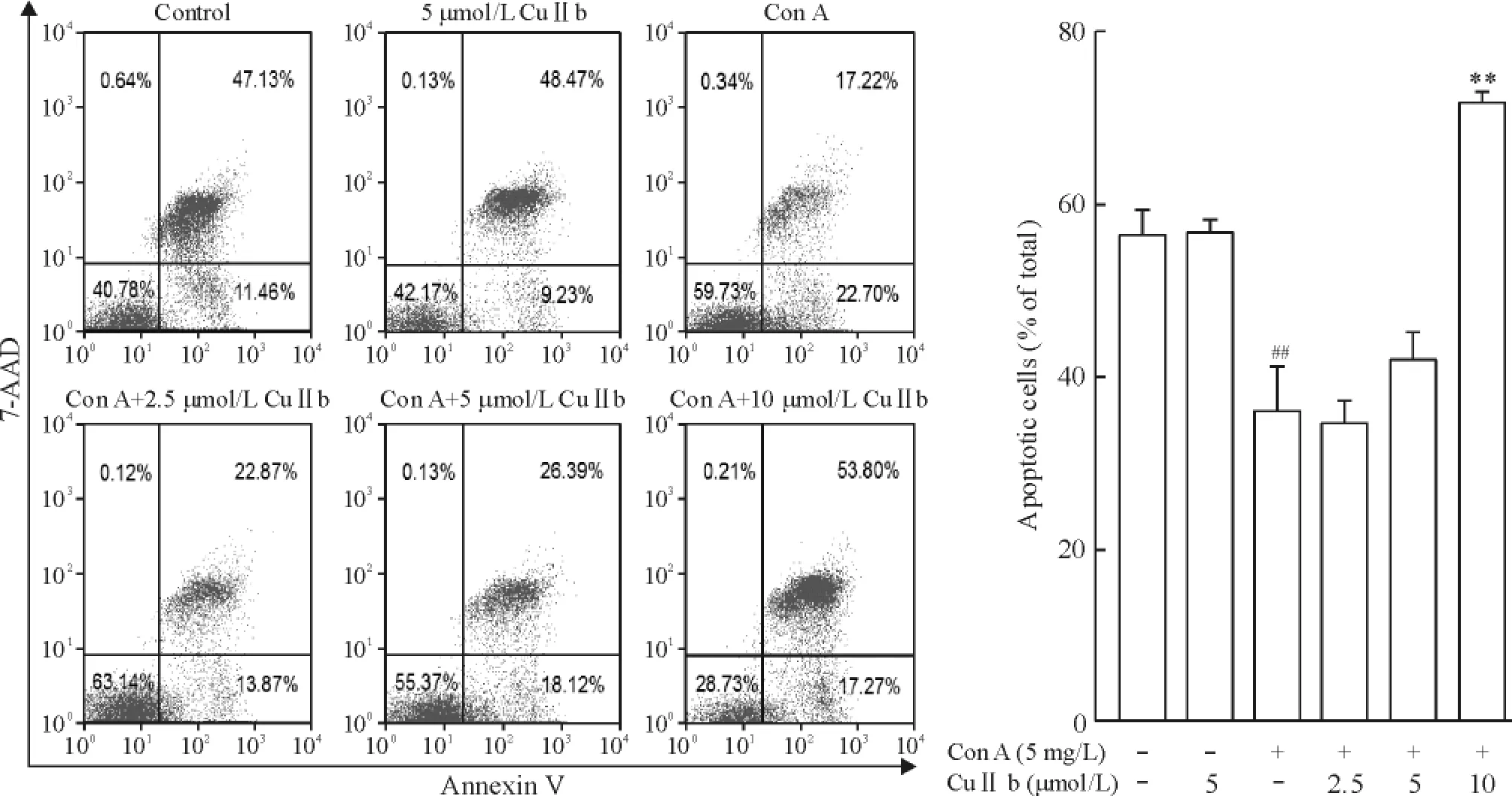
Figure 1.CuIIb induced apoptosis of Con A-stimulated mouse lymphocytes.Mean±SD.n=3.##P<0.01 vs control group;**P<0.01 vs Con A group.图1 CuIIb引起活化的小鼠淋巴细胞凋亡
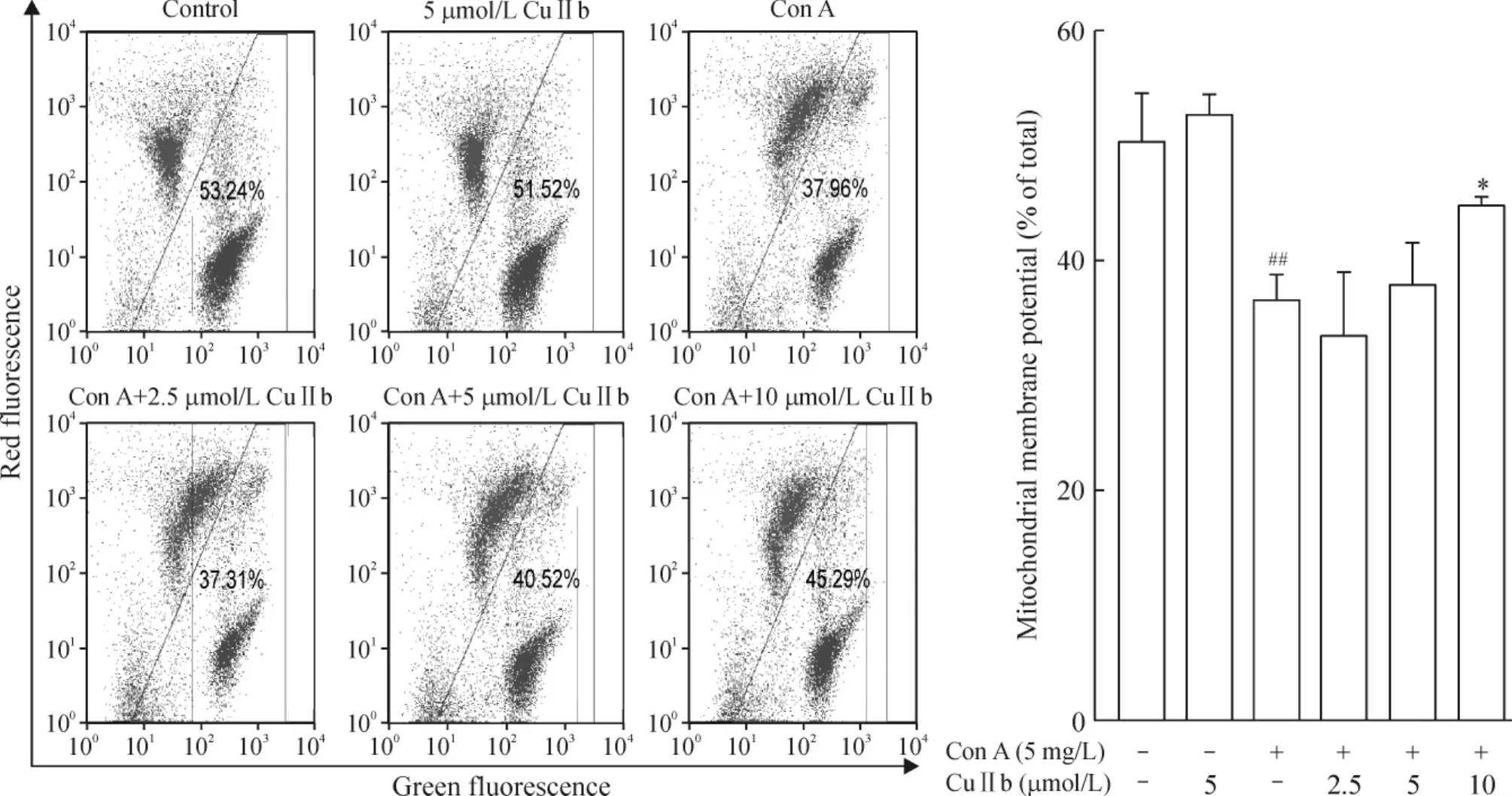
Figure 2.CuIIb induced cell apoptosis with reduced mitochondral membrane potential in Con A-stimulated mouse lymphocytes.Mean± SD.n=3.##P<0.01 vs control group;*P<0.05 vs Con A group.图2 CuIIb对小鼠淋巴细胞线粒体膜电位的影响
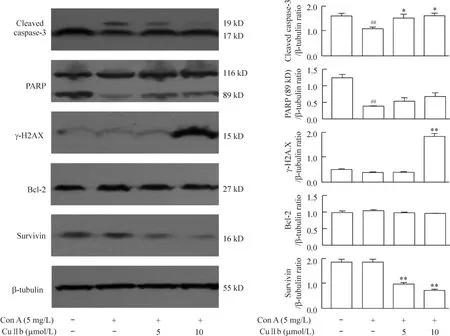
Figure 3.Effects of CuIIb on the levels of cleaved caspase-3,PARP,phosphorylated H2AX(γ-H2AX),Bcl-2 and survivin in Con A-stimulated lymphocytes.Mean±SD.n=3.##P<0.01 vs control group;*P<0.05,**P<0.01 vs Con A group.图3 CuIIb对小鼠淋巴细胞凋亡相关蛋白及survivin表达的影响
讨论
淋巴细胞在适应性免疫应答中发挥核心作用,淋巴细胞的活化、增殖及促炎因子的释放等细胞行为是免疫应答的基础和关键事件,在免疫防御、免疫调节、炎症发生及自身免疫疾病中都发挥重要作用。本研究表明CuIIb能够诱导T淋巴细胞凋亡,并可能与CuIIb以剂量依赖方式影响凋亡相关蛋白的表达有关,提示CuIIb抗炎可能与其诱导淋巴细胞凋亡有关。
Survivin是凋亡抑制蛋白家族的新成员,能直接抑制caspase-3和caspase-7的活性,阻断细胞的凋亡过程。目前研究认为可能是通过以下途径实现的: survivin能与激活的caspase-3和caspase-7结合,阻止由 caspase激活剂或凋亡诱导剂诱导的细胞DEVD-cleaving自杀酶的积累,抑制了caspase的级联反应,从而阻止肿瘤细胞凋亡[6];survivin也可通过p21间接抑制caspase,其机制可能为survivin与细胞周期调控因子CDK4形成survivin-CDK4复合体,使得p21从CDK4的复合体中释放出来,p21进一步与线粒体caspase-3结合,抑制其活性,阻止细胞凋亡[7]。我们的结果显示在Con A刺激活化的T淋巴细胞中,雪胆素乙处理后,淋巴细胞抗凋亡蛋白survivin的下调,促使caspase-3从复合体中释放,从而进一步提高其活化水平,促进了细胞的凋亡。
线粒体在诱导细胞凋亡中的作用已经被证实[8-10]。在特定凋亡诱导环境中,线粒体膜电位水平下调,导致膜通透性增加,启动凋亡相关的细胞色素C释放[11],线粒体膜电位水平下调与线粒体依赖性的早期凋亡相关。另外,当DNA损伤发生,H2AX被快速磷酸化,并招募其它修复因子聚集在损伤部位,因此被作为DNA双链断裂的标志[12-13]。本文结果显示雪胆素乙处理细胞后会提高DNA双键断裂标志物γ-H2AX的水平,表明在淋巴细胞中,雪胆素乙诱导细胞凋亡是通过刺激DNA双键断裂来实现的。同时,体外培养的淋巴细胞会发生自发性凋亡,因此未经Con A刺激的淋巴细胞也表达较高水平的活化caspase-3和PARP。Con A刺激可使淋巴细胞增殖,因此ConA的刺激降低了淋巴细胞的自发凋亡。
综上所述,CuIIb能够明显促进体外培养Con A活化的小鼠淋巴细胞凋亡,并通过CuIIb剂量依赖方式激活caspase-3凋亡通路并下调抗凋亡蛋白survivin表达。
[1]聂瑞麟,陈宗莲.雪胆属植物化学研究历史和现状[J].云南植物研究,1986,8(1):115-124.
[2]白 敏,李宏亮,徐贵丽.雪胆属植物化学成分及药理活性研究进展[J].昆明医学院学报,2012,33(1B): 177-180.
[3]Jayaprakasam B,Seeram NP,Nair MG.Anticancer and antiinflammatory activities of cucurbitacins from Cucurbita andreana[J].Cancer Lett,2003,189(1):11-16.
[4]王 遥,刘坤鹏,宋方茗,等.雪胆素乙对小鼠淋巴细胞体外活化及增殖的影响[J].免疫学杂志,2013,29 (3):190-194.
[5]王 斌,李悦山.硫氧还蛋白硝基化在多柔比星诱导的乳鼠心肌细胞凋亡中的作用[J].中国病理生理杂志,2013,29(8):1358-1364.
[6]Tamm I,Wang Y,Sausville E,et al.IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas(CD95),Bax,caspases and anticancer drugs[J].Cancer Res,1998,58(23):5315-5320.
[7]Suzuki A,Ito T,Kawano H,et al.Survivin initiates procaspase 3/p21 complex form ation as a result of interaction with Cdk4 to resist Fas-mediated cell death[J].Oncogene,2000,19(20):1346-1353.
[8]Shi Y.A structural view of mitochondria-mediated apoptosis[J].Nat Struct Biol,2001,8(5):394-401.
[9]Youle RJ,Karbowski M.Mitochondrial fission in apoptosis[J].Nat Rev Mol Cell Biol,2005,6(8):657-663.
[10]Tait SW,Green DR.Mitochondria and cell death:outer membrane permeabilization and beyond[J].Nat Rev Mol Cell Biol,2010,11(9):621-632.
[11]Wang H,Liu H,Zheng ZM,et al.Role of death receptor,mitochondrial and endoplasmic reticulum pathways in different stages of degenerative human lumbar disc[J].Apoptosis,2011,16(10):990-1003.
[12]Kuo LJ,Yang LX.Gamma-H2AX:a novel biomarker for DNA double-strand breaks[J].In Vivo,2008,22(3): 305-309.
[13]Lobrich M,Shibata A,Beucher A,et al.GammaH2AX foci analysis for monitoring DNA double-strand break repair:strengths,limitations and optimization[J].Cell Cycle,2010,9(4):662-669.
Cucurbitacin IIb induces apoptosis of concanavalin A-activated mouse lymphocytes
HU Bo1,SHI Zi-jian,WANG Yao2,LIU Kun-peng2,PAN Hao2,YIN Liang-hong1
(1Department of Nephrology,The First Affiliated Hospital,2Department of Immunobiology and Department of Cell Biology,College of Life Science and Technology,Jinan University,Guangzhou 510630,China.E-mail:yin-yun@126.com)
AIM:To explore the potential anti-inflammatory effect and the underlying mechanism of cucurbitacin II b(CuIIb)on concanavalin A(Con A)-activated mouse lymphocytes.METHODS:The cell apoptosis was analyzed by flow cytometry with Annexin V staining.The change of mitochondrial membrane potential was detected by JC-1 staining.The levels of caspase-3,phosphorylated H2AX and survivin were detected by Western blotting.RESULTS:Compared with Con A-activated lymphocytes,the significant increases in the proportion of the cells with reduced mitochondrial membrane potential or with increased Annexin V staining were observed,reflecting increased apoptosis in CuIIb plus Con A-treated cells.The increased levels of activated caspase-3 and phosphorylated H2AX(a marker of double-stranded DNA breaks)were manifested in Con A-activated cells co-treated with CuIIb.Although only a slight difference of cleavage of poly(ADP-ribose)polymerase was found in the cells with or without CuIIb treatment,the expression of survivin,an inhibitor of apoptosis protein,was markedly reduced by CuIIb in Con A-activated cells.CONCLUSION:CuIIb promotes apoptosis in mouse lymphocytes.
Cucurbitacin II b;Lymphocytes;Concanavalin A
R363
A
10.3969/j.issn.1000-4718.2014.03.021
1000-4718(2014)03-0509-05
2013-10-27
2014-01-10
科技部专项技术基金资助项目(No.2006AA02Z4D8)
△通讯作者Tel:020-38688502;E-mail:yin-yun@126.com

