宫颈处脱落滋养细胞用于孕早期产前诊断的初步研究
袁静 付娟娟 陈薇 方慧琴 丛林
(安徽医科大学第一附属医院产前诊断中心,安徽合肥 230022)
宫颈处脱落滋养细胞用于孕早期产前诊断的初步研究
袁静 付娟娟 陈薇 方慧琴 丛林*
(安徽医科大学第一附属医院产前诊断中心,安徽合肥 230022)
目的探讨使用差速贴壁法富集和纯化经宫颈采集的脱落滋养细胞在早孕期产前诊断中的应用价值。方法采用细胞刷法收集100例孕妇人工流产前由宫颈处取得的脱落滋养细胞,随机分为两组,一组采用差速贴壁法富集细胞为实验组,另一组为对照组,采用直接培养,比较两组最终的细胞总量及滋养细胞所占比率,采用FISH方法对两组标本进行检测并分析结果。对人流后的绒毛采用染色体核型分析判断性别。结果实验组细胞总量、滋养细胞所占比率均优于对照组,FISH检测结果中实验组45例检验成功并与绒毛检测结果相符,对照组29例检验成功并与绒毛检测结果相符。结论经宫颈获取胎儿滋养细胞为孕早期无创性产前诊断提供了一个可能途径,利用差速贴壁法可以富集并纯化滋养细胞,更利于用FISH行后续的产前诊断。
脱落细胞;产前诊断;早期妊娠;CK-7;荧光原位杂交;差速贴壁
产前诊断是降低出生缺陷、提高人口素质的重要手段之一,目前临床上产前诊断的主要手段是通过羊膜腔穿刺术或者脐静脉穿刺术获取胎儿标本后进行染色体核型分析[1,2]。这种方法操作有创、分析时间长,而且诊断时间限制在孕中晚期,孕妇的接受度低且不利于临床处理,所以寻找一种早期,无创而且快速的产前诊断方法成为了国内外的研究目标[3,4]。1971年Shettles[5]报道胎儿滋养细胞可以从胎盘脱落至宫颈管,并以此成功辨别胎儿性别后,宫颈管处胎儿滋养细胞用于产前诊断就被关注,只是宫颈处取材滋养细胞虽然能够获得,但是一来滋养细胞绝对量少,二来滋养细胞所占的比例小,往往混杂着其他大量的母体细胞[6]。所以,富集和纯化宫颈处的胎儿滋养细胞是一个需要解决的问题,本研究采用差速贴壁法为富集纯化滋养细胞做出初步的探索。
1 材料与方法
1.1 标本来源及分组 选取早孕并要求终止妊娠的100名妇女,实验组妊娠妇女符合以下条件:①要求终止妊娠;②超声确定为宫内妊娠,测量胚芽头臀长并合并末次月经确诊为孕8~10周;③禁性生活5天以上;④妇科检查可排除生殖器官炎症;⑤无阴道流血等先兆流产症状。应用细胞刷无菌取得的宫颈脱落细胞,100名妇女随机分为两组,一组采用差速贴壁法富集细胞为实验组;另一组采用直接培养为对照组,无菌取得所有孕妇的绒毛组织,留待常规方法细胞培养染色体核型分析。
1.2 实验方法
1.2.1 主要用品及试剂 一次性细胞刷(南京微创公司,套管直径2 mm)、无菌15 ml离心管、低速离心机、胶原酶B(美国Sigma)、4%多聚甲醛、苏木素-伊红染料、多聚赖氨酸(北京中杉)、1%曲拉通-100、小鼠抗人细胞角蛋白7(CK-7)单克隆抗体(北京中杉)、过氧化物酶标记的链霉卵白素(SP)染色试剂盒(北京中杉)、DAB显色液(北京中杉)、6孔培养板、Amnio MAXTM-Ⅱ-BM培养基(美国Gibco公司)、胰酶(美国Sigma)、秋水仙素(美国Sigma)、小牛血清、红细胞裂解液。
1.2.2 经宫颈取样方法 妇女取膀胱截石位,常规消毒外阴铺巾,暴露并消毒阴道和宫颈外口,用无菌干纱布擦净宫颈外口处粘液。
细胞刷法使用套管刷伸入宫颈,伸入时毛刷未伸出塑料软管,当套管刷头达到但未超过宫颈内口时,向前推动手柄1 cm,将毛刷伸出使得毛刷一部分刚过宫颈内口处,转动2圈后,拉动手柄将毛刷退入套管中再取出,移至3 mlPBS液的无菌试管充分涮洗。
1.2.3 样本处理及细胞差速贴壁 将收集到的细胞悬液放置在无菌的培养皿中,在倒置显微镜下观察以排除精子的污染。重新将液体移入无菌试管中,1500 rpm离心5分钟,沉淀细胞及黏液,小心弃上清。若倒置显微镜下见红细胞较多(达到107个/L)或离心后红细胞占标本量的一半以上,可以加入2 ml红细胞裂解液,室温下放置2~3分钟后1500 rpm离心5分钟,弃上清。加入1250 u/ml的胶原酶B 2 ml,放入温箱中15分钟,1500 rpm离心5分钟,弃上清,用2 ml培养液(Amnio MAXTM-Ⅱ-BM,Gibco)重悬细胞,移入6孔板中。在37℃的CO2培养箱中分别在放置1小时、2小时、3小时后,将原孔中(a孔)的上悬液移入另一空孔(b孔)中继续培养。
1.2.4 免疫细胞化学染色 目前尚无公认的对滋养细胞高度敏感的特异性标志物,从文献报道中筛选出一种对滋养细胞识别率较高的单克隆抗体,即抗CK-7作为一抗进行免疫细胞化学染色,镜下观察CK-7表达阳性的细胞。
1.2.5 绒毛组织培养及染色体核型分析 将绒毛组织置于无菌培养皿中,用含有双抗的PBS液冲洗2遍。用眼科剪剪取分支好的几只,用剪刀充分剪碎似糊状,加入1 ml 0.25%胰酶和1ml 1250 u/ml胶原酶,混匀后移入15 ml无菌离心管中。放在37℃培养箱中15分钟,取出后立即加入1 ml小牛血清终止消化。1500 rpm离心7分钟,弃上清,加入5 ml培养基重悬细胞并移入25 cm2的培养瓶中。将培养瓶放入37℃的5%CO2培养箱。收获细胞时加20μg/ml秋水仙素10 ul,3小时后用细胞刮刀收获细胞。将细胞悬液移入普通离心管中,离心10分钟(2000 rpm),去上清。加入预热37℃的0.075M KCl 8 ml,反复吹打沉淀物,水浴后加入新鲜配制的固定液(甲醇∶冰乙酸=3∶1)2 ml后混匀,静置5分钟后,2000 rpm离心10分钟,弃上清。重复固定2次(每次使用固定液8 ml)各30分钟。1小时后,2000 rpm离心10分钟,弃上清。常规滴片、显带、染统计学处理色及镜下分析。每例标本核型计数不少于30个,分析3个核型,异常核型计数加倍。
2 结 果
2.1 差速贴壁培养后细胞的情况 采用细胞刷法采集100名早孕妇女的宫颈分泌物中均有脱落滋养细胞。
2.1.1 实验组通过差速贴壁培养6天后,培养成功例数是47例,对照组48例培养成功。
2.1.2 培养后倒置显微镜下观察,Ⅰb孔中以成纤维细胞为主,细胞大多呈梭状,胞浆透明,胞核明显。细胞排列成放射状或漩涡状(见图1)。Ⅱb孔中滋养细胞相对较多,有时可见滋养细胞融合成团状,其间混有少量成纤维细胞(见图2)。Ⅲb孔中的细胞细胞量相对较少(图3)。培养后的细胞收集后,3组b孔的细胞用CK-7行免疫细胞化学染色,玻片上阳性细胞的比例不同,Ⅱb孔中的阳性细胞率相对较高(图4、5、6)。
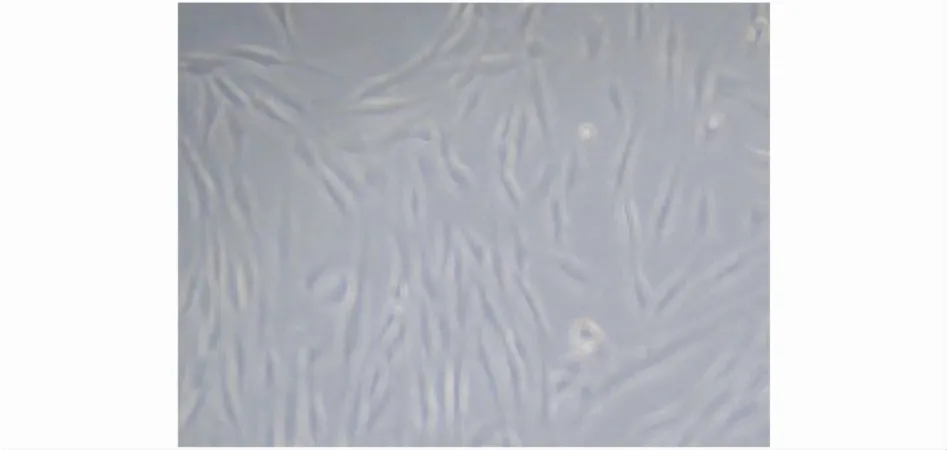
图1 Ⅰb孔中细胞

图2 Ⅱb孔中细胞
2.2 FISH实验的结果 应用于产前诊断的国产探针现有两组:CSP18/CSP X/CSP Y为一组,染色体数目正常的胎儿显示为两个蓝点/(女孩为两个绿点,男孩为一个绿点一个红点)(见图7、8);GLP13/ GLP 21为一组,染色体数目正常的胎儿显示为两个绿点/两个红点(图9)。
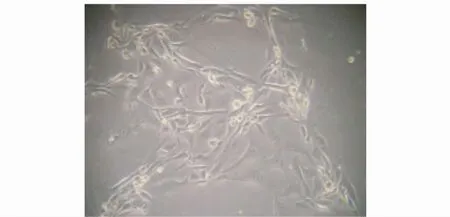
图3 Ⅲb孔中细胞

图4 Ⅰb孔中细胞

图5 Ⅱb孔中细胞

图6 Ⅲb孔中细胞
行FISH检测,结果显示标本和探针杂交良好,镜下观察见背景暗,细胞形态饱满,包膜完整清晰,荧光信号明亮清晰,100例均杂交成功,实验组45例检验成功并与绒毛检测结果相符,2例不符;对照组29例检验成功并与绒毛检测结果相符,19例不符。13、18和21号染色体的数目均正常。

图7 男胎的18/X/Y的FISH图片

图8 女胎的18/X/Y的FISH图片

图9 13/21的FISH图片
3 讨 论
使用无创或微创的方法采集到的标本中常混有母体细胞,而且收获阳性细胞率和阳性细胞数一般不太高,考虑到即使使用了高灵敏度的分子生物学方法,也不能确保诊断结果的正确性[7]。本实验中使用细胞刷经宫颈采集的标本中除了脱落的滋养细胞外,往往混有母体的血细胞、宫颈的上皮细胞、成纤维细胞等。目前纯化滋养细胞的方法有流式细胞仪分选法、免疫磁珠分选法、密度梯度离心法,主要是通过滋养细胞表面表达的较特异性的抗原或细胞体积及密度不同而将其分离出来。但往往获取的细胞量较少,且费用较高。差速贴壁法是纯化和富集细胞的一种方法。这种方法已经成功运用在嗅神经鞘细胞、脂肪源间充质干细胞等细胞的研究中[1,2]。我们将这种方法用于脱落滋养细胞的富集和纯化,一方面可以去除悬浮细胞,另一方面尽可能地去除成纤维细胞、宫颈上皮细胞对滋养细胞的影响,获得纯度较高的滋养细胞,这些含有胎儿全部信息的滋养细胞可以采用任何技术来检测,以用于产前诊断。
利用FISH技术快速分析羊水细胞以获取胎儿相关染色体信息目前在国外已被广泛采用[3,11]。Lau等[4]对1996~2004年1351个绒毛标本进行FISH检测,结果与传统染色体核型分析一致率为94%。已有研究显示,FISH用于产前诊断检测的敏感度和特异度均较高[5,14]。所以本实验在纯化和富集滋养细胞后,考虑用FISH在对其进行检测,一来检测速度快[15],二来本研究目的探讨宫颈处滋养细胞经差速贴壁后纯化细胞的效果,FISH检测性别可以作为纯化效果的指标。本研究两组病例均有标本FISH检测结果与绒毛染色体核型分析不符,其中实验组仅2例不符,而对照组有19例不符,这说明差速贴壁法富集和纯化细胞还是有一定作用的,会出现不相符的情况,可能是来自母体污染,也有可能是FISH技术本身与绒毛核型分析结果的差异造成,这有待于进一步的研究。
总之,差速贴壁法能够有效的富集和纯化细胞,但是为了确保后续诊断的可靠性,需要多寻找一些鉴别母儿细胞的方法,并尽量简单可行,从而使得早孕期产前诊断的可靠性和实用性会越来高。
[1]覃东琼、尼建平.超声引导羊膜腔穿刺术和脐静脉穿刺术产前诊断206例分析[J].中国误诊学杂志,2009,24:66-69.
[2]Alfirevic Z,Sundberg K,Brigham S.Amniocentesis and chorionic villus sampling for prenatal diagnosis[J].Database EBM Reviews-Cochrane Cochrane Database Syst,2007,(02):CD003252.
[3]Imudia AN,Suzuki Y,Kilburn BA.Retrieval of trophoblast cells from the cervical canal for prediction of abnormal pregnancy:a pilot study[J].Human Reproduction,2009,(09):2086-2092.
[4]Bulmer JN,Cioni R,Bussani C.HLA-G positive trophoblastic cells in transcervical samples and their isolation and analysis by laser microdissection and QF-PCR[J].Prenat Diagn,2003,(01):34.
[5]Shettles LB.Use of the Y chromosome in prenatal sex determination[J].Nature,1971,230(5288):52-53.
[6]高玉连,崔满华.孕妇生殖道滋养细胞的检测[J].中华妇产科杂志,2001,(03):172.
[7]付娟娟、丛林、袁静,等.孕早期经宫颈采集脱落滋养细胞的研究[J/CD].中国产前诊断杂志(电子版),2013,5(1):3-6.
[8]戴景兴,杨林林,曲戎梅,等.差速贴壁法分离培养脂肪源性充质干细胞[J].中国临床解剖学杂志.2007,25(3):313-316.
[9]田锋,姜曙祥,贺西京,等.经改良的取材和差速贴壁法培养纯化嗅黏膜嗅鞘细胞[J].细胞与分子免疫学杂志.2009,25(12):1189-1191.
[10]Arab S,Chitayat D,Gardner HA,et al.Mosaicism for a small marker chromosome resulting from a familiar Robertsonian translocation(21;22)[J].Clin Genet,1999,56(2)362-366.
[11]Ulmer R,Pfeiffer RA,Kollert A,et al.Diagnosis of aneuploidy with fluorescence in situ hybridization(FISH);value in pregnancies with increased risk for chromosome aberrations[J].Z Geburtshilfe Neonatol,2000,204(1):1-7.
[12]Lau Tze Kin,Leung Tak Yeung,Fung Tak Yuen,et al Outcome of 1355 consecutive transabdominal chorionic villus samplings in 1351 patients[J].Chin Med J(Engl),2005 118(20):1675-1681.
[13]Lee J,Stanley JR,Vaz SA,et al.Down syndrome with pure partial trisomy 21q22 due to a paternal insertion(4;21)uncovered by uncultured amniotic fluid interphase FISH[J]Am J Med Genet A,2005,132(2):206-208.
[14]Braha E,Martiniuc V,Panzaru M,et al.Prenatal diagnosis of gonosomal anomalies:limitations of the FISH method and genetic counseling difficulties in 15 cases[J].Rev Med Chir Soc Med Nat Iasi.2013 Apr-Jun;117(2):450-456.
[15]Sheth F,Andrieux J,Ewers E,et al.Characterization of sSMC by FISH and molecular techniques[J].Eur J Med Genet,2011,54(3):247-255.
ObjectiveTo explore the application value of cast-off trophoblast cells collected from the cervix enriched and purified through the differential adhesion method in the first trimester prenatal diagnosis.MethodThe cast-off trophoblast cells,collected with cytobrushes from the cervixes of 100 cases of pregnant women before induced abortion,were divided into two groups at random:one is the experimental group with cells enriched through the differential adhesion method;the other one is the control group cultivated directly.The final amounts of cells and the ratios of trophoblast cells in both groups were compared,the FISH method was applied to inspect both samples and analyze the results and the chromosomal karyotype analysis was performed on the villi after induced abortion to identify the sex.ResultsThe total amount of cells and the ratio of trophoblast cells in the experimental group were both superior to those in the control group.In the FISH inspection,45 cases in the experimental group were successfully inspected and consistent with the villus inspection,while in the control group only 29 cases were successful and consistent.ConclusionsThe collection of fetal trophoblast cells from cervix provides a feasible approach for the first trimester non-invasive prenatal diagnosis.The differential adhesion method can be applied to enrich and purify the trophoblast cells and benefit the follow-up diagnosis with the FISH method.
cast-off cells;prenatal diagnosis,early pregnancy;CK-7;fluorescence in situ hybridization;differential cohesion
R394.2
A
2014-08-06)
编辑:宋文颖
10.13470/j.cnki.cjpd.2014.04.002
安徽省科技攻关项目(08010302181)
*通讯作者:丛林,E-mail:conglin1957@163.com

