白藜芦醇对肝癌Bel-7404细胞体外放射治疗的影响
毕仁兵,郭德良,潘定宇,刘志苏,胡守国
(1.湖北省荆门市第一人民医院胆胰血管外科,荆门 448000;2.武汉大学中南医院肝胆胰外科,武汉 430071)
白藜芦醇对肝癌Bel-7404细胞体外放射治疗的影响
毕仁兵1,郭德良1,潘定宇2,刘志苏2,胡守国1
(1.湖北省荆门市第一人民医院胆胰血管外科,荆门 448000;2.武汉大学中南医院肝胆胰外科,武汉 430071)
目的 探讨白藜芦醇(Res)联合体外放射治疗(放疗)对肝癌Bel-7404细胞增殖、侵袭、凋亡的影响。方法25 μmol·L-1Res联合放疗处理肝癌Bel-7404细胞,并将细胞分为4组:对照组,2 Gy放疗组,4 Gy放疗组,6 Gy放疗组,噻唑蓝(MTT)法检测肿瘤细胞的增殖及运动侵袭能力,荧光显微镜检测细胞凋亡,Western-blot法检测细胞基质金属蛋白酶2 (MMP-2)、血管内皮生长因子(VEGF)蛋白表达情况。结果与对照组比较,2 Gy放疗组、4 Gy放疗组、6 Gy放疗组肝癌Bel-7404细胞增殖能力及侵袭能力均下降,凋亡细胞增多(P<0.05)。结论Res能增强肝癌Bel-7404细胞对放疗的敏感性,放疗联合Res可使肝癌细胞增殖受抑,侵袭减弱,凋亡增加,其原因与降低MMP-2、VEGF蛋白表达有关。
白藜芦醇;细胞凋亡;Bel-7404细胞;放疗增敏
原发性肝癌是最常见的实体器官恶性肿瘤之一,该病早期无明显典型症状,近90%的患者检出疾病时已属中晚期,丧失手术机会,仅15%~25%的肝癌患者有机会接受手术治疗[1-3]。因此放射治疗(放疗)、化学治疗(化疗)及术后综合治疗成为肝脏肿瘤学的研究热点。肝癌放疗的理论基础是肝癌组织在放疗中是早反应组织,即对放疗敏感,而正常肝组织属晚反应组织,数月后才表现出放射损伤。肝细胞对放射照射的耐受量低于肝癌细胞根治量,故常规放疗过程中不能兼顾正常组织并发症概率和肿瘤控制概率。联合应用放疗增敏药可以使低剂量放疗达到高剂量放疗的效果,间接降低肝损伤。白藜芦醇(resveratrol,Res)作为植物抵抗外界刺激如紫外线、真菌和病毒感染或机械损伤产生的一种多酚化合物,在花生、藜芦、葡萄等植物广泛存在[4-5]。20世纪90年代,JAYAFILAKE等研究认为,反式白藜芦醇和顺式白藜芦醇均可通过抑制蛋白质-酪氨酸激酶的活性发挥抗癌作用。后期研究发现,Res在肿瘤的启动、促进及发展阶段均表现出抑制甚至逆转肿瘤作用[6-7]。因此Res可能在肝癌的放疗中有增敏作用。笔者在本研究中观察Res对肝癌Bel-7404细胞体外放疗的影响,以期揭示该作用。
1 材料与方法
1.1 细胞 肝癌Bel-7404细胞株(购自武汉大学典型生物保藏中心,批号:100662-200401,传至第4代)。
1.2 药物与试剂 Res(购自美国Sigma公司,纯度> 95%,批号:111535,以无血清1640培养液稀释至0.01 mol·L-1,密封保存于4℃冰箱,使用前取适量以无血清1640培养液调配至所需浓度);兔抗人β-actin抗体(购自美国Sigma公司,批号:A5316);辣根过氧化物酶(Goat anti-chicken igh/HRP,HRP)标记的羊抗兔抗体(购自北京博奥森生物技术公司,批号: BSE-0310G);兔抗人基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2)抗体(批号:sc-205389)及兔抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(批号:sc-7218)购自美国Santacruz公司;Transwell侵袭小室购自美国Costar公司; AnnexinⅤ-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司(批号:20120417);超敏电化学发光(electro-chemi-luminescence,ECL)试剂盒购自上海碧云天生物技术公司(批号:P0006);蛋白提取试剂盒购自上海生工生物工程公司;Bradford蛋白浓度测定试剂盒购自上海碧云天生物技术公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(0.45 μm)购自美国Millipore公司(批号:k1ma4925uk)。
1.3 实验方法 以噻唑蓝(thiazolyl blue,MTT)比色法及荧光显微镜检测Res对肝癌Bel-7404细胞增殖及凋亡的影响。25 μmol·L-1Res用于联合放疗,将细胞分为4组:对照组、2 Gy放疗组、4 Gy放疗组、6 Gy放疗组。
照射方法:采用Varian 2100C型电子直线加速器,剂量率为400 cGy·min-1的6 MV X线,进行一次性照射。射线从细胞贴壁面垂直入射,并加垫厚度1.0 cm有机玻璃板。观察细胞生长状况,细胞处理后按常规培养方法继续培养24 h。
1.3.1 MTT比色法检测Res联合不同剂量放疗对肝癌Bel-7404细胞增殖影响 干预后按常规培养方法继续培养24 h后的细胞,MTT法测定存活率,酶标仪波长490 nm处测吸光度(A)值,重复3次。计算平均值,根据A值测定肝癌Bel-7404细胞存活率。存活率(%)=实验组A值/对照组A值×100%。
1.3.2 Transwell小室实验检测Res对肝癌Bel-7404细胞趋化运动性影响 取干预后按常规培养方法继续培养24 h的细胞,调整细胞浓度为5×105·mL-1,将各组细胞接种于96孔板,吸取细胞悬液200 μL加入Transwell小室上室。检测Res对Bel-7404细胞趋化运动性影响,100倍倒置显微镜下计数5个不同视野穿膜细胞数,取平均值,每组重复3次。
1.3.3 Transwell小室侵袭实验检测各组肝癌Bel-7404细胞侵袭能力 制备Transwell小室成功后,用移液枪吸取5×105·mL-1细胞悬液200 μL,加入Transwell小室上室,检测Bel-7404细胞侵袭能力,100倍倒置显微镜下计数5个不同视野穿膜细胞数,取平均值,每组重复3次。
1.3.4 荧光显微镜检测Res诱导肝癌Bel-7404细胞凋亡 取干预后按常规培养方法继续培养24 h后的细胞,冷磷酸盐缓冲液(phosphate buffered solution, PBS)洗涤盖玻片上细胞2次;在500 μL Binding Buffer中加入AnnexinⅤ-FITC/PI各5 μL;避光孵育后在荧光显微镜下用双色滤光片观察,AnnexinⅤ-FITC荧光信号呈绿色,PI荧光信号呈红色。
1.3.5 Western blot法检测MMP-2、VEGF蛋白表达变化 收集干预后按常规培养方法继续培养24 h的各组细胞,提取细胞总蛋白,变性后取40 μg,经10%聚丙烯酰胺凝胶电泳分离,将蛋白转移至PVDF膜上, 5%脱脂牛奶封闭1 h,加MMP-2(1∶200)、VEGF(1∶400)一抗4℃孵育过夜。用TBST洗4次,每次5 min。加二抗(1∶3 000),37℃孵育60 min。ECL化学发光检测目的蛋白信号。以β-actin为内参,利用灰度分析法检测蛋白条带的相对蛋白含量。
2 结果
2.1 Res联合放疗对肝癌Bel-7404细胞增殖的影响MTT比色法检测各组肝癌Bel-7404细胞增殖能力,对照组、2 Gy放疗组、4 Gy放疗组、6 Gy放疗组的A值分别为(0.451±0.018),(0.315±0.016),(0.227±0.009), (0.154±0.012)。与对照组比较,2 Gy放疗组、4 Gy放疗组、6 Gy放疗组肝癌Bel-7404细胞增殖能力明显降低(P<0.05),Res联合放疗对肝癌Bel-7404细胞增殖的抑制作用随放疗剂量的增加逐渐增强。
2.2 Res联合放疗对肝癌Bel-7404细胞趋化运动性影响 Res联合放疗能够抑制肝癌Bel-7404细胞的趋化运动性,对照组、2 Gy放疗组、4 Gy放疗组、6 Gy放疗组穿膜细胞数分别为(188.33±24.51),(163.00± 15.57),(147.67±12.51),(139.67±9.69)。与对照组比较,2 Gy放疗组、4 Gy放疗组、6 Gy放疗组肝癌Bel-7404细胞趋化运动性明显降低(P<0.05)。Res对肝癌Bel-7404细胞趋化运动性的抑制作用随放疗剂量的增加逐渐增强。
2.3 Res联合放疗对肝癌Bel-7404细胞侵袭能力的影响 Res联合放疗能够抑制肝癌Bel-7404细胞的侵袭能力,对照组、2 Gy放疗组、4 Gy放疗组、6 Gy放疗组的穿膜细胞数分别为(136.62±8.25),(121.50± 12.15),(99.25±14.02),(54.25±6.50)。与对照组比较,2 Gy放疗组、4 Gy放疗组、6 Gy放疗组肝癌Bel-7404细胞的侵袭能力明显降低(P<0.05)。Res对肝癌Bel-7404细胞侵袭能力的抑制随放疗剂量的增加逐渐增强。
2.4 Western blot法检测MMP-2、VEGF蛋白表达变化 与对照组比较,随着放疗剂量逐渐增加,肝癌Bel-7404细胞内MMP-2蛋白表达逐渐降低(图1),呈放疗剂量依赖性。VEGF蛋白表达量(图2)随放疗剂量增加也逐渐降低,呈放疗剂量依赖性。
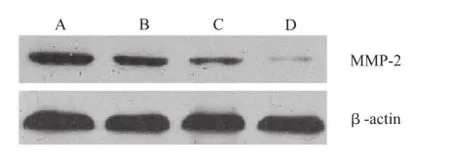
A.对照组;B.2 Gy放疗组;C.4 Gy放疗组;D.6 Gy放疗组图1 Western blot检测各组干预后对肝癌Bel-7404细胞MMP-2蛋白表达的影响A.control group;B.2 Gy radiation group;C.4 Gy radiation group;D.6 Gy radiation groupFig.1 Effect of treatment on MMP-2 protein expression in Bel-7404 cells detected by Western blotting
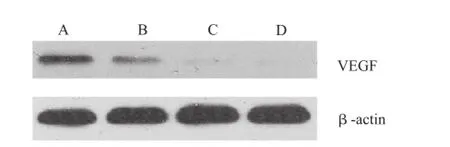
A.对照组;B.2 Gy放疗组;C.4 Gy放疗组;D.6 Gy放疗组图2 Western blot检测各组干预后对肝癌Bel-7404细胞VEGF蛋白表达的影响A.control group;B.2 Gy radiation group;C.4 Gy radiation group;D.6 Gy radiation groupFig.2 Effect of treatment on VEGF protein expression in Bel-7404 cells detected by Western blotting
2.5 荧光显微镜检测Res诱导肝癌Bel-7404细胞凋亡 AnnexinⅤ-FITC荧光信号呈绿色,PI荧光信号呈红色。因此,细胞染色呈单纯的绿色表明为早期凋亡,绿色和红色兼有表明为晚期凋亡,呈单纯的红色为死亡。见图3。
3 讨论
现代放射生物学认为,鉴别肿瘤细胞存活的标准不再是单个细胞的存活,而是其是否丧失了无限增殖的能力。不同细胞周期的细胞对电离辐射的敏感性不同,处于S期和G0期细胞对放射不敏感,M期和G2后期细胞最敏感[6]。因此通过外部因素调节细胞周期的长短以期获得较长的敏感窗口期可以增强放射治疗的效果。白藜芦醇可活化Caspasea,释放细胞色素C,抑制DNA聚合酶活性,诱导细胞凋亡,将细胞周期阻滞于S期和G2期[8]。
DELMAS等[8]进行的体外实验表明,Res对人HepG2及鼠Fao细胞的增殖均有抑制作用,Res可以促使更多的细胞滞留于G2/M期。同时,荷瘤大鼠实验[9]发现,其对肿瘤的抑制作用与G2/M时相细胞数增多及肿瘤细胞凋亡数增多有很大关系。
以Res作为放疗增敏药,观察其联合放疗对肝癌Bel-7404细胞的增殖、侵袭、凋亡的影响,结果显示放疗联合Res可以有效增强对肝癌Bel-7404细胞放射治疗的效果,肝癌Bel-7404细胞的增殖受抑,侵袭减弱,凋亡增加。这可能与Res促使更多的肿瘤细胞滞留于G2/M期,而此期的放疗敏感性较高有关。
MMP-2及VEGF均与肿瘤血管的生成、肿瘤的生长及转移密切相关[10-12],它们通过调节细胞粘附的作用,建立新的细胞与细胞之间、细胞与细胞外基质之间的粘附关系,促进肿瘤侵袭和转移[13],通过增加血管内皮细胞的增殖,促进新生血管的形成,加速肿瘤的生长[14-15]。研究已经证实,在肺癌、胃癌、宫颈癌等恶性肿瘤组织中均有MMPs及VEGF过表达现象[16]。

A.对照组;B.2 Gy放疗组;C.4 Gy放疗组;D.6 Gy放疗组图3 荧光显微镜检测Res联合放疗诱导肝癌Bel-7404细胞凋亡(×100)A.control group;B.2 Gy radiation group;C.4 Gy radiation group;D.6 Gy radiation groupFig.3 Cell apoptosis induced by Res combined with Radiation detected by Flurecenee Microscope(×100)
运用Western blot检测Res联合放疗对肝癌Bel-7404细胞MMP-2、VEGF蛋白的表达变化,MMP-2、VEGF蛋白的表达随放疗剂量的增加受抑制。以荧光显微镜检测Res联合放疗诱导肝癌Bel-7404细胞凋亡显示,随着放疗剂量的增加,凋亡细胞数量增加。因此,其对肝癌Bel-7404细胞的增殖能力、侵袭性的抑制及凋亡的诱导促进与MMP-2、VEGF蛋白的表达受抑相关。
综上所述,Res能促使更多的肿瘤细胞滞留于G2/ M期,增强肝癌Bel-7404细胞对放疗的敏感性。放疗联合Res可使肝癌细胞增殖受抑,侵袭减弱,凋亡增加,可能与MMP-2和VEGF蛋白的表达被抑制相关。
[1] BISMUTH H,MAJNO P.Hepatobiliary surgery[J].J Hepatol,2000,32(Suppl 1):208-224.
[2] WU K T,WANG C C,LU L G,et al.Hepatocellular carcinoma:Clinical study of long-term survival and choice of treatment modalities[J].World J Gastroenterol,2013, 19(23):3649-3657.
[3] SHIMADA K,SAKAMOTO Y,ESAKI M,et al.Analysis of prognostic factors affecting survival after initial recurrence and treatment efficacy for recurrence in patients undergoing potentiallycurativehepatactomyforhepatovellular carcinoma[J].Ann Surg Oncol,2007,14(8):2337-2347.
[4] GAMBINI J,LOPEZ-GRUESO R,OLASO-GONZALEZ G, et al.Resveratrol:distribution,properties and perspectives [J].Rev Esp Geriatr Gerontol,2013,48(2):79-88.
[5] PACE-ASCIAK C R,HAHN S,DIAMANDIS E P,et al. The red wine phenolics trans-resveratrol and quercetin block humanplateletaggregationandeicosanoidsynthesis: implications for protection against coronary heart disease [J].Clin Chim Acta,1995,235(2):207-219.
[6] KRAFT TE,PARISOTTO D,SCHEMPP C,et al.Fighting cancer with red wine?Molecular mechanisms of resveratrol [J].Crit Rev Food Sci Nutr,2009,49(9):782-799.
[7] 刘伟,于沛,王玉强.白藜芦醇衍生物的药理活性研究进展[J].医药导报,2010,29(7):901-904.
[8] DELMAS D,JANNIN B,CHERKAOUI MALKI M,et al. Inhibitory effect of resveratrol on the proliferation of human and rat hepatic derived cell lines[J].Oncol Rep,2000,7 (4):847-852.
[9] CARBO N,COSTELLI P,BACCINO F M,et al. Resveratrol,a natural product present in wine,decreases tumour growth in a rat tumour model[J].Biochem Biophys Res Commun,1999,254(3):739-743.
[10] TANG N,WANG L,ESKO J,et al.Loss of HIF-1 alpha in endothelial cells disrupts a hypoxia-driven VEGF autocrine loop necessary for tumorigenesis[J].Cancer Cell,2004,6 (5):485-495.
[11] KLEIN G,VELLENGA E,FRAAIJE M W,et al.The possible role of matrix metalloproteinase(MMP)-2 and MMP-9 in cancer,e.g.acute leukemia[J].Crit Rev Oncol Hematol,2004,50(2):87-100.
[12] M魻NIG S P,BALDUS S E,HENNECKEN J K,et al. Expression of MMP-2 is associated with progression and lymph-nodemetastasisofgastriccarcinoma[J]. Histopathology,2001,39(6):597-602.
[13] TRUDEL D,FRADET Y,MEYER F,et al.Significance of MMP-2expressioninprostatecancer:an immunohistochemical study[J].Cancer Res,2003,63 (23):8511-8515.
[14] KLUETZ P G,FIGG W D,DAHUT W L.Angiogenesis inhibitors in the treatment of prostate cancer[J].Exp Opin Pharmacother,2010,11(2):233-247.
[15] 刘芝兰,曾春娇,吴梅青,等.白藜芦醇与白皮杉醇及赤松素研究进展[J].医药导报,2013,32(8):1043-1049.
[16] DONG Y,LU B,ZHANG X,et al.Cucurbitacin E,a tetracyclic triterpenes compound from Chinese medicine, inhibitstumorangiogenesisthroughVEGFR2-mediated Jak2-STAT3 signaling pathway[J].Carcinogenesis,2010, 31(12):2097-2104.
DOI 10.3870/yydb.2014.11.011
Effects of Resveratrol Combined with Radiotherapy on Human Hepatoma Cell Line Bel-7404 in Vitro
BIRen-bing1,GUODe-liang1,PANDing-yu2,LIUZhi-su2,HUShou-guo1
(1.Departmentof Hepatopancreatobiliary Surgery,the First People's Hospital of Jingmen City,Hubei Province,Jingmen 448000, China;2.Department of Hepatopancreatobiliary Surgery,Zhongnan Hospital,Wuhan University,Wuhan 430071, China)
ObjectiveTo investigate the effects of radiotherapy combined with resveratrol(Res)on proliferation, invasion and apoptosis of hepatoma cell line Bel-7404.MethodsBel-7404 cell line was treated with Res(25 μmol·L-1) combined with radiotherapy,then divided into four groups(group 1:the control;group 2:radiation at dose of 2 Gy;group 3: radiation at dose of 4 Gy;group 4:radiation at dose of 6 Gy).Cell proliferation and invasion were detected by MTT assay.Cell apoptosis were observed by fluorescence microscopy.Expressions of MMP-2 and VEGF proteins were determined by Western blotting.ResultsCompared with the control group,cell proliferation and invasion were significantly inhibited,while cell apoptosis was increased in all radiation groups(P<0.05).ConclusionThe sensitivity of hepatoma Bel-7404 cells to radiation can be enhanced by resveratrol.Radiation therapy combined with resveratrol can inhibit proliferation and invasion of hepatoma cells and increase the cell apoptosis,which may be related with the down-regulation of MMP-2 and VEGF proteins.
Resveratrol;Apoptosis;Hepatoma cells Bel-7404;Radiotherapy sensitization
R286;R965
A
1004-0781(2014)11-1442-04
2013-08-18
2013-09-20
毕仁兵(1979-),男,湖北石首人,主治医师,硕士,研究方向:肝胆胰恶性肿瘤综合治疗。电话:0724-2305775,E-mail:4346193@qq.com。
胡守国(1963-),男,湖北荆州人,主任医师,学士,研究方向:肝胆胰恶性肿瘤综合治疗。电话:0724-2305771,E-mail:guoxueshi@gmail.com。

