十字孢碱对人胆管癌QBC-939细胞增殖和凋亡的影响
何政,郑军
(湖北省宜昌市中心人民医院普通外科一病区,宜昌 443002)
十字孢碱对人胆管癌QBC-939细胞增殖和凋亡的影响
何政,郑军
(湖北省宜昌市中心人民医院普通外科一病区,宜昌 443002)
目的 探讨蛋白激酶C(protein kinase C,PKC)抑制药十字孢碱(STS)对人胆管癌QBC-939细胞增殖和凋亡的影响及其机制。方法采用CCK-8法检测STS对QBC-939细胞增殖的影响;透射电子显微镜观察STS对QBC-939细胞超微结构的影响;流式细胞术检测STS对QBC-939细胞凋亡率和周期分布的影响;蛋白质印迹法检测STS对QBC-939细胞周期蛋白cyclin B1、细胞周期蛋白依赖性激酶(Cdk1)和磷酸化周期蛋白依赖性激酶(p-Cdk1)表达的影响。结果STS能显著抑制QBC-939细胞的增殖(P<0.05),抑制作用呈浓度依赖性,对QBC-939细胞的半数抑制浓度(IC50) 24 h为334 nmol·L-1,48 h为118 nmol·L-1。透射电镜观察发现,STS能诱导QBC-939细胞出现典型的凋亡小体。Annexin V-FITC/PI双标法检测0,12,24和48 h凋亡率分别为(10.16±4.52)%,(22.35±2.19)%,(34.27±2.30)%和(59.70±5.97)%。流式细胞术检测发现,与对照组相比,STS可显著诱导QBC-939细胞凋亡率增加(P<0.05),并引起G0/G1期细胞比例减少,而G2/M期细胞比例增加(P<0.05)。蛋白质印迹法检测发现,经STS处理后的QBC-939细胞cyclin B1和Cdk1蛋白表达明显降低(P<0.05),而p-Cdk1蛋白表达则明显增加(P<0.05)。结论STS可显著抑制人胆管癌QBC-939细胞增殖并诱导其凋亡,其机制可能是通过阻滞细胞周期于G2/M期,进而抑制QBC-939细胞生长并促进细胞凋亡。
十字孢碱;蛋白激酶C抑制药;胆管癌;细胞周期;凋亡;QBC-939细胞
胆管癌是胆道系统常见的恶性肿瘤,近年来其发病率有明显增高的趋势[1]。由于胆管癌特殊的解剖部位以及缺乏早期有效的诊断标志物,大多数胆管癌在最终明确诊断时已属中晚期,失去根治性切除的机会,因此患者预后极差[2]。蛋白激酶C(protein kinase C,PKC)是一种钙激活和磷脂酶依赖的丝氨酸/苏氨酸蛋白激酶,PKC通过磷酸化一系列底物进而参与细胞内广泛的生物学效应,其对细胞的增殖、分化、凋亡和运动等过程均有一定调节作用[3]。同时,越来越多的研究表明,PKC在人类多种肿瘤中存在异常激活,是肿瘤细胞维持其恶性生物学表型的重要信号分子[4]。十字孢碱(staurosporine,STS)是从微生物中分离出的一种生物碱,是已知化合物中最强PKC抑制药。研究发现,STS具有潜在的抗肿瘤活性,能抑制多种人类肿瘤的生长并促进其凋亡。但STS对胆管癌细胞的影响笔者未见文献报道。笔者在本研究以人胆管癌QBC-939细胞为研究对象,观察STS对胆管癌细胞增殖、凋亡等的影响,并对其机制进行初步探讨。
1 材料与方法
1.1 试剂 人胆管癌细胞系QBC-939购自中国科学院上海细胞库;RPMI 1640培养液和胎牛血清购自美国Gibco公司;CCK-8试剂盒(CK04)购自日本Dojindo公司;碘化丙啶(propidium iodide,PI,批号:P4170)、RNA酶(RNase A,批号:R4642)和PKC抑制药STS (批号:S5921)购自美国Sigma公司,STS用二甲亚砜(dimethyl sulfoxide,DMSO)配制成浓度为1 mmol·L-1的原液并储存于-20℃,实验时根据需要用RPMI 1640培养液将原液稀释成不同浓度的工作液;Annexin V/FITC凋亡检测试剂盒(批号:V13241)购自美国Invitrogen公司;RIPA裂解液(批号:P0013B)、2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:P0010)购自上海碧云天生物技术有限公司;兔抗人cyclin B1、周期蛋白依赖性激酶(Cdk1)和p-Cdk1(pY15)单克隆抗体购自美国Epitomics公司;鼠抗人β-actin单克隆抗体及辣根过氧化酶(HRP)标记的二抗购自武汉谷歌生物科技有限公司。
1.2 仪器 酶标仪型号ELX800(美国Biotek公司);透射电镜型号Tecnai G2 F20 S-TWIN(美国FEI公司);流式细胞仪型号为FACScan(美国BD公司)。
1.3 细胞培养 细胞采用含有10%胎牛血清的RPMI 1640培养液,常规在37℃、5%二氧化碳的细胞培养箱中培养,0.25%胰酶消化、传代,取对数生长期细胞进行实验。
1.4 细胞增殖活性的测定 采用CCK-8法检测,将对数生长期QBC-939细胞以2.0×105个·mL-1密度接种于96孔培养板中,每孔200 μL置于培养箱中培养,待细胞完全贴壁后吸去培养液,分别加入含10,25, 50,100,250和500 nmol·L-1STS的培养液200 μL,并设立不加任何处理的对照组,继续培养24和48 h后,每孔加入CCK-8溶液10 μL作用4 h,于酶标仪波长450 nm处测定吸光度(A)值。计算细胞的存活率和抑制率。细胞存活率(%)=药物处理组平均A值/细胞对照孔平均A值×100%;细胞抑制率(%)=(1-药物处理组平均A值/细胞对照孔平均A值)×100%。同时根据抑制率计算出细胞的半数抑制浓度(half inhibitory concentration,IC50)。
1.5 电镜下观察细胞超微结构的变化 将处于对数生长期的QBC-939细胞传代于50 mL培养瓶中常规培养,待细胞长至约80%融合度时吸去培养液,分别加入浓度为250 nmol·L-1STS和不含STS的完全培养液,继续培养24 h;消化收集细胞后,立即置于2.5%戊二醛溶液中预固定,0.1 mol·L-1磷酸盐缓冲液(phosphate buffered solution,PBS)清洗3次,过夜;其后以1%鹅酸溶液固定,丙酮逐级脱水,环氧树脂包埋,超薄切片,经铀和铅双重染色后,于透射电子显微镜下观察细胞超微结构的变化。
1.6 Annexin V-FITC/PI双标法检测细胞凋亡 将处于对数生长期的QBC-939细胞以每孔2×105个接种于6孔板,待细胞完全贴壁后吸去培养液,用浓度为250 nmol·L-1的STS培养液分别处理细胞0,12,24和48 h,随后按照凋亡试剂盒说明书进行操作,流式细胞仪检测细胞凋亡情况。
1.7 流式细胞术检测细胞周期 将处于对数生长期的QBC-939细胞以每孔2×105个细胞密度接种于6孔板,待细胞完全贴壁后吸去培养液,用浓度为250 nmol·L-1的STS培养液分别处理细胞0,12,24和48 h,随后消化、收集细胞,用4℃预冷的PBS洗2次,并重悬细胞于PBS 200 μL,缓慢加入预冷的无水乙醇1 mL,于-20℃固定过夜;之后离心收集细胞,4℃预冷的PBS洗2次,并重悬于PBS 500 μL中,分别加入终浓度为50 μg·mL-1的RNA酶(RNase A)及PI,室温避光反应30 min后上流式仪检测细胞周期分布。采用CellQuest和ModFit软件分析实验结果。
1.8 蛋白质印迹 将处于对数生长期QBC-939细胞接种于6 cm的培养皿中,待细胞完全贴壁后吸去培养液,用浓度为250 nmol·L-1STS培养液分别处理细胞0,12和24 h;消化收集细胞,加入含有蛋白酶抑制剂的RIPA裂解液,冰上孵育20 min后于4℃,12 000×g离心15 min。上清液即为细胞总蛋白。按照BCA法蛋白定量试剂盒说明书测定蛋白浓度,以50 μg蛋白上样量进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecylsulfatepolyacrylamidegel electrophoresis,SDS-PAGE)凝胶电泳,电泳结束后将胶上蛋白电转至聚偏氟乙烯(polyvinylidene fluoride, PVDF)膜上;5%脱脂奶粉室温封闭2 h;分别加入一抗(稀释比例均为1∶500)于杂交袋中4℃孵育过夜;次日用三羟甲基氨基甲烷聚山梨酯(TBS-T)洗涤缓冲液洗膜3次,每次15 min,二抗(1∶3 000)室温孵育1 h; TBS-T洗膜3次,每次10 min;采用电致化学发光(electrochemiluminescence,ECL)法进行显色、曝光。用图像分析软件Image J进行灰度分析;以目的蛋白与内参照蛋白的相对表达量进行半定量分析。
1.9 统计学方法 上述实验均重复3次,采用SPSS 15.0版软件作统计处理,计量数据以均数±标准差(±s)表示。不同处理组间差异采用单因素方差分析,组间两两比较采用Dunnett-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 STS对QBC-939细胞增殖活性的影响 CCK-8检测结果表明,STS对QBC-939细胞的生长有显著抑制作用,且这种抑制作用呈明显的浓度和时间依赖性(图1)(F=37.85,P<0.01)。STS对QBC-939细胞的IC5024 h为334 nmol·L-1,48 h为118 nmol·L-1。

图1 CCK-8法检测STS对QBC-939细胞增殖活性的抑制作用Fig.1 Inhibitoryeffectofstaurosporineoncell proliferation of QBC-939 cells detected by CCK-8 assay
2.2 STS对QBC-939细胞形态学的影响 透射电镜下观察可见,未用STS处理的QBC-939细胞形体较大,胞质均匀且含有丰富的线粒体、内质网等细胞器,核质均匀,无明显染色质边集;而在250 nmol·L-1STS作用24 h后,可见QBC-939细胞体积缩小,其内可见线粒体、内质网等细胞器肿胀明显,数量减少,同时细胞核内染色质高度浓缩并边集于核膜下呈新月形,有的出现核固缩和核碎裂等凋亡变化,脱落后形成凋亡小体。见图2。
2.3 STS对QBC-939细胞凋亡率的影响 采用Annexin V-FITC/PI双标法检测细胞凋亡率。结果显示:250 nmol·L-1STS分别作用QBC-939细胞0,12, 24和48 h后,其凋亡率分别为(10.16±4.52)%, (22.35±2.19)%,(34.27±2.30)%和(59.70± 5.97)%。表明随着药物作用时间的延长,细胞凋亡率亦逐渐上升,实验组与对照组比较,差异有统计学意义(F=81.08,P<0.01)。见图3。
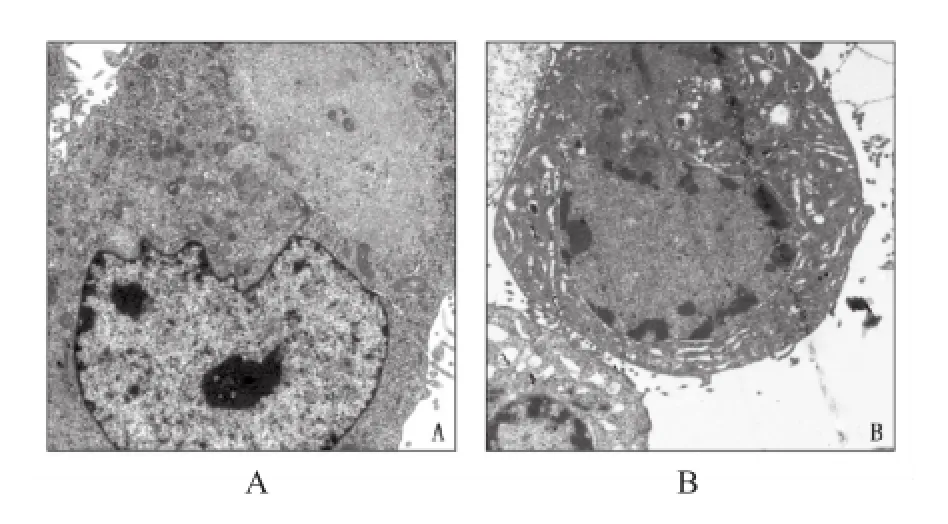
A.QBC-939细胞;B.250 nmol·L-1STS作用的QBC-939细胞图2 透射电子显微镜下观察STS对QBC-939细胞超微结构的影响(×1 700)A.QBC-939 control cells;B.250 nmol·L-1STS treated QBC-939 cellsFig.2 Effect of staurosporine on ultrastructure of QBC-939cellsdetectedbytransmissionelectronmicroscopy (×1 700)
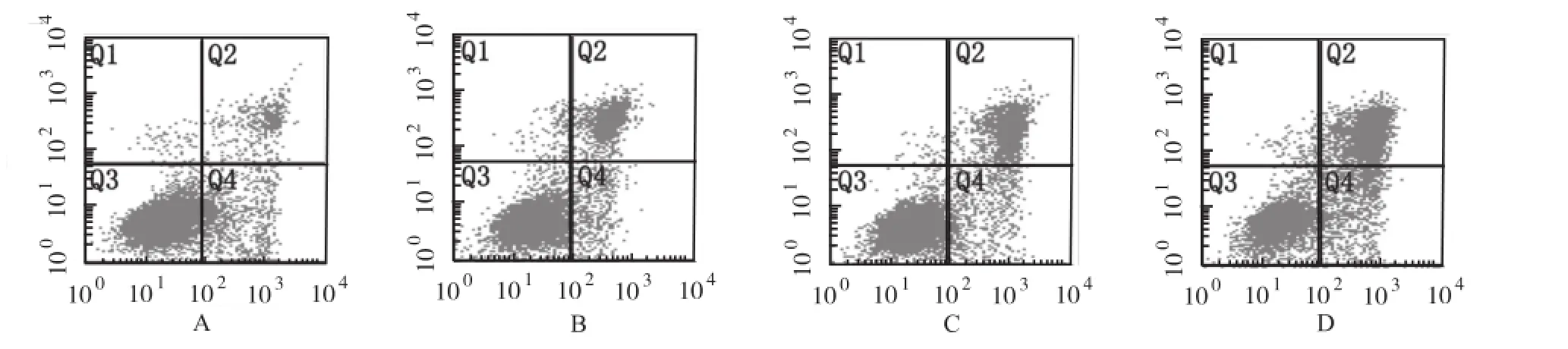
A.0 h;B.12 h;C.24 h;D.48 h图3 流式细胞术检测STS对QBC-939细胞凋亡率的影响A.0 h;B.12 h;C.24 h;D.48 hFig.3 Effect of staurosporine on apoptotic rate of QBC-939 cells detected by flow cytometry
2.4 STS对QBC-939细胞周期的影响 250 nmol·L-1的STS作用QBC-939细胞0,12,24和48 h后流式细胞术检测细胞周期,结果显示:药物作用12和24 h后, QBC-939细胞的S期比例依次下降(F=698.0,P<0.01),同时G2/M期比例依次增加(F=136.8,P<0.01),而G0/G1比例无明显变化;当STS作用48 h后引起了QBC-939细胞显著的凋亡,周期分布与空白对照组比较差异无统计学意义(P>0.05)。见表1。
表1 流式细胞术检测STS作用不同时间对QBC-939细胞周期的影响Tab.1 Effect of STS on cell cycle of QBC-939 cells detected by flow cytometry %,±s

表1 流式细胞术检测STS作用不同时间对QBC-939细胞周期的影响Tab.1 Effect of STS on cell cycle of QBC-939 cells detected by flow cytometry %,±s
与0 h比较,*1P<0.01Compared with 0 h,*1P<0.01
时间/hG0/G1SG2/M 凋亡率066.79±4.0623.09±1.0810.12±2.983.73±0.63 1266.03±1.1812.24±0.23*121.74±0.95*115.59±1.84 2460.97±2.628.27±0.56*130.78±2.07*122.74±2.77 4871.22±0.4720.03±0.818.76±0.3355.88±5.06
2.5 STS对QBC-939细胞周期蛋白的影响 蛋白质印迹法检测结果显示,250 nmol·L-1的STS作用12和24 h后,与对照组比较,cyclin B1和Cdk1蛋白表达水平逐渐降低(P<0.05),而p-Cdk1蛋白表达水平则逐渐增加(P<0.05)。见图4。
3 讨论
胆管癌的发生和发展受多种因素影响,其中细胞周期的调节异常在胆管肿瘤的恶性增殖过程中起重要作用[5-6]。PKC广泛分布于真核细胞中,具有多个亚型,在细胞的信号转导过程中发挥着重要作用,并参与人体内多种的生理和病理过程[7]。然而随着研究的不断深入,PKC在肿瘤中的异常调节作用逐渐被人们所重视,其同样参与并维持了胆管癌的恶性生物学特性[8-9]。而一般认为肿瘤的恶性增殖与其细胞周期之间密切相关,研究表明PKC参与肿瘤细胞的周期调节过程,并对细胞的G1期和G2/M期时相转换具有重要调节作用[10]。
STS是一种广谱的PKC抑制药,主要作用于PKC的催化区,通过与ATP竞争结合PKC的ATP结合位点而发挥抑制作用。研究表明,STS能够抑制如宫颈癌[11]、前列腺癌[12]、口腔癌[13]等多种肿瘤细胞生长及促进其凋亡,然而目前关于STS对胆管癌细胞的作用尚不明确。本研究通过体外细胞增殖活性检测、电镜下超微结构观察、流式细胞术等方法,发现STS在体外能显著抑制人胆管癌QBC-939细胞生长,并且这种抑制作用具有浓度和时间依赖性;同时,STS能诱导QBC-939细胞发生凋亡,且细胞凋亡率随着药物作用时间的延长而逐渐增加。
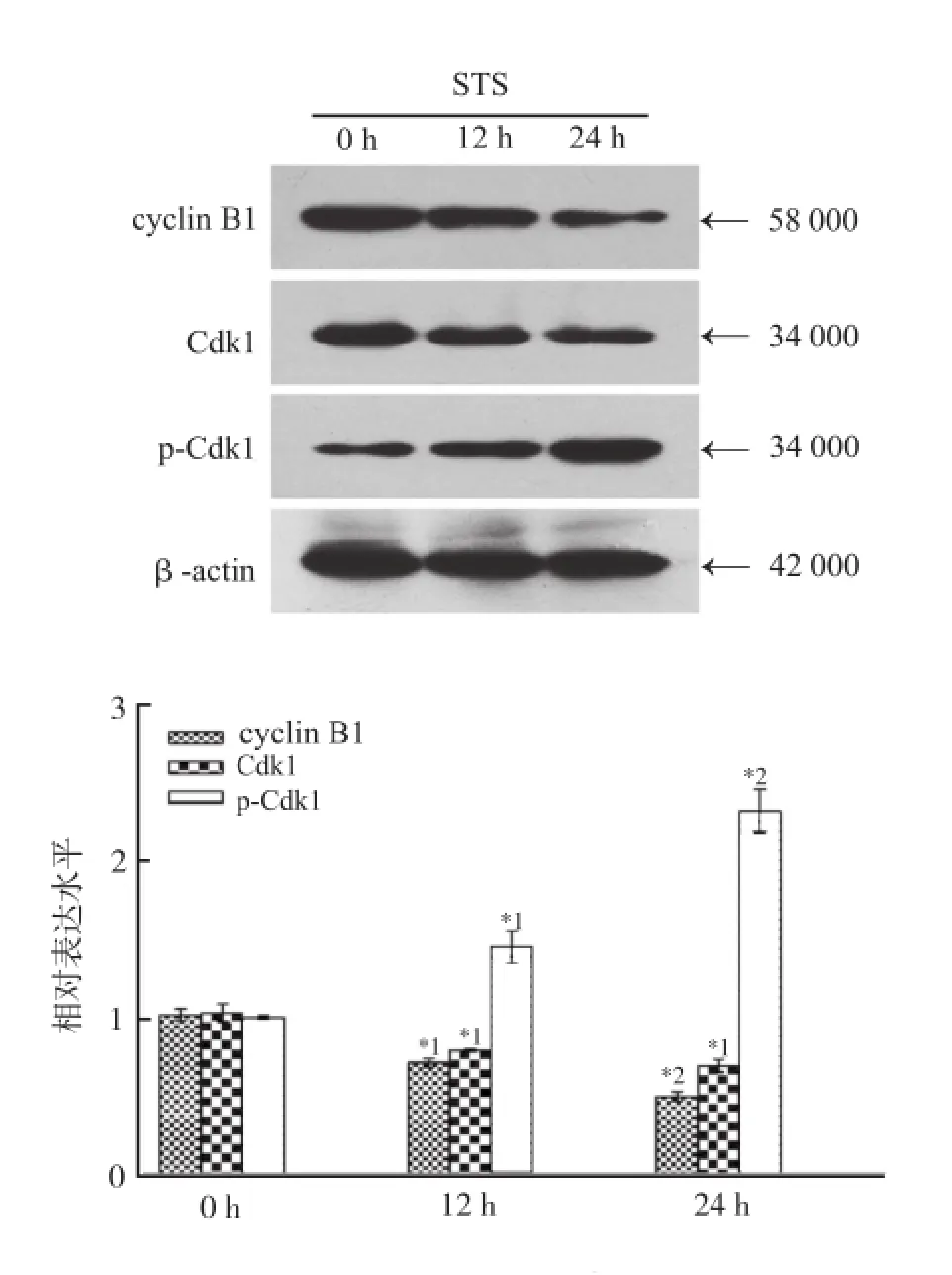
与0 h比较,*1P<0.05,*2P<0.01图4 蛋白质印迹法检测STS对QBC-939细胞周期蛋白的影响Compared with 0 h,*1P<0.05,*2P<0.01Fig.4 Effect of staurosporine on the expressions of cell cycle-related proteins in QBC-939 cells detected by western blotting
大量研究表明,细胞周期阻滞与细胞凋亡之间关系密切。而在细胞周期的调控过程中存在两个限制点,即G1/S期限制点和G2/M期限制点。当外界各种刺激因素作用细胞时,其通过激活限制点引起G1/S期或G2/M期阻滞,使细胞有时间完成损伤修复,以保证细胞的存活;而当损伤超过细胞修复能力时,则会促使细胞凋亡[14]。有文献报道STS能够诱导人口腔上皮癌KB细胞和结肠癌HT-29细胞周期阻滞于G2/M期,从而达到抑制细胞增殖的作用[13,15]。本研究结果也证实,STS抑制人胆管癌QBC-939细胞增殖的同时,可诱导细胞周期阻滞于G2/M期。STS作用12 h后,QBC-939细胞的G2/M期比例即显著升高;作用24 h后G2/M期比例进一步升高;到48 h后,G2/M期比例下降,而细胞的调亡率却明显增加,提示STS可能是先诱导细胞周期阻滞,而后引起细胞凋亡。
在细胞周期过程中,周期蛋白cyclin B1和Cdk1是G2/M期的关键调节蛋白,二者可形成cyclin B1/ Cdk1复合物,该复合物的活化是G2期进入M期的必要条件;而Cdk1被磷酸化后其活性受到抑制,进而引起G2/M期阻滞[16]。通过蛋白质印迹法检测发现,250 nmol·L-1STS分别作用QBC-939细胞12和24 h后,细胞内cyclin B1和Cdk1蛋白表达水平逐渐降低,而p-Cdk1蛋白表达水平则逐渐增加,提示细胞被阻滞于G2/M期,这与细胞周期分布的结果相一致。
综上所述,本研究从体外实验证明STS可引起人胆管癌QBC-939细胞周期阻滞于G2/M期并诱导其凋亡。而STS诱导QBC-939细胞G2/M期阻滞的分子基础可能与其降低cyclin B1、Cdk1表达水平,同时上调p-Cdk1表达水平有关,但其具体调控机制尚待于进一步研究。目前,PKC已成为抗肿瘤药物研究中的重要靶点,其抑制剂STS有望成为抗胆管癌治疗的有效药物之一。
[1] KHAN S A,THOMAS H C,DAVIDSON B R,et al. Cholangiocarcinoma[J].Lancet,2005,366(9493):1303-1314.
[2] BLECHACZ B,GORES G J.Cholangiocarcinoma:advances in pathogenesis,diagnosis,and treatment[J].Hepatology, 2008,48(1):308-321.
[3] MUSASHI M,OTA S,SHIROSHITA N.The role of protein kinase C isoforms in cell proliferation and apoptosis[J].Int J Hematol,2000,72(1):12-19.
[4] ALI A S,ALI S,EL-RAYES B F,et al.Exploitation of protein kinase C:a useful target for cancer therapy[J]. Cancer Treat Rev,2009,35(1):1-8.
[5] HAN C,LENG J,DEMETRIS A J,et al.Cyclooxygenase-2 promotes human cholangiocarcinoma growth:evidence for cyclooxygenase-2-independentmechanismincelecoxibmediated induction of p21waf1/cip1 and p27kip1 and cell cycle arrest[J].Cancer Res,2004,64(4):1369-1376.
[6] OLARU A V,GHIAUR G,YAMANAKA S,et al.MicroRNA down-regulated in human cholangiocarcinoma control cell cyclethroughmultipletargetsinvolvedintheG1/S checkpoint[J].Hepatology,2011,54(6):2089-2098.
[7] FUKAMI K,INANOBE S,KANEMARU K,et al.Phospholipase C is a key enzyme regulating intracellular calcium and modulating the phosphoinositide balance[J].Prog Lipid Res,2010,49(4):429-437.
[8] FRANCIS H,ONORI P,GAUDIO E,et al.H3 histamine receptor-mediated activationofproteinkinaseCalpha inhibits the growth of cholangiocarcinomain vitroandin vivo[J].Mol Cancer Res,2009,7(10):1704-1713.
[9] TECHASENA,LOILOMEW,NAMWATN,etal. Myristoylatedalanine-richCkinasesubstrate phosphorylationpromotescholangiocarcinomacell migration andmetastasisviatheproteinkinaseC-dependent pathway[J].Cancer Sci,2010,101(3):658-665.
[10] GRINER E M,KAZANIETZ M G.Protein kinase C and other diacylglycerol effectors in cancer[J].Nat Rev Cancer,2007,7(4):281-294.
[11] BERNARD B,FEST T,PRETET J L,et al.Staurosporineinduced apoptosis of HPV positive and negative human cervical cancer cells from different points in the cell cycle [J].Cell Death Differ,2001,8(3):234-244.
[12] LI X,MARANI M,MANNUCCI R,et al.Overexpression of BCL-X(L)underlies the molecular basis for resistance to staurosporine-induced apoptosis in PC-3 cells[J].Cancer Res,2001,61(4):1699-1706.
[13] SARKAR J,SINGH N,MEENA S,et al.Staurosporine induces apoptosis in human papillomavirus positive oral cancer cells at G2/M phase by disrupting mitochondrial membrane potential and modulation of cell cytoskeleton [J].Oral Oncol,2009,45(11):974-979.
[14] PIETENPOL J A,STEWART Z A.Cell cycle checkpoint signaling:cell cycle arrest versus apoptosis[J].Toxicology, 2002,(181-182):475-481.
[15] QIAO L,KOUTSOS M,TSAI L L,et al.Staurosporine inhibits the proliferation,alters the cell cycle distribution andinducesapoptosisinHT-29humancolon adenocarcinoma cells[J].Cancer Lett,1996,107(1):83-89.
[16] KING R W,JACKSON P K,KIRSCHNER M W.Mitosis in transition[J].Cell,1994,79(4):563-571.
DOI 10.3870/yydb.2014.10.015
Effects of Staurosporine on the Proliferation and Apoptosis of Human Cholangiocarcinoma QBC-939 Cells
HE Zheng,ZHENG Jun
(Department of Hepatopancreatobiliary Spleen Surgery,the First Clinical Medical College of Three Gorges University,Yichang 443002,China)
ObjectiveTo study the effects of protein kinase C(PKC)inhibitor staurosporine(STS)on the proliferation and apoptosis of human cholangiocarcinoma QBC-939 cells and to explore its possible mechanism.MethodsCCK-8 was used to detect the effects of PKC inhibitor STS on the proliferation of human cholangiocarcinoma QBC-939 cells.The effects of STS on the ultrastructural characteristics of QBC-939 cells were observed by routine transmission electron microscopy(TEM).The apoptosis rate and the cell cycle distribution of QBC-939 cells were detected by flow cytometry.The expression of cyclin B1,Cdk1 and p-Cdk1 in QBC-939 cells was detected by Western blotting.ResultsSTS could significantly inhibit the proliferation of QBC-939 cells in a dose-dependent manner(P<0.05)and the half inhibitory concentration(IC50)of QBC-939 cells at 24th and 48th h was 334 nmol·L-1and 118 nmol·L-1,respectively.TEM observed that STS could induce typical apoptotic bodies and supermicrostructural changes of QBC-939 cells.By Annexin V-FITC/PI double labeling flow cytometry,we found that the apoptotic rate of QBC-939 cells after treatment with STS for 0,12,24 and 48 h was(10.16±4.52)%,(22.35±2.19)%,(34.27±2.30)%and (59.70±5.97)%,respectively.By flow cytometry,compared with the control group,STS could significantly increase apoptosis rate of QBC-939 cells,decrease the percentage of cells in G0/G1phase and increase the percentage of cells in G2/M phase(P<0.05). Western blotting proved that the expression levels of cyclin B1 and Cdk1 proteins in the STS-treated QBC-939 cells were significantly decreased(P<0.05),while the expression level of p-Cdk1 protein in the STS-treated QBC-939 cells was significantly increased(P<0.05).ConclusionSTS can significantly inhibit cell proliferation and induce apoptosis of human cholangiocarcinoma QBC-939 cells and the mechanism may be related to cell cycle arrest at G2/M phase.
Stanrosporine;Protein kinase C inhibitor;Cholangiocarcinoma;Cell cycle;Apoptosis;QBC-939 cell
R979.1;R965
A
1004-0781(2014)10-1314-05
2013-09-25
2013-11-22
何政(1978-),男,湖北鄂州人,主治医师,博士,从事胆道胰腺肿瘤方面研究。电话:(0)15872654116,E-mail:805226494@qq.com。
郑军(1965-),男,湖北宜昌人,主任医师,硕士,从事肝胆胰肿瘤方面研究。电话:(0)15871598533,E-mail:zhengjun1995@163.com。

