米非司酮基于糖皮质激素受体调节糖尿病大鼠高血糖的作用机制*
王晓丽,周珺,李茂星,邱建国,贾正平,张汝学
(1.兰州大学药学院,兰州 730000;2.兰州军区兰州总医院全军高原环境损伤防治重点实验室、国家中医药管理局临床中药学重点学科,兰州 730050)
米非司酮基于糖皮质激素受体调节糖尿病大鼠高血糖的作用机制*
王晓丽1,2,周珺2,李茂星2,邱建国2,贾正平2,张汝学2
(1.兰州大学药学院,兰州 730000;2.兰州军区兰州总医院全军高原环境损伤防治重点实验室、国家中医药管理局临床中药学重点学科,兰州 730050)
目的 观察米非司酮(MIF)对2型糖尿病大鼠血浆中促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)、皮质酮(CORT)、胰岛素(INS)、醛甾酮(ALD)的水平和海马组织中糖皮质激素受体(GR)mRNA表达的影响,探讨MIF对2型糖尿病高血糖的调节作用及其可能机制。方法采用高脂饲料加小剂量链脲佐菌素(30 mg·kg-1)腹腔注射诱导2型糖尿病模型。随机分为正常对照组、模型对照组、阳性对照组(给予二甲双胍200 mg·kg-1·d-1)、米非司酮小剂量组(10 mg·kg-1·d-1)、米非司酮中剂量组(25 mg·kg-1·d-1)、米非司酮大剂量组(50 mg·kg-1·d-1),正常对照组和模型对照组给予纯化水。每周测定大鼠空腹血糖,给药5周后断头处死,计算脏器指数,测定血浆中CRH、ACTH、CORT、INS、ALD水平,采用实时荧光定量PCR技术测定大鼠海马组织中GR mRNA的表达。结果与正常对照组比较,模型对照组大鼠体质量明显降低(P<0.01),空腹血糖升高(P<0.01),脏器指数增加(P<0.05),CRH、ACTH、CORT、INS、ALD水平升高;糖尿病大鼠海马组织中GRmRNA的表达降低(P<0.01)。与模型对照组比较,米非司酮中剂量组和大剂量组给药14 d体质量有所增加(P<0.01);给药第1~4周,米非司酮中剂量组空腹血糖水平有所降低,且在第4周差异有统计学意义(P<0.05);米非司酮中剂量组和大剂量组肾指数减小(P<0.01或P<0.05);米非司酮小剂量组CRH、ACTH、CORT增加,ALD降低,米非司酮中和大剂量组CRH、ACTH、CORT、ALD降低,INS升高,但均差异无统计学意义(P>0.05)。米非司酮小剂量组、中剂量组、大剂量组GR mRNA的相对表达均有所增加(均P<0.01)。结论MIF对2型糖尿病的高血糖有缓解作用,其机制可能与MIF基于GR拮抗调节HPA轴功能有关。
米非司酮;高血糖;糖皮质激素受体;糖尿病,2型
机体维持糖稳态,需要升糖激素和降糖激素的共同参与。糖皮质激素是机体肾上腺皮质束状带分泌的升糖激素之一,活化的糖皮质激素(glucocorticoids, GCs)只有与糖皮质激素受体(glucocorticoid receptor, GR)结合后才能发挥包括调节物质代谢、抗炎、抗免疫作用在内的一系列生物学作用。但机体GCs的过多分泌,可导致机体血糖处置和重吸收出现异常,诱导胰岛素抵抗的发生,继而血糖升高,胰岛素抵抗贯穿2型糖尿病发展的始终[1-2]。因此若能基于GR拮抗以阻断GCs与GR作用的发挥而调节下丘脑-垂体-肾上腺皮质(hypothalamic-pituitary-adrenal,HPA)轴功能紊乱对2型糖尿病的影响,对于糖尿病预防和治疗将具有理论和实际意义。本实验采用高脂饲料喂养加小剂量STZ联合诱导的糖尿病大鼠模型模拟人类临床2型糖尿病,课题组前期已证明米非司酮对于2型糖尿病大鼠的糖脂代谢有一定的调节作用[3],而本实验则通过进一步观察糖皮质激素受体拮抗剂——米非司酮对2型糖尿病大鼠HPA轴相关激素水平和海马组织中GR mRNA相对表达的影响,具体阐明米非司酮基于GR拮抗调节HPA轴功能达到改善2型糖尿病高血糖的作用及可能机制。
1 材料与方法
1.1 动物 Wistar大鼠,雌性,清洁级,体质量(200± 20)g,由兰州大学医学院动物实验中心提供,生产许可证号:SCXK(甘)2009-0004,动物合格证号:0000789,饲养于兰州军区兰州总医院动物实验科,普通饲料由动物实验科提供,自由摄食进水,室温19~24℃。
1.2 药品与试剂 链脲佐菌素(streptozocin,STZ, Sigma公司,批号:S0130);米非司酮(mifepristone, MIF,北京紫竹药业有限公司,批号:431101071,规格:每片25mg);盐酸二甲双胍片(metformin hydrochloride,MET,中美上海施贵宝制药有限公司,批号:1206096,规格:每片0.5 g);血糖检测试剂盒(四川迈克生物科技股份有限公司,批号:081206);胰岛素(insulin,INS)、醛甾酮(aldosterone,ALD)放射免疫分析测定试剂盒(天津九鼎生物技术研究所,批号: 201303);促肾上腺皮质激素释放激素(corticotropin releasehormone,CRH)、促肾上腺皮质激素(adrenocorticotropichormone,ACTH)、皮质酮(corticosterone,CORT)酶联免疫吸附测定(enzymelinked immuno-sorbent assay,ELISA)测定试剂盒为R&D公司产品(96T,批号201302);其他试剂均为国产分析纯。RNAisoPlus(TakaRa,BK4606); PrimeScriptTM RT Master Mix(TakaRa,DRR036A); SYBR®PremixExTaqTMⅡ(TiRNaseHPlus) (TakaRa,RR820A)。
1.3 仪器 TGL-16G台式离心机(上海安亭仪器厂);IEC MICROMAX离心机(美国Thermo Electron公司);Vitalab ISP-21半自动生化分析仪(荷兰Vital Scientific公司);BP210S电子天平(赛多利斯有限公司);Multiscan MK3酶标仪(美国Thermo Electron公司);Telstar Mini-V PCR超净工作台(西班牙TERRASSA-SPAIN医疗器械公司);SN-682放射免疫γ-计数器(中国科学院上海原子核研究所日环仪器厂);ABI7300定量PCR仪(美国应用生物系统公司)。
1.4 糖尿病动物模型的制备 结合课题组前期实验研究和国内外相关文献报道[4-5],本实验采用的糖尿病大鼠模型制备方法为:高脂饲料的配方(蛋黄2.5%、蔗糖20.0%、猪油10.0%、基础饲料67.5%);新购买的雌性Wistar大鼠在实验科适应性饲养2~3 d后,根据体质量平均分组,正常对照组,给予普通饲料,其余均以高脂饲料饲养,喂养1个月后,大鼠禁食16 h后腹腔注射STZ 30 mg·kg-1诱发2型糖尿病模型。测定空腹血糖值,将血糖值≥11.00 mmol·L-1大鼠纳入实验,并随机分为模型对照组、阳性对照组(给予二甲双胍200 mg·kg-1·d-1)、米非司酮小剂量组(给予米非司酮10 mg·kg-1·d-1)、米非司酮中剂量组(给予米非司酮25 mg·kg-1·d-1)、米非司酮大剂量组(给予米非司酮50 mg·kg-1·d-1)。正常对照组和模型对照组每日给予等量纯化水。每组10只,各组均为灌胃给药,每日早8∶30给药一次,每周称定体质量并测定一次血糖,连续给药5周后大鼠禁食不禁水6 h后处死并收集躯干血,4℃,900×g离心15 min,分装, -20℃保存待用。
1.5 体质量的测定 每周固定时间测定一次体质量,测定结果以克表示。
1.6 血糖的测定 每周固定时间测定一次空腹血糖,采血前大鼠禁食不禁水6 h,乙醚麻醉后,大鼠眼眶静脉丛采血,用葡萄糖氧化酶法测定血糖。具体测定方法按照试剂盒说明书进行,测定结果以mmol·L-1表示。
1.7 脏器指数的测定 大鼠处死后,分别取肾脏、肝脏、脾脏、肾上腺组织,精确称量,计算脏器指数。脏器指数=脏器质量/体质量×100。
1.8 血浆中CRH、ACTH、CORT、INS、ALD的测定血浆室温放置解冻后,测定CRH、ACTH、CORT、INS、ALD水平。CRH、ACTH及CORT采用ELISA法测定, INS、ALD采用放射免疫法测定,具体测定方法按试剂盒说明书进行。
1.9 海马组织中GRmRNA表达的测定 大鼠处死后,剖取大鼠海马组织,即刻冻存于-80℃冰箱中,用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)测定。①总RNA提取,海马组织约100 mg加Trizol试剂1 mL研磨匀浆,提取海马组织中的总RNA。②总RNA反转录为cDNA,反应条件: 37℃15 min;85℃,5 s;4℃保存。③根据大鼠GR基因序列设计引物,GR上游引物:5′-AAGGTTAGCAGAGGGAGGCTTT-3′;下游引物:5′-GAAGGGTGGGGAGGATTAGTG-3′,扩增产物大小117 bp;内参照以管家基因(β-actin)为引物,上游引物:5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游引物: 5′-GACTCATCGTACTCCTGCTTGCTG-3′,扩增产物大小150 bp,引物均由宝生物工程(大连)有限公司合成。④RT-PCR:反应条件:95℃,30 s;95℃,5 s; 60℃,31 s;40个循环;4℃保存。每批模板均同时进行内参β-actin和目的基因的扩增反应。
1.10 统计学方法 使用SPSS16.0版统计软件进行统计学处理,各组实验数据以均数±标准差(±s)表示,组间差异的显著性用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况 实验期间,糖尿病大鼠表现出明显的“三多一少”症状,即饮食增加,饮水增加,尿量增加,体质量减少。
2.2 体质量变化 结果见表1。造模前,各组大鼠体质量差异无统计学意义,造模后,与正常对照组比较,模型对照组大鼠体质量明显降低(P<0.01);与模型对照组比较,阳性对照组在给药第7天体质量有增加趋势,米非司酮中剂量组和大剂量组给药14 d体质量有所增加,且差异有统计学意义(P<0.01或P<0.05)。
2.3 米非司酮对糖尿病大鼠空腹血糖水平的影响结果见表2。与正常对照组比较,各糖尿病组大鼠空腹血糖均显著升高(P<0.01)。与模型对照组比较,给药第7天至第28天,非司酮中剂量组空腹血糖水平有所降低,且在第28天差异有统计学意义(P<0.05);说明中剂量米非司酮降低2型糖尿病大鼠空腹血糖。给药3周后,阳性对照组空腹血糖开始降低,说明二甲双胍改善2型糖尿病空腹高血糖。
2.4 米非司酮对糖尿病大鼠脏器指数的影响 结果见表3。与正常对照组比较,模型对照组大鼠各组脏器指数均有所增加,差异有统计学意义(P<0.05或P<0.01);与模型对照组比较,阳性对照组、米非司酮小剂量组、米非司酮中剂量组肝肿大现象改善,但差异无统计学意义(P>0.05);二甲双胍、米非司酮可改善肾肿大现象,且米非司酮中剂量组和米非司酮大剂量组差异有统计学意义(P<0.05或P<0.01);二甲双胍和小剂量米非司酮可改善糖尿病大鼠肾上腺肿大,各组均未改善糖尿病大鼠脾肿大的现象。
表1 6组大鼠体质量的变化Tab.1 Changes of body weight in six groups of rats g,±s

表1 6组大鼠体质量的变化Tab.1 Changes of body weight in six groups of rats g,±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.05,*3P<0.01Compared with normal control group,*1P<0.01;compared with model control group,*2P<0.05,*3P<0.01
组别大鼠/只剂量/ (mg·kg-1·d-1)第1天第7天第14天第21天第28天第35天正常对照组100215.20±18.38218.00±14.06216.90±14.34221.60±14.16224.90±13.07217.20±10.21模型对照组100214.40±15.49181.56±13.87*1174.78±14.88*1173.33±15.23*1171.89±15.79*1170.40±14.01*1阳性对照组10200215.20±15.07184.25±16.77178.25±13.73179.88±21.04178.14±17.53169.25±19.28米非司酮小剂量组1010215.80±16.26184.22±8.88183.44±9.82188.78±10.98*2189.78±14.28*2176.40±12.46中剂量组1025217.78±13.13188.56±9.62190.11±7.82*3197.11±11.73*3193.78±9.08*3186.40±11.01*3大剂量组1050217.10±16.97189.50±10.75189.10±8.88*2199.00±9.35*3201.10±9.65*3200.40±9.96*3
2.5 米非司酮对糖尿病大鼠激素水平的影响 结果见表4。与正常对照组比较,模型对照组CRH、ACTH、CORT、ALD均有所增加(P<0.05),与模型对照组比较,阳性对照组激素水平均有降低趋势,米非司酮小剂量组CRH、ACTH、CORT增加,ALD降低,米非司酮中剂量组和大剂量组CRH、ACTH、CORT、ALD降低,INS升高,但均差异无统计学意义(P>0.05)。
2.6 米非司酮对海马组织中GR mRNA表达的影响结果见表5。与正常对照组比较,模型对照组的GR mRNA相对表达降低(P<0.01),与模型对照组比较,阳性对照组GRmRNA表达差异无统计学意义(P>0.05),米非司酮小剂量组、中剂量组、大剂量组GR mRNA的相对表达均有所增加,且差异均有统计学意义(均P<0.01)。
表2 6组大鼠空腹血糖的变化Tab.2 Changes of fasting blood glucose in six groups of rats mmol·L-1,±s
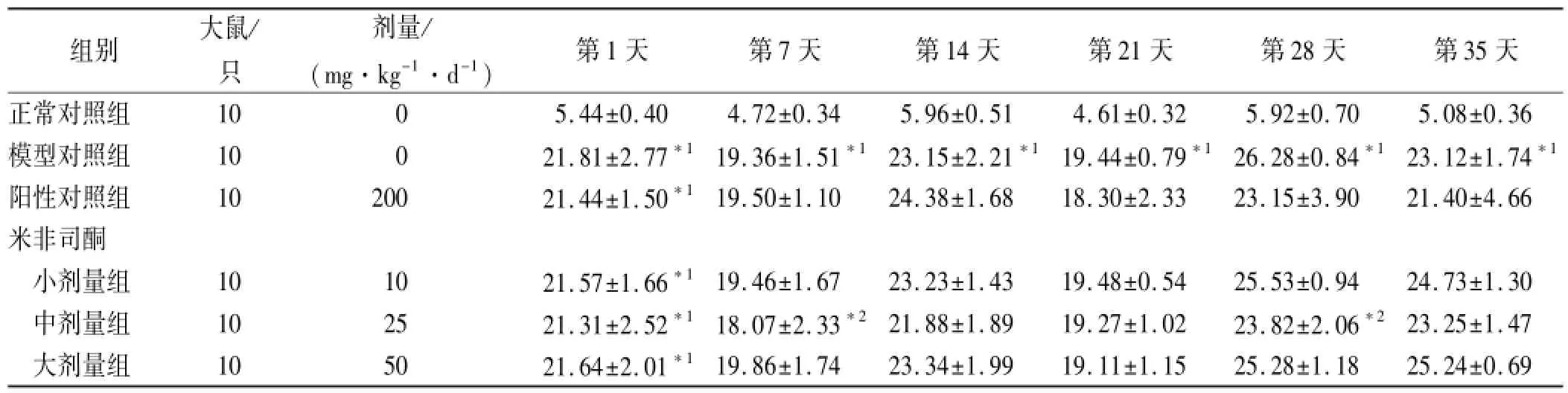
表2 6组大鼠空腹血糖的变化Tab.2 Changes of fasting blood glucose in six groups of rats mmol·L-1,±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.05Compared with normal control group,*1P<0.01;compared with model control group,*2P<0.05
组别大鼠/只剂量/ (mg·kg-1·d-1)第1天第7天第14天第21天第28天第35天正常对照组1005.44±0.404.72±0.345.96±0.514.61±0.325.92±0.705.08±0.36模型对照组10021.81±2.77*119.36±1.51*123.15±2.21*119.44±0.79*126.28±0.84*123.12±1.74*1阳性对照组1020021.44±1.50*119.50±1.1024.38±1.6818.30±2.3323.15±3.9021.40±4.66米非司酮小剂量组101021.57±1.66*119.46±1.6723.23±1.4319.48±0.5425.53±0.9424.73±1.30中剂量组102521.31±2.52*118.07±2.33*221.88±1.8919.27±1.0223.82±2.06*223.25±1.47大剂量组105021.64±2.01*119.86±1.7423.34±1.9919.11±1.1525.28±1.1825.24±0.69
表3 6组大鼠脏器指数测定值Tab.3 Determination on organ indexes in six groups of rats ±s

表3 6组大鼠脏器指数测定值Tab.3 Determination on organ indexes in six groups of rats ±s
与正常对照组比较,*1P<0.01,*2P<0.05;与模型对照组比较,*3P<0.05,*4P<0.01Compared with normal control group,*1P<0.01,*2P<0.05;compared with model control group,*3P<0.05,*4P<0.01
组别大鼠/只剂量/ (mg·kg-1·d-1)肝指数脾指数/ (×10-1)肾指数肾上腺指数/ (×10-2)正常对照组1002.63±0.161.83±0.140.58±0.042.18±0.21模型对照组1004.50±0.29*12.05±0.20*20.96±0.07*12.74±0.48*1阳性对照组102004.27±0.48*12.06±0.230.92±0.172.68±0.25*1米非司酮小剂量组10104.39±0.31*12.13±0.17*10.90±0.08*12.57±0.31*1中剂量组10254.45±0.24*12.21±0.15*10.88±0.04*1*33.00±0.36*1大剂量组10504.50±0.39*12.28±0.30*20.83±0.09*1*43.42±0.32*1
表4 6组大鼠激素水平测定值Tab.4 Determination on hormone levels in six groups of rats ±s
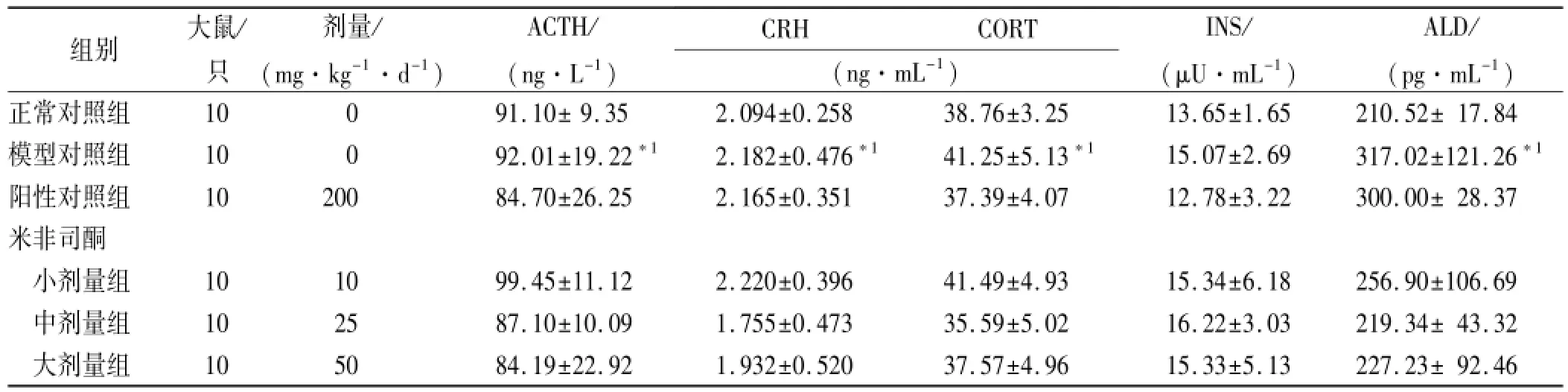
表4 6组大鼠激素水平测定值Tab.4 Determination on hormone levels in six groups of rats ±s
与正常对照组比较,*1P<0.05Compared with normal control group,*1P<0.05
组别大鼠/只剂量/ (mg·kg-1·d-1) ACTH/ (ng·L-1) CRHCORT (ng·mL-1) INS/ (μU·mL-1) ALD/ (pg·mL-1)正常对照组10091.10±9.352.094±0.25838.76±3.2513.65±1.65210.52±17.84模型对照组10092.01±19.22*12.182±0.476*141.25±5.13*115.07±2.69317.02±121.26*1阳性对照组1020084.70±26.252.165±0.35137.39±4.0712.78±3.22300.00±28.37米非司酮小剂量组101099.45±11.122.220±0.39641.49±4.9315.34±6.18256.90±106.69中剂量组102587.10±10.091.755±0.47335.59±5.0216.22±3.03219.34±43.32大剂量组105084.19±22.921.932±0.52037.57±4.9615.33±5.13227.23±92.46
表5 6组大鼠海马组织中GR mRNA表达Tab.5 GR mRNA expression in hippocampus in six groups of rats ±s
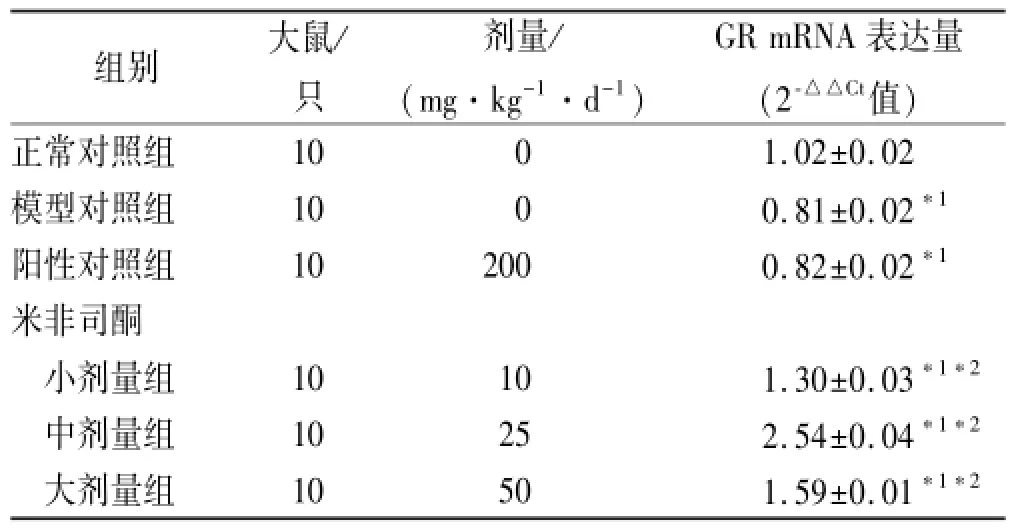
表5 6组大鼠海马组织中GR mRNA表达Tab.5 GR mRNA expression in hippocampus in six groups of rats ±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.01Compared with normal control group,*1P<0.01;compared with model control group,*2P<0.01
组别大鼠/只剂量/ (mg·kg-1·d-1) GR mRNA表达量(2-△△Ct值)正常对照组1001.02±0.02模型对照组1000.81±0.02*1阳性对照组102000.82±0.02*1米非司酮小剂量组10101.30±0.03*1*2中剂量组10252.54±0.04*1*2大剂量组10501.59±0.01*1*2
3 讨论
HPA轴作为神经内分泌免疫调节网络的主要轴路之一,具有维持机体内环境稳态的重要作用[6]。HPA轴功能异常与2型糖尿病的发生关系密切,但因果关系目前尚无定论。HPA轴分泌的终末靶激素GCs,灵长类动物为皮质醇,啮齿类动物为皮质酮过多分泌可导致HPA轴功能紊乱[7]。国内外研究报道米非司酮小剂量使用主要表现抗孕激素的作用;大剂量使用可与GR结合,拮抗GCs的作用,缓解应激条件下皮质醇增高引起的记忆损伤[8]、治疗抑郁症[9]和库欣综合征[10]。
本实验采用高脂饲料喂养加小剂量STZ腹腔注射联合诱导的糖尿病大鼠模型模拟人类临床2型糖尿病。造模后,2型糖尿病大鼠体质量明显降低,空腹血糖升高,脏器指数增加,HPA轴激素水平升高,INS、ALD水平升高,说明2型糖尿病模型造模成功,且模型大鼠机体代谢紊乱,HPA轴活性升高,这与本课题组前期实验结果及相关文献报道一致[3,11-12]。
本实验研究结果显示,米非司酮对糖尿病大鼠的体质量降低有一定的改善作用,米非司酮可改善糖尿病大鼠肾肿大,可能由于血糖降低可使糖尿病大鼠增大的肾小球、肾小管体积减小,滤过面积减小,从而肾脏体积回缩。糖尿病大鼠HPA轴功能紊乱,引起HPA轴负反馈机制出现暂时性或是永久性的失调,使得血浆中CRH、ACTH、CORT水平升高,加重糖尿病大鼠胰岛素抵抗。大量基础及临床研究提示,肾上腺皮质过量分泌的盐皮质激素ALD参与糖尿病、代谢综合征等疾病的发生、发展[13-15],中、大剂量的米非司酮有降低血浆中CRH、ACTH、CORT、ALD水平的趋势。其机制可能在于:米非司酮可抑制过多的GCs与GR结合,可能部分恢复GCs的负反馈调节作用机制,使得HPA轴相关激素CRH、ACTH分泌减少,血浆CORT随之下降,醛固酮分泌减少。
GR作为参与调节糖代谢的核受体,与进入体内循环的配体结合并启动催化肝糖生成的相关酶的基因转录而发挥作用[16]。活化的GCs与GR结合可促进蛋白质分解,使较多的氨基酸进入肝脏,肝内糖异生相关酶的活性升高,促进糖异生过程,使血糖水平升高。此外,过多的GCs能够产生强烈的胰岛素抵抗作用,降低血糖的利用率,导致血糖升高。本实验中,GR拮抗药米非司酮和GCs竞争性地与GR结合,一方面引起GR受体代偿性上调,抑制过量活化的GCs发挥作用,从而有可能达到抑制肝内糖异生相关酶的活性,同时削弱胰岛素抵抗,另一方面,米非司酮可抑制过多的GCs与GR结合,部分恢复GCs的负反馈调节作用,使得CRH、ACTH分泌减少,血浆CORT随之下降,ALD分泌减少。共同作用降低血糖水平,从而可能改善糖尿病大鼠高血糖。
综合实验结果分析:米非司酮改善糖尿病大鼠体质量下降;米非司酮中剂量改善高血糖作用较好,但是米非司酮基于GR拮抗继而改善糖尿病大鼠高血糖和海马组织中GR mRNA表达的作用与剂量的关系及通过HPA轴调节高血糖的作用机制还有待进一步研究。
[1] 徐冲,徐国恒.糖皮质激素与脂肪代谢和胰岛素抵抗[J].生理科学进展,2009,40(1):19-23.
[2] DI DALMAZI G,PAGOTTO U,PASQUALI R,et al.Glucocorticoids andtype 2diabetes:fromphysiologyto pathology[J].J Nutr Metab,2012.DOI:1155/2012/ 525093.
[3] 周珺,贾正平,邱建国,等.米非司酮对2型糖尿病大鼠糖脂代谢的影响[J].中国药理学通报,2013,29(5): 737-739.
[4] 王利军.四种大鼠糖尿病模型HPA轴功能变化与糖代谢的关系及地黄寡糖的调节作用[D].兰州:兰州大学, 2010.
[5] KUMAR S,KUMAR V,PRAKASH O M.Antidiabetic and hypolipidemic activities ofKigelia pinnataflowers extract in streptozotocin induced diabetic rats[J].Asian Pac J Trop Biomed,2012,2(7):543-546.
[6] XIONG F,ZHANG L.Role of the hypothalamic-pituitaryadrenal axis in developmental programming of health and disease[J].Frontiers Neuroendocrinol,2013,34(1):27-46.
[7] FELSOCI M,SCHRONER Z,PETROVICOVA J,et al.Relationship between type 2 diabetes mellitus and hypothalamicpituitary-adrenal axis[J].Wien Klin Wochenschr,2011, 123(1-2):28-33.
[8] BAITHARU I,DEEP S N,JAIN V.et al.Inhibition of glucocorticoid receptors ameliorates hypobaric hypoxia induced memory impairment in rat[J].Behavioural Brain Res, 2013,3(240):76-86.
[9] BLASEY C M,BLOCK T S,BELANOFF J K,et al.Efficacy and safety of mifepristone for the treatment of psychotic depression[J].J Clin Psychopharmacol,2011,31(4):436-440.
[10] FLESERIU M,MOLITCH M E,GROSS C,et al.A new therapeutic approach in the medical treatment of Cushing's syndrome:glucocorticoid receptor blockade with mifepristone [J].Endocr Pract,2013,19(2):313-326.
[11] 周珺,张汝学,贾正平,等.不同糖尿病动物模型的特点比较研究[J].国际内分泌代谢杂志,2010,3(4):273-276.
[12] 王保伟,李颖,刘晓红,等.高脂饲料喂养时间及链脲佐菌素剂量对实验型2型糖尿病大鼠造模的影响[J].卫生研究,2011,40(1):99-106.
[13] SELVARAJ J,MUTHUSAMY T,SRINIVASAN C,et al.Impact of excess aldosterone on glucose homeostasis in adult male rat[J].Clin Chimica Acta,2009,407(1-2):51-57.
[14] 何艳宏,崔国红,程琦.醛固酮与代谢综合征相关性研究进展[J].国外医学:卫生学分册,2009,36(1):7-10.
[15] 王霞娟,卜瑞芳,顾敏峰.糖代谢异常患者血浆醛固酮水平变化的临床意义[J].临床合理用药,2009,2(4):19-20.
[16] TAYLOR A I,FRIZZELL N,MCKILLOP A M,et al.Effect of RU486onhepaticandadipocytegeneexpression improves diabetes control in obesity-type 2 diabetes[J]. Horm Metab Res,2009,41(12):899-904.
DOI 10.3870/yydb.2014.10.006
Mifepristone Improves Hyperglycemia in Diabetic Rats by Regulating Glucocorticoid Receptor Expression
WANG Xiao-li1,2,ZHOU Jun2,LI Mao-xing2,QIU Jian-guo2,JIA Zheng-ping2,ZHANG Ru-xue2
(1.College of Pharmacy,Lanzhou University,Lanzhou 730000,China;2.Key Laboratory of the Prevention and Cure for the Plateau Environment Damage,PLA,Clinical Pharmacy Key Discipline of State Administration of Traditional Chinese Medicine,Lanzhou 730050,China)
ObjectiveTo observe the effect of mifepristone(MIF)on the level of corticotropin releasing hormone (CRH),adrenocorticotropic hormone(ACTH),corticosterone(CORT),insulin(INS)and aldosterone(ALD)in plasma and expression of glucocorticoid receptor(GR)mRNA in hippocampus in type 2 diabetic rats and to discuss the effect and mechanism by which mifepristone improves hyperglycemia.MethodsType 2 diabetes mellitus model was induced by high-fat diet plus intragastric administration of low dose streptozotocin(30 mg·kg-1).Rats were randomly divided into normal control group,model control group,positive control(MET)(metformin hydrochloride 200 mg·kg-1·d-1)group,mifepristone low dose(MIF-L) (10 mg·kg-1·d-1),medium dose(MIF-M)(25 mg·kg-1·d-1)and high dose(MIF-H)(50 mg·kg-1·d-1)groups.The normal control group and model control group were given distilled water.Fasting blood glucose(FBG)was measured once a week. The rats were decapitated after five weeks.Organ index,corticotropin release hormone(CRH),adrenocorticotropic hormone (ACTH),corticosterone(CORT),insulin(INS)and aldosterone(ALD)levels were measured.The expression of GR mRNA in hippocampus was measured by using real-time PCR.ResultsCompared with the normal control group,body weight was decreased significantly(P<0.01),FBG was increased significantly(P<0.01),organ index was increased significantly(P<0.05), CRH,ACTH,CORT,INS and ALD were increased and the expression of GR mRNA in hippocampus was decreased(P<0.01)in the model control group.Compared with model control group,body weight increased in MIF-M and MIF-H groups after administration for 14 days(P<0.01).FBG was decreased in MIF-M group 1 to 4 weeks after administration,with significant difference(P<0.05) at 4th week.The kidney index was decreased in MIF-M and MIF-H groups(P<0.01,P<0.05).CRH,ACTH and CORT were increased,ALD level was decreased in MIF-L group,CRH,ACTH,CORT and ALD were decreased,INS level was increased in MIFM and MIF-H groups,without statistically significant differences(P>0.05).Relative expression of GR mRNA was significantly increased in MIF-L,MIF-M and MIF-H groups(allP<0.01).ConclusionHyperglycemia in type 2 diabetic rats can beimproved by MIF.The possible mechanism may be related to regulating the HPA axis through inhibiting GR.
Mifepristone;Hyperglycemia;Glucocorticoid receptor;Diabetes mellitus,type 2
R984;R965
A
1004-0781(2014)10-1278-06
2013-10-03
2014-02-18
*国家自然科学基金资助项目(81173620, 30772773)
王晓丽(1986-),女,甘肃白银人,在读硕士,研究方向:内分泌代谢药理学。电话:0931-8994676,E-mail:wxl_ lisa@126.com。
张汝学(1963-),男,甘肃陇南人,硕士生导师,主任药师,博士,研究方向:内分泌代谢药理学。电话:0931-8994676,E-mail:ruxuezh@hotmail.com。

