雷帕霉素对皮肤鳞癌细胞体外转移潜能的影响
郭思佳,查晓军,周海胜
雷帕霉素(rapamycin,RAPA)是从吸水性链霉菌提取出来的一种新型大环类酯类免疫抑制剂[1]。它可与磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物RAPA靶体蛋白(PI3K/AKT/mTOR)信号通路下游分子蛋白mTOR特异性结合,阻断该信号通路的刺激应答[2]。RAPA近年来一直是国内外的关注热点,许多研究已经发现RAPA有良好的抗肿瘤效果,包括乳腺癌、肺癌、肾癌等[3],对肿瘤细胞的生长有很强的抑制作用。最近国外研究发现RAPA还可用于治疗阿尔采末病[4],但对皮肤上皮鳞癌细胞的作用鲜有报道。
皮肤上皮鳞状细胞癌(鳞癌)是皮肤表皮细胞的恶性肿瘤,又称为皮样癌,常见于50岁以上的老年人,高发于头皮、面部、口舌等处,尤其是皮肤与粘膜交界处。发展快,对组织破坏力强,具有很强的侵袭性和迁移性[5]。临床治疗主要采用根治性切除手术,并联合术后放疗或化疗。但由于癌细胞的高侵袭性和高迁移性,易发生复发和转移,因此临床上的预后不良。而皮样癌的发病机制目前尚不清楚,有研究表明,可能由于Ras信号通路的激活,进而活化 PI3K/AKT/mTOR信号通路[6],促进上皮细胞的过度增殖、迁移和脱(转)分化,同时导致了表皮屏障的增厚和功能障碍[7]。
本研究旨在观察RAPA对于上皮鳞癌细胞的作用,并对其作用机制进行初步探讨。
1 材料与方法
1.1 实验材料 人上皮鳞癌细胞A431,中国协和医科大学细胞中心实验室刘德培教授惠赠。高糖DMEM培养基、胎牛血清、双抗均购自美国Hyclone公司。RAPA为美国Cell Signaling Technology产品(10μmol·L-1)。噻唑蓝 MTT购自碧云天公司。基质胶Matrigel为美国BD公司产品。Taq酶、逆转录试剂盒、PCR试剂盒、DNA Marker均为中国大连宝生物公司产品。引物由上海生工生物工程技术服务有限公司合成。β-actin引物序列为:Sense:5′-TGGACATCCGCAAAGAC-3′,Antisense:5′-AAGGGTGTAACGCAACTAA-3′,PCR产物 302bp;OPN引物序 列:Sense: 5′-CATACAAGGCCATCCCCGTT-3′,Antisense:5′-ACGGCTGTCCCAATCAGAAG-3′,PCR产物59 bp。兔源抗OPN单克隆抗体、鼠源抗GAPDH单克隆抗体均为Abcam公司产品。Transwell嵌套为Corning产品。
1.2 实验方法
1.2.1 细胞培养 细胞培养用高糖DMEM培养基含10%的胎牛血清和1%青、链霉素(P/S),培养条件为5%CO2和37℃。
1.2.2 实验分组 实验分为Control(正常对照组)、RAPA处理组(5、10、20 nmol·L-1)。
1.2.3 MTT实验 取对数生长期的A431细胞,用10 g·L-1胰蛋白酶消化,并吹打成单个细胞,用DMEM制备成约为2×108·L-1的细胞悬液,按12、24、48、72 h 4个时间梯度准备4个96孔板,每孔加入100μl约2×104个细胞,待细胞贴壁后,在每个时间梯度按照预定的实验分组进行处理(每组设5个复孔),每孔加入10μl配制好的MTT溶液(5 g·L-1),在培养箱内继续孵育4 h后,每孔加入100μl的Formanzan溶解液,在培养箱内继续孵育,直至在光学显微镜下观察发现Formanzan全部溶解,在570 nm测定吸光度(OD)值。计算抑制率/%=(对照组吸光度平均值-实验组吸光度平均值)/对照组吸光度平均值×100%,并作图。
1.2.4 划痕愈合实验 取状态良好的A431细胞铺板,铺匀细胞,待生长密度至90%时,换用1%低血清培养基培养,用10μl枪头划痕,同时在RAPA处理组中加入适当浓度的RAPA。37℃继续培养,按0、12、24、36、48 h时间梯度观察并拍照,重复 3次。
1.2.5 Transwell侵袭实验 A431细胞饥饿24 h,用10 g·L-1胰蛋白酶消化,制备成单细胞悬液,用含0.1%BSA的无血清培养液重悬细胞,稀释成2×108·L-1,取出 1 ml细胞悬液,加入 1μl浓度为10μmol·L-1的 RAPA,使之终浓度为 10 nmol·L-1,在每个Transwell上室加入200μl细胞悬液,正常对照组加入等体积培养液。每组设5个复孔,重复2次。在下室中加入600μl含5%胎牛血清的培养基,37℃继续培养24 h,HE染色,显微镜下观察,并计数。
1.2.6 RT-PCR 接种A431细胞于6孔板,细胞贴壁后,依据MTT实验筛选出的药物浓度处理细胞,并按12、24、36、48 h收集细胞,提取各组细胞总RNA,按照试剂盒说明书进行逆转录,再通过PCR方法检测目的基因表达水平。PCR体系为:模板3 μg,Ex Tag酶 0.25μl,10×Ex Tag Buffer 2.5μl,dNTP Mixture 2μl,上下游引物各 1μl,再加入dH2O使终体系终体积为25μl;PCR条件(三步法)是94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 40 s(30个循环);72℃ 7 min。
1.2.7 Western blot 接种A431细胞于12孔板,贴壁后,依据MTT实验筛选出的药物浓度处理细胞,并按12、24、36、48 h时间梯度收集细胞,用 PBS清洗3次,加入适量事先37℃预热10 min过的细胞裂解液,冰上裂解20 min,用1 ml枪头刮下细胞,100℃水浴锅裂解10 min,随后进行10%SDS-PAGE电泳,后采用恒流170 mA湿转2 h,使蛋白转移到PVDF膜上,封闭40 min后(封闭液为含5%脱脂奶粉的TBST溶液),按1∶1 000稀释的一抗并孵育,次日洗膜,按1∶5 000稀释的二抗并孵育,12 h后洗膜,暗室曝光显影。
1.3 统计学分析 利用IBM SPSSStatistics19.0软件对数据进行处理,实验数据以¯x±s表示,不同组间比较采用方差分析。
2 结果
2.1 RAPA对A431细胞增殖的影响 为研究RAPA对A431细胞增殖能力的影响,采用MTT法检测不同浓度RAPA对鳞癌细胞A431增殖活性的抑制率,结果显示(Fig 1):5、10及 20 nmol·L-1RAPA分别处理A431细胞,其增殖的抑制率均明显升高(P<0.05);与10 nmol·L-1相比较,利用 20 nmol·L-1处理A431细胞时,细胞增殖抑制率变化无统计学意义(P>0.05)。拟选用10 nmol·L-1RAPA处理A431细胞进行后续试验。
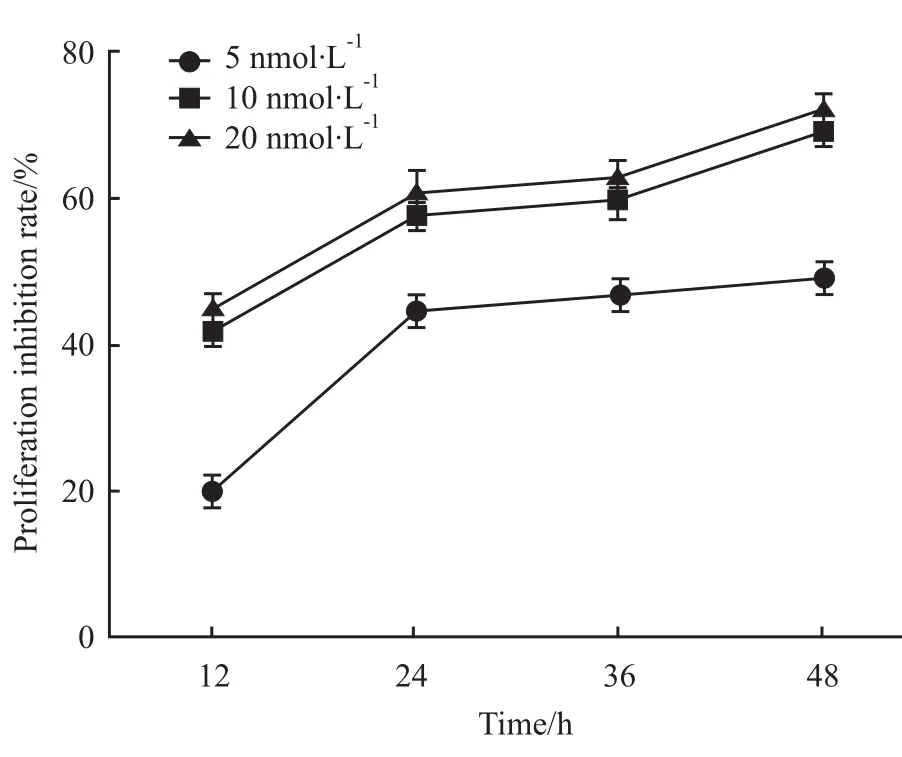
Fig 1 Proliferation inhibitory rate of A431 cells treated by RAPA at different concentrations(5,10,20 nmol·L-1)
2.2 RAPA对A431细胞迁移的影响 为了研究RAPA对A431迁移能力的影响,选择10 nmol·L-1RAPA处理A431细胞0~48 h,进行划痕实验(Fig 2A)。A431细胞在划痕后48 h内有明显迁移现象,而经过RAPA处理的A431细胞,迁移现象明显减弱。利用Wimasis GmbH计算其划痕面积,按¯x±s,并作图(Fig 2B)。与对照组相比,RAPA组的划痕面积在24 h后,A431细胞迁移率差异具有显著性(P<0.05)。
2.3 RAPA对A431细胞侵袭能力的影响 Transwell实验检测鳞癌细胞A431经RAPA处理前后侵袭能力的变化(Fig 3)。结果显示:对照组A431细胞穿透基质膜的细胞数(14.8±1.25),提示A431具有一定的侵袭能力;而经过RAPA处理的A431细胞,穿透的细胞数明显减少(3±1.27)。与对照组相比,穿膜细胞数差异具有显著性(P<0.05)。
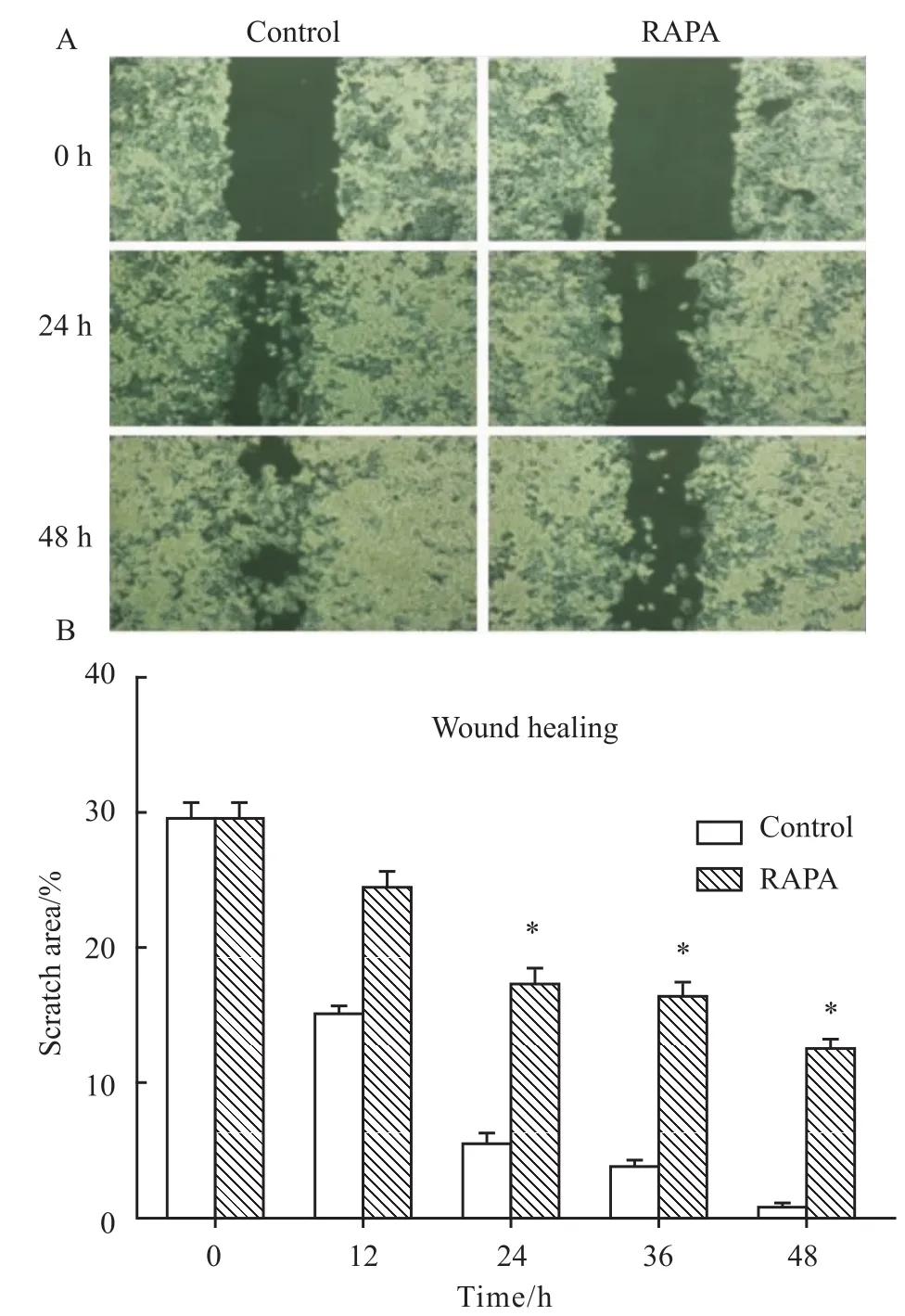
Fig 2 Migration of A431 cells treated with RAPA(10 nmol·L-1)
2.4 RAPA对A431细胞中OPN的表达影响 为了研究RAPA抑制A431细胞的迁移和侵袭是否与抑制OPN的表达有关,选用10 nmol·L-1RAPA处理细胞,在作用12、24、36、48 h后,分别收集各时间点的细胞提取细胞总RNA和总蛋白。利用RT-PCR和Western blot分别在mRNA水平和蛋白水平检测细胞中OPN的变化。随RAPA作用A431细胞的时间增加,RT-PCR结果显示OPN的mRNA丰度逐渐降低(Fig 4A);同时Western blot的结果也显示OPN蛋白逐渐降低(Fig 4B)。
3 讨论

Fig 3 Invasion of A431 cells treated by RAPA(10 nmol·L-1)
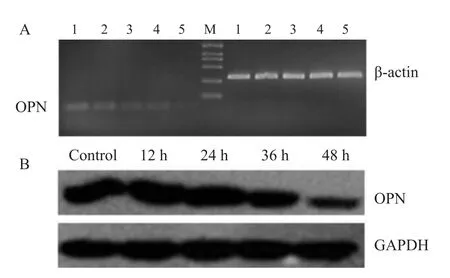
Fig 4 The expression of OPN in A431 cells treated by RAPA(10 nmol·L-1)
肿瘤细胞中的mTOR信号转导通路,依靠其结构和功能的特异性,通过调控细胞周期蛋白表达水平,调节细胞周期和细胞的迁移侵袭,进而调控肿瘤细胞的生长及转化方向[8]。RAPA是mTOR特异性抑制剂[9],最初作为一种新型的大环类酯类免疫抑制剂应用于临床。但是近年来,越来越多的研究证实RAPA具有治疗肿瘤的潜能[10]:如RAPA明显抑制乳腺癌细胞的增殖及侵袭迁移、减少肝癌细胞血管内皮生长因子(VEGF)的分泌,抑制肿瘤血管生成。本研究为探讨RAPA对人皮肤鳞癌细胞的影响,采用MTT方法观察其抑制癌细胞的增殖作用。结果显示使用不同浓度的RAPA作用于A431细胞后,可以有效抑制人上皮鳞癌细胞A431的增殖,且抑制率呈浓度依赖性。
肿瘤细胞获得迁移和侵袭能力是肿瘤转移的关键因素之一,抑制肿瘤细胞的迁移、侵袭能力已经成为该领域的研究热点之一。为证实RAPA是否具有抑制皮肤鳞癌细胞的迁移和侵袭能力,使用RAPA处理A431细胞进行划痕实验,结果显示划痕愈合距离较对照组细胞明显减少;说明RAPA可以有效抑制A431迁移;Transwell实验结果显示RAPA处理的透膜细胞较对照组明显减少(P<0.05),同时证实RAPA可以降低A431细胞的侵袭能力。OPN作为细胞基质蛋白家族成员,在上皮肿瘤的发生发展中,尤其是促进上皮细胞迁移和侵袭,都起到了重要作用[11]。研究证实 PI3K/AKT/mTOR信号通路的活化可以增加OPN的表达,从而促进细胞的迁移和侵袭[12-13]。RT-PCR和 Western blot的结果均显示在RAPA处理后的A431细胞中OPN的表达均下降。其分子机制可能是RAPA通过抑制PI3K/mTOR信号通路,降低了OPN的表达,进而抑制A431细胞的迁移和侵袭。
RAPA作为mTOR的特定靶向抑制剂,体外实验证实其可以抑制鳞癌细胞A431的增殖、迁移及侵袭,从而为应用于上皮鳞癌临床治疗提供理论依据。但其抑制的作用结合位点,如整合蛋白受体(α9β1、α4β1、αvβ3、αvβ5)和跨膜蛋白 CD44及其相互作用的分子机制有待进一步研究[14-15]。
参考文献:
[1] Sehgal S N.Sirolimus:its discovery,biological properties,and mechanism of action[J].Transplant Proc,2003,35(3 Suppl):7S-14S.
[2] Seto B.Rapamycin and mTOR:a serendipitous discovery and implications for breast cancer[J].Clin Transl Med,2012,1(1):29.
[3] Dufour M,Dormond-Meuwly A,Demartines N,Dormond O.Targeting the mammalian target of rapamycin(mTOR)in cancer therapy:lessons from past and future perspectives[J].Cancers(Basel),2011,3(2):2478-500.
[4] Avrahami L,Farfara D,Shaham-Kol M,et al.Inhibition of glycogen synthase kinase-3 amelioratesβ-amyloid pathology and restores lysosomal acidificationand mammalian target of rapamycin activity in the Alzheimer disease mouse model:in vivo and in vitro studies[J].J Biol Chem,2013,288(2):1295-306.
[5] Siddiqui M S,Chandra R,Aziz A,Suman S.Epidemiology and histopathological spectrum of head and neck cancers in Bihar,a state of Eastern India[J].Asian Pac J Cancer Prev,2012,13(8):3949-53.
[6] Darido C,Georgy S R,Wilanowski T,et al.Targeting of the tumor suppressor GRHL3 by a miR-21-dependent proto-oncogenic network results in PTEN loss and tumorigenesis[J].Cancer Cell,2011,20(5):635-48.
[7] Koster M I.Making an epidermis[J].Ann N YAcad Sci,2009,1170:7-10.
[8] Yang H,Rudge D G,Vaidialingam B,et al.mTOR kinase structure,mechanism and regulation[J].Nature,2013,497(7448):217-23.
[9] 延光海,金光玉,朴红梅,等.雷帕霉素对哮喘小鼠气道重塑的影响[J].中国药理学通报,2013,29(7):942-6.
[9] Yan G H,Jin G Y,Piao H M,et al.Effects of rapamycin on airway remodeling in asthmatic mice[J].Chin Pharmacol Bull,2013,29(7):942-6.
[10]Chen Y C,Lo C L,Lin Y F,Hsiue GH.Rapamycin encapsulated in dual-responsive micelles for cancer therapy[J].Biomaterials,2013,34(4):1115-27.
[11]Hubbard NE,Chen QJ,Sickafoose L K,et al.Transgenic mammary epithelial osteopontin(spp1)expression induces proliferation and alveologenesis[J].Genes Cancer,2013,4(5-6):201-12.
[12]Ahmed M, Kundu G C.Osteopontin selectively regulates p70S6K/mTOR phosphorylation leading to NF-kappaB dependent AP-1-mediated ICAM-1 expression in breast cancer cells[J].Mol Cancer,2010,9:101.
[13]Bazer F W,Song G,Kim J,et al.Mechanistic mammalian target of rapamycin(MTOR)cell signaling:effects of select nutrients and secretedphosphoprotein 1 on development of mammalian conceptuses[J].Mol Cell Endocrinol,2012,354(1-2):22-33.
[14]Phillips R J,Helbig K J,Van der Hoek K H,et al.Osteopontin increases hepatocellula carcinomacell growth in a CD44 dependant manner[J].World J Gastroenterol,2012,18(26):3389-99.
[15]Urtasun R,Lopategi A,George J,et al.Osteopontin,an oxidant stress sensitive cytokine,up-regulates collagen-Ivia integrinα(V)β(3)engagement and PI3K/pAkt/NFκB signaling[J].Hepatology,2012,55(2):594-608.

