青藤碱对大鼠海马神经元缺血损伤的保护作用
吴文宁,王玉婵,董六一,陈志武
缺血性脑损伤是脑缺血、脑外伤、脑缺氧性疾病等多种神经系统疾病所共有的病理过程,具有高致残率和致死率的特点,严重威胁人类的生命健康,但目前临床上对于该类疾病的有效治疗手段仍然很有限,因此,寻找新的缺血性脑损伤的治疗药物和治疗途径一直备受关注。
青藤碱是从中国传统药用植物青风藤中提取的生物碱,长期以来一直作为治疗风湿和类风湿药物用于临床,具有多种药理作用,包括抗炎抗氧化、免疫抑制、镇痛、减轻成瘾大鼠戒断症状、细胞保护等作用[1-5]。较早之前的研究已经发现,青藤碱能对抗急性心肌缺血/再灌注损伤,保护心肌细胞[6];我们之前研究证实青藤碱能减少脑缺血面积,具有神经保护作用[7],但其对海马神经元缺氧/缺血损伤的作用研究还比较少。所以我们建立原代培养海马神经元OGD-R模型,模拟脑缺氧缺血损伤的病理过程,观察SN对OGD-R引起海马神经元损伤的保护作用,并探讨其可能的作用机制。
1 材料与方法
1.1 动物 新生SD乳鼠(24 h内),安徽医科大学动物中心提供。
1.2 药品与试剂 青藤碱(中国药品生物制品检定所,纯度大于0.99),DMEM/F12培养基和胎牛血清(Gibco公司),四甲基偶氮唑盐 MTT、Hoechst 33258和胰酶(Sigma公司),LDH试剂盒(南京建成生物工程研究所),Fura-2/AM(Biotium,美国),Bcl-2、Bax、Caspase-3抗体购自 Santa Cluz公司,PcTx1购自(Alomone labs,以色列),其他试剂均为分析纯。细胞外液(mmol·L-1):NaCl 150,KCl 5,MgCl21,CaCl22,HEPES 10,glucose 10,pH调至 7.4。电极内液 (mmol·L-1):KCl 140,NaCl 10,MgCl21,EGTA 5,Mg-ATP 2,HEPES 10,pH调至7.2。
1.3 仪器 CO2培养箱(Sheldon Manufacturing Inc,美国),超净化工作台(SW-CJ-2FD,苏州净化公司,中国),低温离心机(Biofuge-22R Heraeus company,德国),全自动酶标仪(Bio Tech,美国),荧光钙离子成像图象系统 (Tillphotonics,德国),膜片钳放大器(HEKA,德国)倒置相差显微镜(Olympus IX70,日本),Western blot电泳、转膜装置(Bio-RAD,美国)。
1.4 海马神经元原代培养 取24 h内新生SD乳鼠,超净工作台中无菌条件下分离海马组织,剪碎,质量浓度1.25 g·L-1胰蛋白酶消化30 min后轻柔吹打,过滤,800 r·min-1离心 5 min弃上清,收集细胞接种于poly-L-lysine处理过的细胞培养板或者培养皿,置于体积分数0.05 CO2,37℃培养箱培养,每隔1天DMEM/F12培养液换液1次。
1.5 细胞OGD模型 模型组细胞使用无糖Earle’s平衡盐溶液替换正常的细胞培养液,并将其置于37℃含体积分数0.95 N2和0.05 CO2的混合气体的培养箱,2 h后换正常培养液,然后正常培养条件继续培养24 h。对照组细胞使用有糖Earle’s平衡盐溶液正常条件培养2 h时间后,再换正常培养液正常条件继续培养24 h。处理组细胞在OGD前24 h加入各不同浓度的药物孵育。
1.6 MTT测定 将原代培养海马神经元分成正常组、OGD组、阳性药物组、OGD加不同浓度药物组,按实验要求处理后,每孔加入含0.5 g·L-1MTT细胞培养液150μl继续培养4 h。弃上清,每孔加DMSO 150μl,37℃振摇孵育15 min,酶标仪 490 nm波长处检测光密度值。
1.7 LDH测定 将原代培养海马神经元分成正常组、OGD组、阳性药物组、OGD加不同浓度药物组,按实验要求处理后,收集各组培养液上清,然后使用体积分数0.002 TritonX-100破膜,再次收集各组细胞液体,根据试剂盒说明书分别测得上清和细胞中的LDH活力,计算上清LDH/总LDH的比率,以此代表细胞受损程度。
1.8 Hoechst染色 将接种在玻片上的原代培养海马神经元分成正常组、OGD组、OGD加药物组,按实验要求处理后,弃培养液,PBS液清洗3次,质量浓度40 g·L-1多聚甲醛固定30 min,PBS清洗3次,然后37℃条件下 Hoechst 33258(1 mg·L-1)孵育20 min,再次PBS清洗3次,甘油封片,倒置荧光显微镜观察细胞核形态,细胞核固缩突亮或者碎块状致密浓染为凋亡神经元。
1.9 细胞内钙离子浓度测定 将原代培养海马神经元分成正常组、OGD组、OGD加药物组,按实验要求处理后,用细胞外液将海马神经元清洗3次后,37℃条件下 Fura-2/AM(1μmol·L-1)孵育 20 min,然后细胞外液再清洗3次,使用钙离子荧光成像系统,分别以340 nm和380 nm波长的荧光进行激发,运用TILLVISION软件记录每秒F340/F380比值,以此代表细胞内钙离子浓度,最后导出数据进行统计。
1.10 Western blot 将原代培养海马神经元分成正常组、OGD组、OGD加药物组,按实验要求处理后,收集各组细胞,加入适量蛋白裂解液,置于冰上裂解 30 min后 12 000 r·min-1离心 15 min,取上清,BCA法测定蛋白含量。然后按1∶4体积(上样缓冲液:样本)加入上样缓冲液,充分混匀后灭活5 min。配制体积分数0.1的分离胶,每泳道加入等量蛋白,100 V电压电泳分离约90 min,用湿转法将蛋白转移至NC膜上。使用含质量浓度50 g·L-1脱脂奶粉的TBST液封闭1 h,然后使用含质量浓度10 g·L-1脱脂奶粉TBST液稀释一抗到适当浓度,4℃孵育过夜。次日TBST洗膜,加入适当浓度二抗室温孵育1 h。TBST再次洗膜后,加ECL荧光剂显影,GTS凝胶图像处理系统扫描显影的密度。
1.11 全细胞膜片钳记录 海马神经元培养10 d后,通过膜片钳技术记录细胞膜电流,再采用Pulse/PulseFit软件采集和处理数据,采样频率为10 kHz,滤波频率为3 kHz。药物对正常海马神经元ASICs电流的影响采用瞬时给药自身对照的方法;药物对OGD处理后海马神经元ASICs电流的影响采用组间对照的方法,分成正常组、OGD组、OGD加药物组,按实验要求处理后,记录各组细胞的电流(pA)和电容(pF),以电流密度(pA/pF)来反映电流大小改变情况。
1.12 数据统计分析 统计学处理使用SPSS12.0软件,所有数据以¯x±s表示,采用单因素方差分析结合 Student-Newman-Keuls检验或t检验。
2 结果
2.1 SN对抗OGD-R诱导海马神经元损伤的作用如Fig 1所示,与正常对照组比较,OGD-R后海马神经元存活率明显降低,LDH释放量明显增加(P<0.01);而阳性药 Nimodipine(10μmol·L-1)和 SN处理组(0.1、0.5和1μmol·L-1)海马神经元存活率明显增加,LDH释放明显减少(P<0.05或P<0.01)。
2.2 SN对抗OGD-R诱导海马神经元凋亡 Hoechst染色结果显示,0.5μmol·L-1SN明显抑制OGD-R诱导的海马神经元凋亡,如Fig 2A所示;与正常组相比,OGD-R后Bax表达明显增加,Bcl-2的表达则减少,Bcl-2/Bax的比率下降,同时caspase-3表达也明显增加(P<0.05);而给予0.5μmol·L-1SN处理组Bcl-2/Bax的比率增加,caspase-3表达减少(P<0.05),如 Fig 2B、2C所示。

Fig 1 SN protects hippocampal neurons against injury induced by OGD-R
2.3 SN对OGD诱导细胞内钙离子浓度变化的影响 如Fig 3所示,和对照组相比,OGD处理组细胞内钙离子浓度明显增加(P<0.01),而0.5 mol·L-1SN处理组,明显抑制细胞内钙离子浓度增加(P<0.01)。
2.4 SN对原代培养海马神经元ASCIs电流的影响 如Fig 4A所示,0.5μmol·L-1SN明显抑制ASICs电流(P<0.05),洗脱后可恢复;给予ASIC1a阻断剂 PcTx1(10nmol·L-1)后,SN对剩余部分电流没有影响,只抑制ASIC1a通道,如Fig 4B所示。和正常对照组相比,OGD处理组ASICs电流密度明显增加(P<0.05),而 SN(0.5μmol·L-1)处理组明显抑制ASICs电流密度增加(P<0.05),如Fig 4C所示。
3 讨论

Fig 2 SN protects hippocampal neurons against apoptosis induced by OGD-R
神经元缺血损伤后,其死亡的方式主要有坏死、凋亡和自噬3种。坏死主要发生于脑缺血急性期的缺血中心区域,而缺血/再灌注引起的继发性神经元死亡则发生在半暗带区,以凋亡为主[8],因此,抑制再灌注引起神经元凋亡是治疗缺血性脑损伤、降低致死率和致残率的关键所在。多种传统中药有效成份已被证实能抑制缺血/再灌注引起的神经元凋亡。
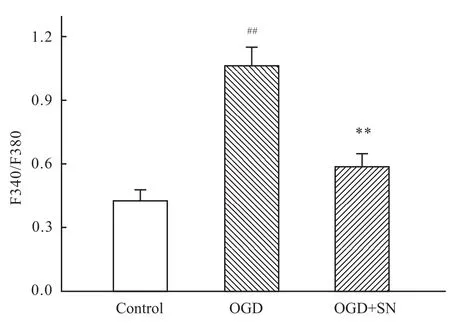
Fig 3 SN inhibits the increase of[Ca2+]i induced by OGD in hippocampal neurons
青藤碱源于传统中药青风藤,具有细胞保护作用,但对缺氧缺血/再灌注引起海马神经元凋亡的作用还鲜有报道。我们研究发现,SN浓度依赖性抑制OGD-R诱导的细胞活率降低,提高细胞的生存率;SN也可浓度依赖性抑制OGD-R诱导LDH的释放;根据上两个实验结果以及前期体内实验结果[7],我们选择0.5μmol·L-1SN作为后续实验的剂量。Hochest染色结果表明SN能明显抑制OGD-R诱导的海马神经元凋亡;Western blot结果显示,SN抑制OGD-R诱导的促凋亡蛋白Bax和caspase-3表达的上调,增加抗凋亡蛋白Bcl-2的表达。这些表明SN能对抗再灌注引起的海马神经元凋亡,具有神经保护作用。
脑缺血的病理机制目前还未完全阐明,现认为多因素参与了神经元缺血损伤的分子机制,如兴奋性氨基酸毒性、钙稳态失调、氧化应激、炎症、酸中毒、脑能量代谢紊乱等。其中钙超载是引起缺血后继发神经元凋亡的重要环节,是诸多因素导致神经元死亡的“最后共同通路”[9]。钙超载可通过改变线粒体膜的通透性、触发内质网应激等途径启动胞内的级联反应诱导神经细胞的凋亡。我们的结果显示,海马神经元经OGD-R处理后,胞内钙离子浓度明显增加,而给予0.5μmol·L-1SN处理之后,钙离子浓度增加明显被抑制,表明SN对抗缺血性损伤、保护海马神经元可能与其抑制细胞内钙离子浓度有关。
ASICs(acid sensing ion channels)是 H+-门控的离子通道,属于上皮钠通道/退化蛋白(epithelial Na channel/degenerin,ENaC/DEG)超家族,在细胞外pH降低时被激活,主要引起内向电流和膜的去极化,它包括 6个亚型:ASIC1a,ASIC1b,ASIC2a,ASIC2b,ASIC3和ASIC4,广泛存在外周和中枢神经系统,在多种生理病理过程中扮演重要角色[10]。ASIC1a除对钠离子通透外,对钙离子也有一定通透性。近些年研究表明,ASICs特别是ASIC1a在缺血性脑损伤过程中扮演重要的角色[11-12],脑缺血过程伴有ASIC1a的大量激活,导致细胞内钙超载,进而引起胞内级联反应导致神经元的凋亡,而ASIC1a特异性阻断剂PcTx1能减轻缺血后神经元的损伤,减少缺血面积,保护脑功能[13]。所以在明确SN能抑制胞内钙离子浓度增加后,我们进一步观察了其对ASICs的影响,结果发现,SN能抑制海马神经元ASICs通道电流,并且在预先给予10 nmol·L-1PcTx1阻断ASIC1a后,SN对ASICs电流剩余部分无明显影响,表明SN主要选择性作用于ASIC1a通道。以往研究表明[11],OGD-R处理后,皮层神经元ASICs通道功能上调,从而加重缺氧缺血神经元的损伤,因此我们观察了SN对OGD诱导ASICs功能改变的影响,结果显示,海马神经元经OGD处理后,ASICs电流密度明显增加,而SN处理组ASICs电流密度未见明显改变。以上结果揭示SN神经保护作用可能主要是通过抑制ASIC1a通道,减轻钙超载来实现的。

Fig 4 Effect of SN on ASICs current in hippocampal neurons
综上所述,SN能对抗OGD-R诱导的海马神经元损伤,具有神经保护作用,其作用机制可能与抑制ASICs通道,减轻细胞内钙超载有关。我们的研究可能为临床缺血性脑损伤的治疗提供新的潜在药物和治疗途径。
参考文献:
[1] Qian L,Xu Z,Zhang W,et al.Sinomenine,a natural dextrorotatory morphinan analog,is anti-inflammatory and neuroprotective through inhibition of microglial NADPH oxidase[J].J Neuroinflammation,2007,4(23):1-14.
[2] Feng H,Yamaki K,Takano H,et al.Suppression of Th1 and Th2 immune responses in mice by sinomenine,an alkaloid extracted from the chinese medicinal plant sinomenium acutum[J].Planta Med,2006,72(15):1383-8.
[3] 李 鹏,张美玉,王丹巧,等.青藤碱对SSNI模型大鼠镇痛效应及脑内兴奋性氨基酸递质的影响[J].中国药理学通报,2012,28(10):1365-9.
[3] Li P,Zhang M Y,Wang D Q,et al.Effects of sinomenine on analgesia and exciting amino acid neurotransmitters in brain of SSNIrat model[J].Chin Pharmacol Bull,2012,28(10):1365-9.
[4] 徐国强,刘晓红,董宇华,等.青藤碱及针刺治疗对海洛因戒断大鼠杏仁核的影响[J].中国药理学通报,2010,26(4):505-8.
[4] Xu G Q,Liu X H,Dong Y H,et al.Effects of sinomenine and acupuncture on amygdala in heroin-withdrawal rats[J].Chin Pharmacol Bull,2010,26(4):505-8.
[5] Bao G H,Qin G W,Wang R,Tang X C.Morphinane alkaloids with cell protective effects from Sinomenium acutum[J].J Nat Prod,2005,68(7):1128-30.
[6] Xie SX,Jin Q Q.Prevention of sinomenine on isolated rat myocardial reperfusion injury[J].Zhongguo Yao Li Xue Bao,1993,14(Suppl):S12-5.
[7] Wu W N,Wu P F,Chen X L,et al.Sinomenine protects against ischaemic brain injury:involvement of co-inhibition of acid-sensing ion channel 1a and L-type calcium channels[J].Br J Pharmacol,2011,164(5):1445-59.
[8] Lopez N F,Toledo A H,Toledo P L H.Molecular biology of apoptosis in ischemia and reperfusion[J].J Invest Surg,2005,18(6):335-50.
[9] Matsude T,Arakawa N,Takuma K,et al.SEA0400,a novel and selective inhibitor of theNa+-Ca2+exchanger,attenuates reperfusion injury in the vitro and in vivo cerebal ischemic models[J].Phamacol Exp Ther,2001,298(1):249-56.
[10]Chu X P,Xiong Z G.Physiological and pathological functions of acid-sensing ion channels in the central nervous system[J].Curr Drug Targets,2012,13(2):263-71.
[11]Xiong Z G,Zhu X M,Chu X P,et al.Neuroprotection in ischemia:blocking calcium-permeable acid-sensing ion channels[J].Cell,2004,118(6):687-98.
[12]Gao J,Duan B,Wang D G,et al.Coupling between NMDA receptor and acidsensing ion channel contributes to ischemic neuronal death[J].Neuron,2005,48(4):635-46.
[13]Duan B,Wang Y Z,Yang T,et al.Extracellular spermine exacerbates ischemic neuronal injury through sensitization of ASIC1a channels to extracellular acidosis[J].J Neurosci,2011,31(6):2101-12.