磷酸二酯酶-4的中枢功能研究进展
文睿婷,张汉霆,冯婉玉,梁建辉
环腺苷酸(cyclic adenosine monophosphate,cAMP)和环鸟苷酸(cyclic guanosine monophosphate,cGMP)作为普遍存在于生物体内的第二信使物质,参与介导激素、神经递质及多种细胞外信号引发的生物学效应,其表达水平对调节细胞的多项生理功能具有重要意义。cAMP和cGMP的胞内浓度主要取决于两类酶的活性,即催化其生成的腺苷酸环化酶(adenylatecyclase,AC)/鸟苷酸环化酶 (guanylatecyclase,GC),以及催化其水解的磷酸二酯酶(phosphodiesterase,PDEs);两者的平衡可使细胞内cAMP和cGMP水平维持在正常范围。其中,PDEs是cAMP和cGMP在细胞内降解的唯一途径,对两者的胞内浓度起关键性调节作用。
PDEs是一个超级酶家族,根据氨基酸序列、酶促动力学特征,以及对底物的特异性和抑制剂的敏感性,可将其分为11型100余种同工酶[1]。其中,PDE 4、7、8是 cAMP的特异性水解酶,PDE 5、6、9选择性作用于 cGMP,其它 PDEs对cAMP和cGMP均可水解。PDEs在不同的组织、细胞和亚细胞区域中表达,介导特定的信号转导,精确调控细胞的各项生理功能。基于cAMP信号通路在基因表达、细胞生长、代谢和分裂过程中的重要作用,目前对其特异性水解酶PDE4的研究最为深入。大量研究提示,PDE4可作为多种疾病的潜在治疗靶点。早期研究多集中在炎症性疾病(包括哮喘、关节炎、克罗恩病和多发性硬化)方向;近年来,PDE4对中枢神经系统的调节功能逐渐受到关注,选择性PDE4抑制剂的开发也为多种神经精神疾病的治疗提供了新的思路。本文综述PDE4中枢神经系统功能的最新研究进展,并探讨其作为神经精神疾病新型治疗靶点的应用前景。
1 PDE4概述
PDE4可分为 PDE4A、PDE4B、PDE4C、PDE4D 4个亚型,分别由相互独立的A、B、C、D 4个基因编码。根据N-端序列的差异,上述4种亚型又可各自分为3~11个次亚型,由此形成至少25种不同的剪接变异体。所有PDE4变异体大致分为4类(Fig 1):长形式(long form),短形式(short form),超短形式(super-short form)和极短形式(dead-short form)[2]。长形式PDE4s含有2个位于N-端上游区的保守结构域(upstreamconserved region 1 and 2,UCR1和UCR2)。UCR1包含1个保守的 cAMP依赖的蛋白激酶 A(protein kinase A,PKA)磷酸化位点,该位点对cAMP的水解具有正性调控作用,是cAMP信号转导通路去敏感化的重要机制;短形式PDE4s(如 PDE4B2、PDE4D1、PDE4D2)含有完整的 UCR2,但缺少UCRl;超短形式仅含有部分 UCR2,此型 PDE4s包括PDE4A1、PDE4B5、PDE4D6和近期发现的 PDE4D10;极短形式PDE4s(如PDE4A7)中,UCR1和UCR2全部缺失,且其他形式PDE4中所含有的高度同源C-端水解催化结构域,在极短形式PDE4s中,N-端和 C-端均有部分缺失。除 PDE4A外,其他PDE4s在其催化结构域均含有细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)磷酸化位点,此位点的水解功能根据其所在的变异体而有所不同。ERK磷酸化可抑制长形式PDE4s活性,微弱抑制或不改变超短形式PDE4s活性,并增加短形式PDE4s活性。这是通过改变PDE4活性调控细胞内cAMP信号通路功能的又一重要机制。PDE4s的特异性结构及其对ERK活化的不同反应机制提示PDE4各亚型和剪接变异体可能参与调控不同的细胞功能。
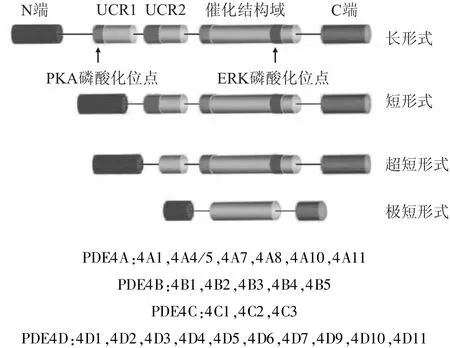
Fig 1 Structure and classification of PDE4(Zhang,2009)[2]
PDE4在体内主要存在于炎性细胞和神经细胞,这样的组织分布提示它与免疫系统和中枢神经系统的功能密切相关。目前,PDE4抑制剂的抗炎功效已被广泛认可,众多学者认为它还可能成为多种神经精神疾病候选药物。深入了解PDE4在脑内的分布情况,对于探索其中枢神经系统功能具有重要意义。
PDE4在哺乳动物(如大小鼠、猴和人等)脑内的分布基本相似,Perez-Torres等[3]通过原位杂交免疫组化和放射自显影的方法,分别观察了大鼠、猴和人脑内PDE4各亚型的分布特点。结果显示,大鼠脑组织中PDE4A和PDE4D分布基本一致,均高表达于大脑皮层、嗅觉系统、黑质、海马和脑干中;PDE4B在伏隔核、杏仁核、丘脑及下丘脑中具有优势表达,在皮层、嗅觉系统、海马和脑干中的表达不及PDE4A和PDE4D。然而,PDE4B是唯一存在于白质束、软脑膜和室管膜细胞等非神经元细胞的PDE4亚型;PDE4C被发现仅存在于嗅球中,更多地在外周组织表达。值得注意的是,PDE4D在极后区和孤束核的表达较高,推测其可能与PDE4抑制剂所致的恶心、呕吐等症状有关。神经功能学的研究结果与PDE4亚型的分布相互映证:PDE4D在抗抑郁[4]、学习记忆[5]进程中发挥重要作用,而PDE4B参与调节精神分裂症[6]、焦虑[7]等应激相关障碍。与低等动物不同,PDE4A、PDE4B和PDE4D在人脑中的分布差异较小,3者广泛分布于大脑皮层、基底神经节、海马、丘脑、小脑和脑干等结构中,以PDE4B和PDE4D的表达水平较高;PDE4C仅低表达于皮层、小脑和丘脑的一些核团。猴脑中PDE4各亚型分布与人脑基本类似,但PDE4C的表达更为局限。由此可见,PDE4各亚型的中枢分布特点可能是其不同调节机制的神经解剖学基础。
2 PDE4抑制剂
选择性PDE4抑制剂可特异性作用于细胞内PDE4,阻断cAMP的降解,使后者胞内浓度增高,从而激活PKA,使其C亚基进入核内,进而催化转录因子cAMP反应元件结合蛋白(cAMP responsive element binding protein,CREB)的丝氨酸残端磷酸化而活化。磷酸化的 CREB(phosphorylated CREB,pCREB)可与DNA分子上靶基因附近的cAMP反应元件(cAMP responsive element,CRE)结合,从而调控该基因转录的起始。选择性PDE4抑制剂因早期在哮喘和慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的临床治疗中显示出不凡的功效,成为许多制药公司的研发热点。目前,已开发的抑制剂按化学结构共可分为6类:儿茶酚醚类(代表药物为rolipram)、苯甲酰胺类(代表药物为roflumilast)、喹唑啉二酮类(nitraquazone类抑制剂)、黄嘌呤类(代表药物为茶碱)、苯并呋喃类和其他(苯并吡唑化合物等)。其中,rolipram是PDE4第一代抑制剂,极易吸收,可迅速通过血脑屏障,并发挥强大的抗炎作用。然而,由于在临床试验中易引起强烈的头晕头痛、恶心呕吐等不良反应,rolipram和同为第一代PDE4抑制剂的piclanfilast被中断试验,目前仅作为工具药物应用于临床前研究。第二代PDE4抑制剂中,Glaxo SmithKline公司的cilomilast因药物疗效和安全性相关试验结果与预期不一致,也停止进一步研发;而AltanaPharma公司的 roflumilast疗效确切,分别于2010和2011年被欧洲药品管理局(EMEA)和美国食品药品监督管理局(FDA)批准用于COPD的治疗[8],是首个获得许可用于COPD临床治疗的选择性PDE4抑制剂。除此之外,在不久前召开的2013年美国风湿病学年会(ACR/ARHP)上,Celgene公司发布了新型PDF4抑制剂apremilast治疗银屑病关节炎的3项Ⅲ期研究结果。根据其有效性和安全性数据,许多专家认为apremilast具有出色的风险/收益比,很可能成为银屑病的一线治疗药物。目前,PDF4抑制剂已发展到第3代,具有十分广阔的临床应用前景,基于PDE4及各亚型作用特点的深入研究,可有助于解决生物利用度低,不良反应多等问题,而PDE4亚型抑制剂的开发,也为研制药理活性与副作用分离的特异性治疗药物提供了新的思路。
3 PDE4的中枢作用
3.1 PDE4的抗抑郁作用 cAMP信号通路参与调节多种药物的抗抑郁效应,被认为是传统抗抑郁剂的共同作用路径。PDE4对细胞内cAMP水平的关键调控作用,使其成为抗抑郁药物治疗的靶点之一,相关研究始于约30年前。包括rolipram在内的PDE4抑制剂已被证实在多种临床前动物模型中具有抗抑郁药理活性,如对利血平诱导的低体温的翻转作用[9],对嗅球切除大鼠的抗攻击行为作用[10],以及缩短小鼠强迫游泳的不动时间[11]。随后,rolipram的抗抑郁作用在临床试验中得到证实,rolipram的抗抑郁效应具有以下3方面的特点:①对啮齿类动物、人等多个物种都具有抗抑郁药理活性,这对于将临床前研究成果转化为临床治疗手段至关重要;②作用效应具有立体特异性[9]。rolipram的(-)-异构体比(+)-形式作用效应强10~15倍,提示在新一代PDE4抑制剂的研发中应重视不同异构体的作用;③临床前研究显示,rolipram的抗抑郁效力较传统抗抑郁剂(如去甲丙米嗪、丙米嗪)要强得多[9-10]。在低反应率差速性增强(dif-ferential-reinforcement-of-low rate,DRL)行为中rolipram的抗抑郁效力是去甲丙米嗪的30余倍。此外,传统抗抑郁剂、选择性5-羟色胺再摄取抑制剂(selective serotonin re-uptake inhibitors,SSRIs)、β-肾上腺素受体激动剂都可增强 rolipram的抗抑郁效应[12],这为研究兼有PDE4抑制和传统作用机制双重效应的抗抑郁剂提供了方向。
近年来,学者们开始关注参与抗抑郁作用的具体PDE4亚型。在重复给予rolipram和其他经典抗抑郁剂后,动物脑内海马和皮层结构中的PDE4A和PDE4D表达量明显增加[13],PDE4B在伏隔核和皮层中表达增加,在海马区域表达无变化。考虑到海马神经元对抗抑郁作用的发挥至关重要,因此推测PDE4A和PDE4D在介导抗抑郁效应中发挥主要作用,而PDE4B并非介导抗抑郁作用的主要PDE4亚型。这一推测在选择性PDE4B和PDE4D基因敲除动物模型中得到证实。
3.2 PDE4在学习记忆中的作用 前期研究显示cAMP/PKA/CREB和MAPK/ERK/CREB通路对突触可塑性及记忆过程的调节起重要作用,PDE4抑制剂对上述两条关键通路均可直接激活,从而通过强化长时程突触易化及长时程增强(long term potentiation,LTP)影响学习记忆过程[14]。Navakkade等[15]的研究表明,rolipram可以明显延长早期LTP的维持时间,并可通过升高cAMP水平和增强PKA活性来诱导晚期LTP。行为学实验显示,rolipram可改善海马依赖性记忆任务,如物体识别任务、被动回避学习和恐惧记忆实验等[16];同时,rolipram对大鼠和猴的前额皮质依赖性记忆也有增强作用[17]。基于在海马 CA1区的优势分布[3],PDE4D被认为是与记忆巩固关系最密切的PDE4亚型。PDE4D基因敲除小鼠的长时程海马依赖性记忆可出现明显改善,而且给予 rolipram对此现象并无明显作用[5],提示PDE4D在记忆过程中具有关键作用。相反,PDE4B基因敲除小鼠并无获得性和巩固性的认知改变,仅出现逆反学习的受损。
阿尔采末病(Alzheimer′s disease,AD)是以 β淀粉样蛋白沉积激活小胶质细胞炎症为核心病理改变的认知障碍性疾病。在此疾病过程中,谷氨酸大量释放,导致神经元持久去极化至最终死亡,从而造成突触及LTP现象的损伤。在成年小鼠实验中,PDE4抑制剂可降低海马LTP的阈值,并逆转AD转基因小鼠模型中 Aβ1-42淀粉肽的损伤,修复LTP[18]。美国哥伦比亚大学的Ottavio Arancio等研究发现,rolipram可改善AD转基因小鼠模型的突触可塑性和记忆缺陷,作用持续停药后2个月之久,并且在老龄鼠中作用更明显,但不能改变淀粉样沉积的病理改变[19]。以上结果提示,PDE4抑制剂可能为AD患者的对症性治疗提供新的方向。
3.3 PDE4介导精神活性物质的成瘾过程 cAMP信号通路与药物奖赏负性相关作用的发现,促使PDE4抑制剂在精神活性物质中的研究不断增多。Knapp等[20]发现,PDE4选择性抑制剂rolipram和Ro 20-1724均可抑制大鼠可卡因自身给药的起始;Thompson等[21]的研究表明,rolipram可干扰小鼠对可卡因及吗啡诱导的条件性位置偏爱的形成,但不影响可卡因引起的纹状体区c-fos基因表达;另有报道提示rolipram可阻断甲基苯丙胺诱导的行为敏化作用[22],并抑制吗啡所致躯体依赖的形成[23]。最近,美国弗吉尼亚大学的张汉霆教授实验室和本实验室相继发现,rolipram和Ro 20-1724可选择性抑制 C57BL/6J小鼠[24]及 FH/Wjd大鼠[25]的摄酒行为,对天然奖赏无明显影响,再一次证实了PDE4在物质依赖形成和维持过程中的重要作用。究其作用机制可能与增强药物成瘾相关脑区(如纹状体、杏仁核)的cAMP信号通路功能有关。另有证据显示,rolipram可直接增加体外培养的中脑神经元及在体纹状体的多巴胺释放和(或)生成[26]。基于中脑边缘多巴胺系统在成瘾性物质强化和奖赏过程中的重要作用,推测PDE4抑制剂的抑制成瘾效应可能通过对多巴胺能神经传导的调节而实现,但其具体作用机制及PDE4各亚型的功能还有待更为深入的研究。
3.4 PDE4对中枢神经系统损伤的调节作用 许多研究证实cAMP不仅可提高神经元的存活,还可诱导神经元或其轴突的再生,其作用接近多种神经营养因子联合应用的效果,由此推测PDE4抑制剂对中枢神经系统相关损伤也有一定的缓解作用。通过对局灶性和全脑缺血/再灌注损伤的动物模型研究发现,rolipram治疗能明显改善该损伤所致的学习记忆功能障碍和神经元缺失[27]。进一步的机制学研究表明,缺血/再灌注损伤后的大鼠全脑PDE4活性升高,经rolipram治疗后PDE4活性有所降低,提示rolipram对缺血/再灌损伤的抵抗作用可能与其对PDE4活性的影响有关[28]。此外,在物理性因素所致的急性脊髓损伤中,rolipram也通过抑制cAMP水平的降低,抑制细胞凋亡,并起一定的保护作用[29]。以上保护作用的机制可能为以下3方面:① 通过cAMP通路,调控bcl-2等凋亡相关基因的表达,减少细胞凋亡;②由于上述两种损伤都涉及炎性因子的参与,因此,rolipram可能通过抗炎机制发挥保护作用;③ 提高cAMP水平可能增强神经内在生长能力和加强营养因子的作用。
3.5 PDE4其它的中枢作用 除上述发现外,PDE4抑制剂在临床前研究中还被证实具有一定的抗精神病活性[8],PDE4B可能是介导这一作用的主要PDE4亚型。此外,rolipram还可改善帕金森病(Parkinson′s disease,PD)动物模型中MPTP所致的神经毒性损伤,对大鼠的迟发性运动障碍也有一定的抑制作用。另有学者认为,PDE4很可能是治疗脑肿瘤的潜在靶点[30],相应的临床前和临床研究正在进行中。
4 结语
综上所述,PDE4可通过对cAMP信号转导的调控,发挥抗抑郁、改善认知记忆、阻断药物依赖的形成以及维持和促进神经细胞生存等功能。对PDE4的干预和调节,为治疗抑郁症、AD、药物滥用及脑缺血等疾病导致的神经功能损伤提供了全新的治疗思路和用药策略。深入探讨PDE4及其各亚型在中枢神经系统中的具体功能和调控机制,将会为神经精神疾病的治疗带来新的希望。
参考文献:
[1] Bender A T,Beavo J A.Cyclic nucleotide phosphodiesterases:molecular regulation to clinical use[J].Pharmacol Rev,2006,58(3):488-520.
[2] Zhang H T.Cyclic AMP-specific phosphodiesterase-4 as a target for the development of antidepressant drugs[J].Curr Pharm Des,2009,15(14):1688-98.
[3] Perez-Torres S,Miro X,Palacios J M,et al.Phosphodiesterase type 4 isozymes expression in human brain examined by in situ hybridization histochemistry and[3H]rolipram binding autoradiography:Comparison with monkey and rat brain[J].J Chem Neuroanatomy,2000,20(3-4):349-74.
[4] Zhang H T,Huang Y,Jin SL,et al.Antidepressant-like profile and reduced sensitivity to rolipram in mice deficient in the PDE4D phosphodiesterase enzyme[J].Neuropsychopharmacology,2002,27(4):587-95.
[5] Li Y F,Cheng Y F,Huang Y,et al.Phosphodiesterase-4D knock-out and RNA interference-mediated knock-down enhance memory and increase hippocampal neurogenesis via increased cAMP signaling[J].J Neurosci,2011,31(1):172-83.
[6] Millar JK,Pickard B S,Mackie S,et al.DISC1 and PDE4B are interacting genetic factors in schizophrenia that regulate cAMPsignaling[J].Science,2005,310(5751):1187-91.
[7] Zhang H T,Huang Y,Masood A,et al.Anxiogenic-like behavioral phenotype of mice deficient in phosphodiesterase 4B(PDE4B)[J].Neuropsychopharmacology,2008,33(7):1611-23.
[8] Giembycz M A,Field SK.Roflumilast:first phosphodiesterase-4 inhibitor approved for treatment of COPD[J].Drug Des Devel T-her,2010,21(4):147-58.
[9] Wachtel H.Potential antidepressant activity of rolipram and other selective cyclic adenosine 3′,5′-monophosphate phosphodiesterase inhibitors[J].Neuropharmacology,1983,22(3):267-72.
[10]Mizokawa T,Kimura K,Ikoma Y,et al.The effect of a selective phosphodiesterase inhibitor,rolipram,on muricide in olfactory bulbectomized rats[J].Jpn J Pharmacol,1988,48(3):357-64.
[11] Przegalinski E,Bigajska K.Antidepressant properties of some phosphodiesterase inhibitors[J].Pol J Pharmacol Pharm,1983,35:233-40.
[12]Zhang H T,Huang Y,Mishler K,et al.Interaction between the antidepressant-like behavioral effects of beta adrenergic agonists and the cyclic AMP PDE inhibitor rolipram in rats[J].Psychopharmacology(Berl),2005,182(1):104-15.
[13]Dlaboga D,Hajjhussein H,O′Donnell J M.Regulation of phosphodiesterase-4(PDE4)expression in mouse brain by repeated antidepressant treatment:comparison with rolipram[J].Brain Res,2006,1096(1):104-12.
[14]王 闯,程玉芳,张汉霆,徐江平.磷酸二酯酶抑制剂与学习记忆相关信号转导通路研究进展[J].中国药理学通报,2009,25(7):844-7.
[14]Wang C,Cheng Y F,Zhang H T,Xu J P.Progress in the relationship of phosphodiesterases inhibitors and signal transduction pathway associated with learning and memory[J].Chin Pharmacol Bull,2009,25(7):844-7.
[15]Navakkode S,Sajikumar S,Frey J U.The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal longterm potentiation and synaptic tagging[J].J Neurosci,2004,24(35):7740-77.
[16]Zhang H T,Huang Y,Suvarna N U,et al.Effects of the novel PDE4 inhibitors MEM1018 and MEM1091 on memory in the radial-arm maze and inhibitory avoidance tests in rats[J].Psychopharmacology(Berlin,Ger.),2005,179(3):613-9.
[17]Ramos B P,Birnbaum SG,Lindenmayer I,et al.Dysregulation of protein kinase a signaling in the aged prefrontal cortex:new strategy for treating age-related cognitive decline[J].Neuron,2003,40(4):835-45.
[18]Vitolo O V,San′t Angelo A,Costanzo V,et al.Amyloid beta-Peptide inhibition of the PKA/CREB pathway and long-term potentiation reversibility by drugs that enhance cAMP signaling[J].Proc Natl Acad Sci USA,2002,99(20):13217-21.
[19]Gong B,Vitolo O V,Trinchese F,et al.Persistent improvement in synaptic and cognitive functions in an Alzheimer mouse model after rolipram treatment[J].JClin Invest,2004,114(11):1624-34.
[20]Knapp C M,Foye M M,Ciraulo D A,Kornetsky C.The type IV phosphodiesterase inhibitors,Ro 20-1724 and rolipram,block the initiation of cocaine self-administration[J].Pharmacol Biochem Behav,1999,62(1):151-8.
[21]Thompson B E,Sachs B D,Kantak K M,Cherry J A.The type IV phosphodiesterase inhibitor rolipram interferes with drug-induced conditioned place preference but not immediate early gene induction in mice[J].Eur J Neurosci,2004,19(9):2561-8.
[22]Iyo M,Bi Y,Hashimoto K,et al.Prevention of methamphetamine-induced behavioral sensitization in rats by a cyclic AMP phosphodiesterase inhibitor,rolipram[J].Eur J Pharmacol,1996,312(2):163-70.
[23]Mamiya T,Noda Y,Ren X,et al.Involvement of cyclic AMP systems in morphine physical dependence in mice:prevention of development of morphine dependence by rolipram,a phosphodiesterase 4 inhibitor[J].Br J Pharmacol,2001,132(5):1111-7.
[24]Hu W,Lu T,Chen A,et al.Inhibition of phosphodiesterase-4 decreases ethanol intake in mice[J].Psychopharmacology,2011,218(2):331-9.
[25]Wen R T,Zhang M,Qin W J,et al.The phosphodiesterase-4(PDE4)inhibitor rolipram decreases ethanol seeking and consumption in alcohol-preferring fawn-hooded rats[J].Alcohol Clin Exp Res,2012,36(12):2157-67.
[26]Nishi A,Kuroiwa M,Miller D B,et al.Distinct roles of PDE4 and PDE10A in the regulation of cAMP/PKA signaling in the striatum[J].J Neurosci,2008,28(42):10460-71.
[27]刘 旭,程玉芳,张汉霆,徐江平.咯利普兰对局灶性脑缺血/再灌注损伤大鼠学习记忆及海马PDE4活性的影响[J].中国病理生理杂志,2008,24(6):1096-100.
[27]Liu X,Cheng Y F,Zhang H T,Xu J P.Effects of rolipram on learn ing and memory and the activity of PDE4 in hippocampus following the focal brain injury induced by ischemia-reperfusion in rats[J].Chin J Pathophysiol,2008,24(6):1096-100.
[28]李凌霞,程玉芳,王 闯,等.咯利普兰对全脑缺血/再灌注损伤大鼠的影响[J].中国药学杂志,2009,44(9):665-9.
[28]Li L X,Cheng Y F,Wang C,et al.Effects of rolipram on global cerebral injury induced by ischemia-reperfusion[J].Chin Pharm J,2009,44(9):665-9.
[29]祁 全,毕郑钢,张 磊,等.Rolipram对大鼠急性脊髓损伤的保护作用[J].中国脊柱脊髓杂志,2008,18(10):766-71.
[29]Qi Q,Bi Z G,Zhang L,et al.Study of Rolipram on the neuroprotection of acute spinal cord injury in rat[J].Chin J Spine Spinal Cord,2008,18(10):766-71.
[30]Sengupta R,Sun T,Warrington N M,et al.Treating brain tumors with PDE4 inhibitors[J].Trends Pharmacol Sci,2011,32(6):337-44.

