祖卡木颗粒大鼠灌胃长期毒性研究
窦勤,闫明,李柯翱,李治建,热比姑丽·伊斯拉木,艾西木江·热甫卡提,季志红
(1.新疆维吾尔自治区维吾尔医药研究所,乌鲁木齐 830049;2.新疆维吾尔医方剂学实验室,乌鲁木齐 830049;3.新疆奇康哈博维药有限公司,乌鲁木齐 830001)
祖卡木颗粒大鼠灌胃长期毒性研究
窦勤1,2,闫明1,2,李柯翱3,李治建1,2,热比姑丽·伊斯拉木1,2,艾西木江·热甫卡提1,2,季志红3
(1.新疆维吾尔自治区维吾尔医药研究所,乌鲁木齐 830049;2.新疆维吾尔医方剂学实验室,乌鲁木齐 830049;3.新疆奇康哈博维药有限公司,乌鲁木齐 830001)
目的 观察SD大鼠反复灌胃给予祖卡木颗粒的长期毒性反应。方法SD大鼠120只,雌雄各半,按体质量随机分为对照组及低、中、高剂量组。对照组给予羧甲基纤维素钠,低、中、高剂量组分别给予祖卡木颗粒0.72,1.43, 2.86 g·kg-1·d-1,po,qd,连续1个月;停药后恢复期2周。结果高剂量组3只动物仅给药期间出现1 d稀便、腹泻。给药末期,与对照组比较,高剂量组白细胞计数、红细胞计数、血红蛋白、血细胞比容及氯水平升高,低、中、高剂量组凝血酶原时间缩短;低、中、高剂量组血尿素氮、丙氨酸氨基转移酶、总胆固醇、天冬氨酸氨基转移酶降低,组织病理学检查无明显变化。结论祖卡木颗粒连续灌胃1个月,对大鼠无明显毒性,未见明显毒性反应剂量为1.4 g·kg-1·d-1(相当于生药20.8 g·kg-1·d-1)。
祖卡木颗粒;大鼠;毒性;长期
祖卡木颗粒是维吾尔医临床常用、具有代表性的特色经典方剂,由山奈、睡莲花、薄荷、大枣、洋甘菊、破布木果、甘草、蜀葵子、大黄、罂粟壳10味药材组成,具有调节异常气质、清热、发汗、通窍功能,用于治疗感冒咳嗽、发热无汗、咽喉肿痛、鼻塞流涕。为对其临床应用安全性进行再评价,本研究通过大鼠长期毒性实验,探讨其毒性表现和毒性靶器官。
1 材料与方法
1.1 动物 SD大鼠,SPF级,雌雄各半,体质量180~220 g,由新疆实验动物研究中心提供,实验动物生产许可证号:SCXK(新)2011-0001,动物合格证号: SCXK-LAC2013-4-3,实验动物使用许可证号:SYXK (新)2011-0006。动物于GCP中心SPF级动物房饲养,每笼饲养同性动物≤5只,自由摄食、饮水,室温20~26℃,相对湿度40%~70%,光照12 h,黑暗12 h。
1.2 药品与试剂 祖卡木颗粒干浸膏由新疆奇康哈博维药有限公司提供,批号:130103,1 g干浸膏相当于生药14.88 g;羧甲基纤维素钠(sodiumcarboxymethy cellulose,CMC-Na)对照品,天津市光复精细化工研究所提供,批号:100409。血液生化试剂由深圳迈瑞生物医疗电子股份有限公司提供,具体包括:丙氨酸氨基转移酶(alanine aminotransferase,ALT,批号:140113002),天冬氨酸氨基转移酶(aspartate aminotransferase,AST,批号:140213002),碱性磷酸酶(alkaline phosphatase, ALP,批号:140313001),血尿素氮(blood urea nitrogen, BUN,批号:141313002),肌酐(creatinine,Cr,批号:14102028),总蛋白(totalprotein,TP,批号: 140813002),清蛋白(albumin,ALB,批号: 140913002),总胆固醇(total cholesterol,CHO,批号: 141613001),血糖(glucose,Glu,批号:141513001),总胆红素(total bilirubin,TBiL,批号:140613002),肌酸磷酸激酶(creatine kinase,CK,批号:142512018),三酰甘油(triglycerides,TG,批号:1141712030)。血液学试剂由希森美康医用电子(上海)有限公司提供(批号: 105198);血凝试剂由上海太阳生物技术有限公司提供,白细胞FFS-801分类染色液,批号:A2007;白细胞分类溶血素,批号:A2008;网红细胞RED-800染色液,批号:ZA2042;网红细胞RED-300染色液稀释液,批号:ZA2042;血色素SLS-220A检测液,批号:A2026;嗜碱通道FBA-200A溶血素,批号:A2022。电解质试剂由郑州市希莱恒医用电子有限公司提供(A标,批号: 20130314;B标,批号:20130320)。
1.3 仪器 7100型全自动生化分析仪,日立公司。XT-2000iv全自动血液分析仪,sysmex corporation。KOBE,JAPAN;S22血凝仪,深圳市鹏瑞佳电子有限公司。XR2000电解质仪,深圳市鹏瑞佳电子有限公司。DM2500生物显微镜,德国莱卡公司。RM2235切片机,德国莱卡公司。KD-BM生物组织自动包埋机,浙江金华科迪仪器设备有限公司。生物组织自动脱水机:KD-TS3D,浙江金华科迪仪器设备有限公司。摊片烤片机:KZPG-1A,天津天利航空机电有限公司。
1.4 实验方法[1-3]
1.4.1 动物分组 120只SD大鼠检疫1周后,按体质量随机分为4组,每组30只,雌雄各半,分别为对照组和低、中、高剂量组。
1.4.2 剂量设计 祖卡木颗粒以供试品计算,成人用量为2.862 g·d-1,成人体质量按60 kg计算,即成人每日用供试品的量为2.862g/60kg= 0.047 7 g·kg-1。低、中、高剂量组分别为临床成人每日每千克体质量用量的15,30,60倍,分别为0.72 (生药10.4 g)、1.43(生药20.8 g)、2.86(生药41.6 g)g·kg-1。
1.4.3 给药方法与观察指标 将供试品灌胃给予大鼠,1 mL·(100 g)-1,每天1次,连续1个月,对照组给予等量CMC-Na。每天观察并记录动物的外观体征、行为活动、饮食、大便、体质量等情况,出现中毒反应应重点观察。每4 d称体质量1次,并根据体质量情况调整给药量,于停药后24 h,各组分别处死大鼠20只,进行全面、细致的系统尸检,取脑、心、肝、脾、肺、肾、肾上腺、胸腺、睾丸、附睾、子宫、卵巢等称定质量,计算脏器器官系数;对大脑、小脑、脑干、脊髓、垂体、胸腺、甲状腺与甲状旁腺、食管、唾液腺、胃、小肠、结肠、肝脏、胆囊、肾脏、肾上腺、脾、胰腺、气管、肺、主动脉、心脏、附睾、睾丸、卵巢、子宫、前列腺、膀胱、视神经、肠系膜淋巴结、胸骨骨髓等脏器,用15%中性甲醛固定,首先对高剂量组和对照组动物标本进行常规石蜡包埋、切片,苏木精-伊红(hematoxylin-eosin,HE)染色,光镜检查,观察脏器组织病理变化。分别测定血液学:红细胞计数(red blood cell count,RBC)、血细胞比容(hematocrit,HCT)、平均红细胞血红蛋白含量(mean corpuscularhemoglobin,MCH)、网织红细胞(reticulocyte,RET)、血小板计数(platelet count,PLT)、血红蛋白(hemoglobin,HGB)、平均红细胞体积(meancorpuscular volume,MCV)、平均红细胞血红蛋白浓度(meancorpuscularhemoglobinconcentration, MCHC)、白细胞计数(white blood cell count,WBCCD)、淋巴细胞数目(lymphocytes,LYMPH)、单核细胞计数(monocyte count,MC)、粒细胞计数(granulocyte count,GRAN)、凝血酶原时间(prothromvin time,PT)和血液生化学指标:ALT、AST、ALP、BUN、Cr、TP、ALB、CHO、Glu、T-BiL、CK、TG、钾(kalium,K+)、钠(natrium, Na+)、氯(chlorin,Cl-)。剩余大鼠继续饲养2周,同样进行上述观察和检测。通过上述观察和检测,了解大鼠在给药期间的毒性反应及停药后一段时间内的恢复情况。
2 结果
2.1 一般状况 高剂量组3只动物给药第10,25,37天出现稀便、腹泻,其他组动物无明显异常,各给药组进食量和体质量与对照组比较差异无统计学意义。
2.2 脏器质量和脏器系数 祖卡木颗粒给药1个月和恢复期,各给药组脏器质量和脏器系数与对照组比较,差异无统计学意义。
2.3 血液学检查 给药末期:♂高剂量组RBC、HGB、HCT较对照组升高(P<0.01),♂低剂量组的HGB,中、高剂量组HCT较对照组升高(P<0.05),♂低、中、高剂量组PT较对照组缩短(P<0.01);♀中剂量组WBC比较对照组显著升高(P<0.01)。除上述指标外,其余血液学指标与对照组比较差异无统计学意义;恢复期结束,♂高剂量组NEUT较对照组升高(P<0.05),LYMPH较对照组降低(P<0.05)。其余血常规指标与对照组比较差异无统计学意义,见表1,2。
表1 4组大鼠灌胃长期毒性实验给药30 d血液学指标检测结果Tab.1 Hematological indexes of four groups of rats after 30-day oral treatment in long termtoxicity test ±s,n=10
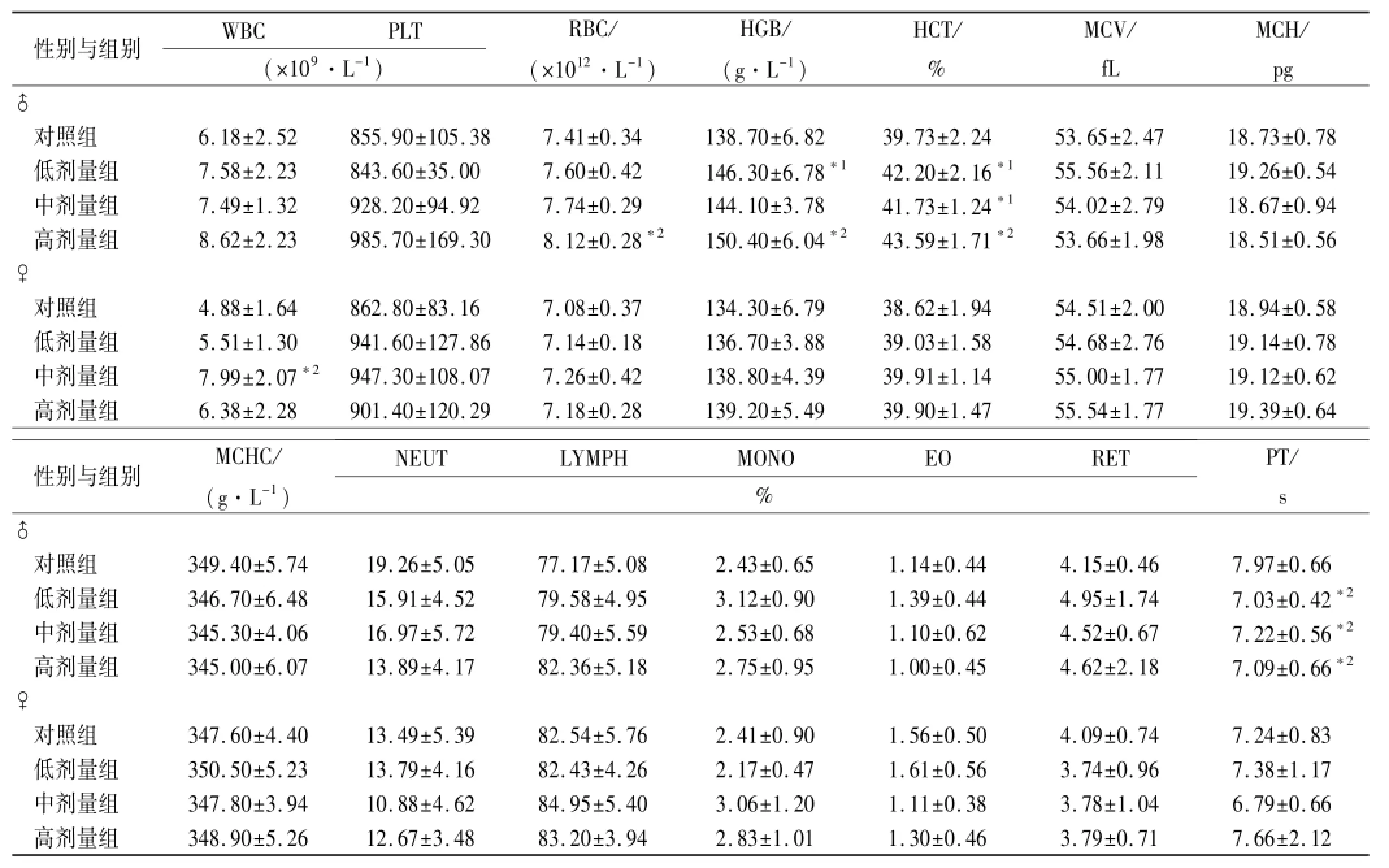
表1 4组大鼠灌胃长期毒性实验给药30 d血液学指标检测结果Tab.1 Hematological indexes of four groups of rats after 30-day oral treatment in long termtoxicity test ±s,n=10
与对照组比较,*1P<0.05,*2P<0.01Compared with control group,*1P<0.05,*2P<0.01
?
表2 4组大鼠停药2周血液学指标检测结果Tab.2 Hematological indexes of four groups of rats two weeks after drug withdrawal ±s,n=5
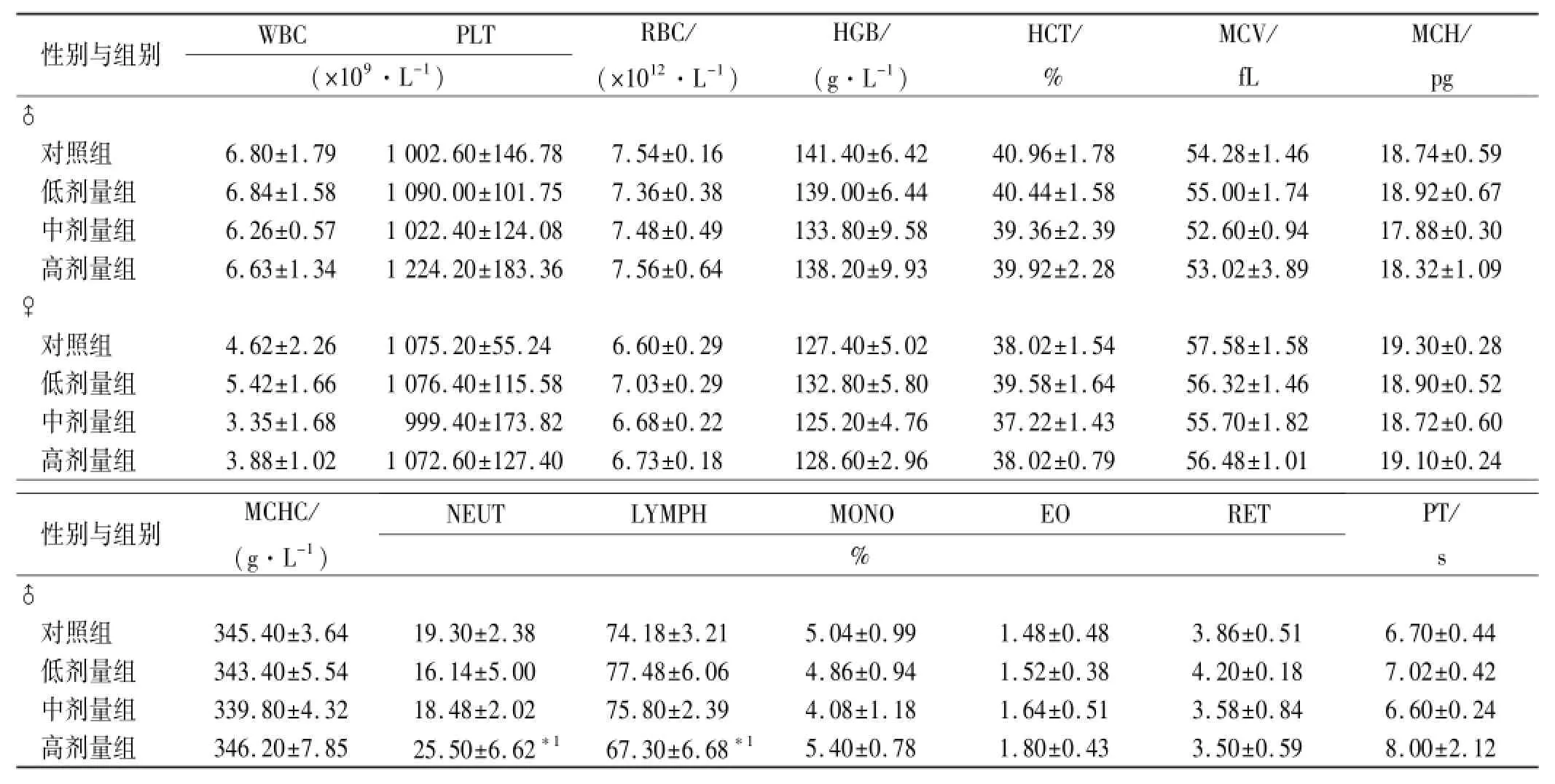
表2 4组大鼠停药2周血液学指标检测结果Tab.2 Hematological indexes of four groups of rats two weeks after drug withdrawal ±s,n=5
?
续表2Tab.2 ±s,n=5
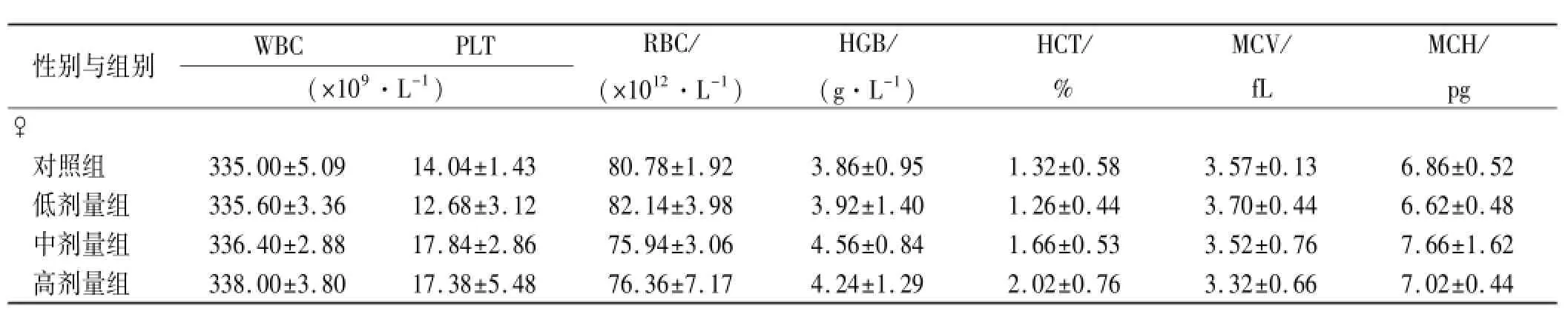
续表2Tab.2 ±s,n=5
与对照组比较,*1P<0.05Compared with control group,*1P<0.05
性别与组别WBCPLT (×109·L-1) RBC/ (×1012·L-1) HGB/ (g·L-1) HCT/ % MCV/ fL MCH/ pg♀对照组335.00±5.0914.04±1.4380.78±1.923.86±0.951.32±0.583.57±0.136.86±0.52低剂量组335.60±3.3612.68±3.1282.14±3.983.92±1.401.26±0.443.70±0.446.62±0.48中剂量组336.40±2.8817.84±2.8675.94±3.064.56±0.841.66±0.533.52±0.767.66±1.62高剂量组338.00±3.8017.38±5.4876.36±7.174.24±1.292.02±0.763.32±0.667.02±0.44
2.4 血液生化指标和电解质检查结果 给药末期:♂高剂量组BUN、ALT较对照组降低(P<0.01),♂低、中剂量组CHO,低、高剂量组AST较对照组降低(P<0.05),除上述指标外,其余生化学指标与对照组比较差异无统计学意义;恢复期:♂高剂量组Cl-较对照组升高(P<0.05),除上述指标外,其余生化学指标与对照组比较差异无统计学意义,见表3,4。
2.5 解剖检查 给药结束和恢复期结束对大鼠进行解剖,各组动物大体解剖检查肉眼未见脏器异常。
2.6 组织病理学检查 给药结束、恢复期结束组织病理学检查,高剂量组肺间质淋巴细胞及单核细胞浸润,大肠黏膜下淋巴细胞浸润,肝细胞点状坏死,这些病理改变在对照组动物中也有发现,与给药组比较病变数量及程度未见明显差异,病变范围小、程度轻,符合SD大鼠常见自发性病变,故考虑与药物作用无关。本实验条件下,未发现明显药物相关性病理改变,亦无明显靶器官。
表3 4组大鼠给药30 d血生化指标检测结果Tab.3 Hematological biochemical indexes of four groups of rats after 30-day treatment ±s,n=10
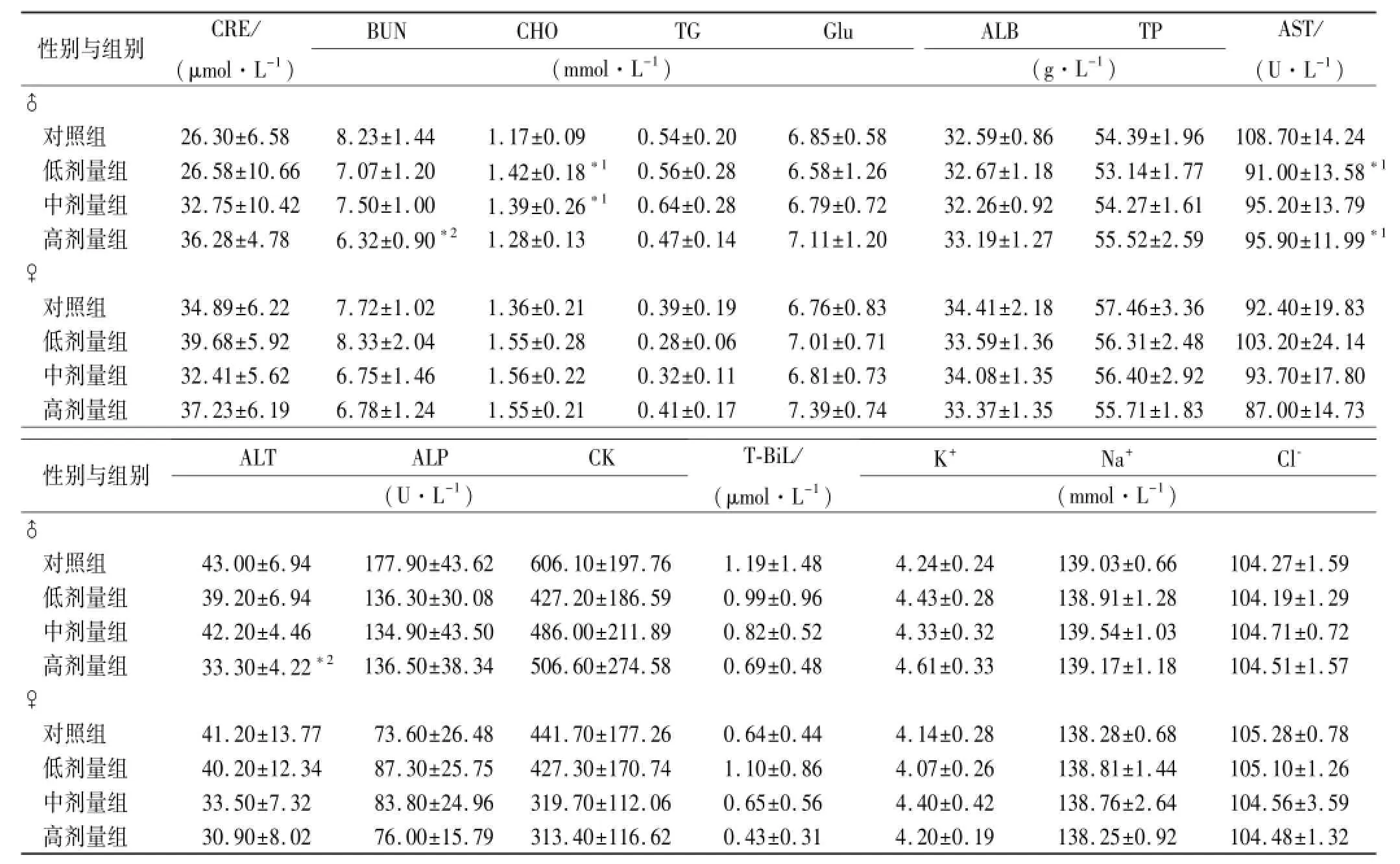
表3 4组大鼠给药30 d血生化指标检测结果Tab.3 Hematological biochemical indexes of four groups of rats after 30-day treatment ±s,n=10
与对照组比较,*1P<0.05,*2P<0.01Compared with control group,*1P<0.05,*2P<0.01
性别与组别CRE/ (μmol·L-1) BUNCHOTGGlu (mmol·L-1) ALBTP (g·L-1) AST/ (U·L-1)♂对照组26.30±6.588.23±1.441.17±0.090.54±0.206.85±0.5832.59±0.8654.39±1.96108.70±14.24低剂量组26.58±10.667.07±1.201.42±0.18*10.56±0.286.58±1.2632.67±1.1853.14±1.7791.00±13.58*1中剂量组32.75±10.427.50±1.001.39±0.26*10.64±0.286.79±0.7232.26±0.9254.27±1.6195.20±13.79高剂量组36.28±4.786.32±0.90*21.28±0.130.47±0.147.11±1.2033.19±1.2755.52±2.5995.90±11.99*1♀对照组34.89±6.227.72±1.021.36±0.210.39±0.196.76±0.8334.41±2.1857.46±3.3692.40±19.83低剂量组39.68±5.928.33±2.041.55±0.280.28±0.067.01±0.7133.59±1.3656.31±2.48103.20±24.14中剂量组32.41±5.626.75±1.461.56±0.220.32±0.116.81±0.7334.08±1.3556.40±2.9293.70±17.80高剂量组37.23±6.196.78±1.241.55±0.210.41±0.177.39±0.7433.37±1.3555.71±1.8387.00±14.73性别与组别ALTALPCK (U·L-1) T-BiL/ (μmol·L-1) K+Na+Cl-(mmol·L-1)♂对照组43.00±6.94177.90±43.62606.10±197.761.19±1.484.24±0.24139.03±0.66104.27±1.59低剂量组39.20±6.94136.30±30.08427.20±186.590.99±0.964.43±0.28138.91±1.28104.19±1.29中剂量组42.20±4.46134.90±43.50486.00±211.890.82±0.524.33±0.32139.54±1.03104.71±0.72高剂量组33.30±4.22*2136.50±38.34506.60±274.580.69±0.484.61±0.33139.17±1.18104.51±1.57♀对照组41.20±13.7773.60±26.48441.70±177.260.64±0.444.14±0.28138.28±0.68105.28±0.78低剂量组40.20±12.3487.30±25.75427.30±170.741.10±0.864.07±0.26138.81±1.44105.10±1.26中剂量组33.50±7.3283.80±24.96319.70±112.060.65±0.564.40±0.42138.76±2.64104.56±3.59高剂量组30.90±8.0276.00±15.79313.40±116.620.43±0.314.20±0.19138.25±0.92104.48±1.32
表4 4组大鼠停药2周血生化指标检测结果Tab.4 Hematological biochemical indexes of four groups of rats after 30-day treatment ±s,n=5
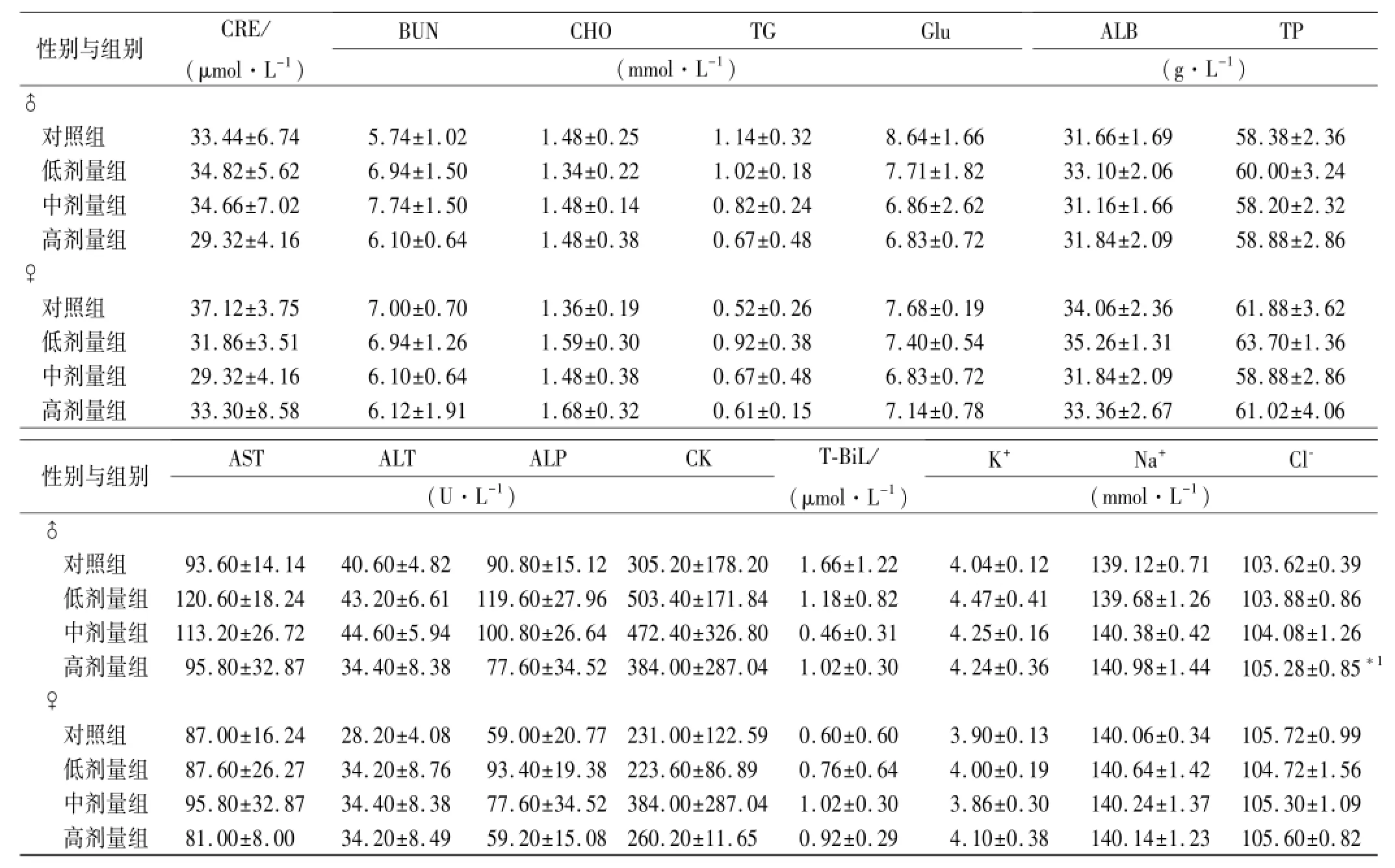
表4 4组大鼠停药2周血生化指标检测结果Tab.4 Hematological biochemical indexes of four groups of rats after 30-day treatment ±s,n=5
与对照组比较,*1P<0.05Compared with control group,*1P<0.05
性别与组别CRE/ (μmol·L-1) BUNCHOTGGlu (mmol·L-1) ALBTP (g·L-1)♂对照组33.44±6.745.74±1.021.48±0.251.14±0.328.64±1.6631.66±1.6958.38±2.36低剂量组34.82±5.626.94±1.501.34±0.221.02±0.187.71±1.8233.10±2.0660.00±3.24中剂量组34.66±7.027.74±1.501.48±0.140.82±0.246.86±2.6231.16±1.6658.20±2.32高剂量组29.32±4.166.10±0.641.48±0.380.67±0.486.83±0.7231.84±2.0958.88±2.86♀对照组37.12±3.757.00±0.701.36±0.190.52±0.267.68±0.1934.06±2.3661.88±3.62低剂量组31.86±3.516.94±1.261.59±0.300.92±0.387.40±0.5435.26±1.3163.70±1.36中剂量组29.32±4.166.10±0.641.48±0.380.67±0.486.83±0.7231.84±2.0958.88±2.86高剂量组33.30±8.586.12±1.911.68±0.320.61±0.157.14±0.7833.36±2.6761.02±4.06性别与组别ASTALTALPCK (U·L-1) T-BiL/ (μmol·L-1) K+Na+Cl-(mmol·L-1)♂对照组93.60±14.1440.60±4.8290.80±15.12305.20±178.201.66±1.224.04±0.12139.12±0.71103.62±0.39低剂量组120.60±18.2443.20±6.61119.60±27.96503.40±171.841.18±0.824.47±0.41139.68±1.26103.88±0.86中剂量组113.20±26.7244.60±5.94100.80±26.64472.40±326.800.46±0.314.25±0.16140.38±0.42104.08±1.26高剂量组95.80±32.8734.40±8.3877.60±34.52384.00±287.041.02±0.304.24±0.36140.98±1.44105.28±0.85*1♀对照组87.00±16.2428.20±4.0859.00±20.77231.00±122.590.60±0.603.90±0.13140.06±0.34105.72±0.99低剂量组87.60±26.2734.20±8.7693.40±19.38223.60±86.890.76±0.644.00±0.19140.64±1.42104.72±1.56中剂量组95.80±32.8734.40±8.3877.60±34.52384.00±287.041.02±0.303.86±0.30140.24±1.37105.30±1.09高剂量组81.00±8.0034.20±8.4959.20±15.08260.20±11.650.92±0.294.10±0.38140.14±1.23105.60±0.82
3 讨论
祖卡木颗粒不同剂量连续灌胃1个月,大鼠一般症状表现为给药组随着剂量的增加,高剂量组给药期间出现稀便、腹泻,但仅1 d,各给药组动物体质量、进食量与对照组比较差异无统计学意义,表明祖卡木颗粒对大鼠的体质量和进食量基本无影响。
血液学检查表明,给药末期RBC、HGB、HCT、PT指标虽然与对照组比较有所增减,偶有统计学意义,但绝对值差别较小,多为一个剂量所致,无明显剂量相关性。血生化指标和电解质检查表明,给药末期BUN与对照组比较偶有差异,是数值降低而非升高,但变化无剂量规律性,肾脏组织病理学光镜检查未见明显病变,认为本品无肾脏毒性;给药末期AST、ALT与对照组比较偶有差异,变化无剂量规律性,且数值下降,无明显病理意义,肝脏组织病理学光镜检查未见明显病变,认为本供试品无肝毒性。给药末期CHO与对照组比较偶有差异,但变化差值很小,无剂量规律性,认为本供试品无升高CHO作用。恢复期Cl-电解质指标与对照组比较,虽有统计学差异,但考虑与标准差过小有关,变化无剂量规律性,且变化绝对值差别较小,认为供试品无升高Cl-的作用。
组织病理学检查:各组间脏器病变例数差异不大,考虑为动物自身病变,而非药物毒性所致,其余脏器未见明显病理变化。综上所述,在本实验条件下,祖卡木颗粒对SD大鼠无明显药物关联性毒性靶器官,祖卡木颗粒对大鼠的未见明显毒性反应剂量为1.4 g·kg-1·d-1(相当于生药20.8 g·kg-1·d-1)[4]。
[1] 袁伯俊,缪明阳,李波.药物毒理学实验方法与技术[M].北京:化学工业出版社,2007:200-210.
[2] 徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2003:226-229.
[3] 热比姑丽·伊斯拉木.新疆曼陀罗子及其代表制剂艾比西帕丸的大鼠长期毒性实验[J].中国药理学通报,2011, 27(10):1479-1480.
[4] 易沙克江·马合穆德.中国医学百科全书-维吾尔医学[M].上海:上海科学技术出版社,2005:302-303.
DOI 10.3870/yydb.2014.07.008
Studies on the Chronic Toxicity of Zukamu Granules in Rats
DOU Qin1,2,YAN Ming1,2,LI Ke-ao3,LI Zhi-Jian1,2,RABIGUL·Islam1,2,HAXIMJAN Rapkat1,2,JI Zhi-hong3
(1.Institute of Xinjiang Traditional Uyghur Medicine,Urumqi 830049,China;2.Laboratory of Traditional Uyghur Medicine Prescription of Xinjiang,Urumqi 830049,China;3.Xinjiang Ciconhabo Uygur Medicine Co., Ltd,Urumqi 830001,China)
ObjectiveTo study the chronic toxicology ofZukamugranules in rats.MethodsA total of 120 healthy SD rats(male∶female=1∶1)were randomly divided into the control,low(0.72 g·kg-1·d-1),middle (1.43 g·kg-1·d-1),and high(2.86 g·kg-1·d-1)doses ofZukamugranules.The drug was given orally,once daily for a month,and the controls were given with sodiumcarboxymethyl cellulose.A 2-week recovery period was allowed after the drug withdrawal.ResultsThree rats in the high dose group developed diarrhea and loose stools for one day.Compared with the control group,the white blood cells(WBC),red blood cells(RBC),hemoglobin(HGB),hematocrit(HCT)and chlorine(Cl-) in the high dose group increased.Prothrombin time(PT),blood urea nitrogen(BUN),alanine aminotransferase(ALT), cholesterol(CHO),and aspartate aminotransferase(AST)decreased markededly in the low,middle and high dose group.No obvious change was found in histopathological examination.ConclusionNo obvious toxicity was observed in SD rats treated withZukamugranules at 1.4g·kg-1·d-1(equivalently to crude drug of 20.8 g·kg-1·d-1)given orally for one month.
Zukamugranula;Rat;Toxicity,chronic
R286;R965
A
1004-0781(2014)07-0869-05
2013-08-22
2013-09-25
窦勤(1977-),女,新疆奇台人,助理研究员,硕士,主要从事药理毒理学研究。E-mail:douqin123@sina.com。
季志红(1961-),女,副主任药师,研究方向:项目管理。E-mail:jizhihongdyy@163.com。

