大杯蕈子实体多糖提取优化及抗氧化活性分析
张 晨,赵法茂,胡春龙,刘正帅,刘贵芬,贾 晓
(1.山东农业大学作物生物学国家重点实验室,山东泰安 271000;2.泰山学院生物与酿酒工程学院,山东泰安 271021)
大杯蕈(Clitocybe maxima)在真菌分类学上,属担子菌纲(Basidiomycetes)、口蘑科(Tricholomataceae).大杯蕈营养丰富,蛋白质含量丰富,必需氨基酸的数量及组成比一般食用菌更接近模式蛋白.另还含有多种人体必需的矿物元素,如锌、钼、钴等微量元素.经全国各地引种栽培,大杯蕈已实现规模化生产,市场前景广阔.近几年来,食用菌多糖在人体医疗保健中的作用日益引起人们的关注.食药用多糖的组成和结构主要有以下几种类型:(1)葡聚糖,是食用菌多糖中的主要构成部分,其主链是由β-1,3糖苷键连接,支链由β-1,6糖苷键连接,如香菇多糖;(2)甘露聚糖,其主链是由α-1,4糖苷键连接,如灵芝多糖;(3)杂多糖;(4)糖蛋白和多糖肽等[1-2].
食用菌多糖是能够控制细胞分裂分化,调节细胞生长衰老的一类活性多糖,主要由几丁质和β-(1,3)-D-葡聚糖构成,它主要是从担子菌与子囊菌子实体、菌丝体和发酵液中分离出的具有生物活性的天然高分子多聚物.药理实验表明,食用菌多糖具有调节人体机能、提高免疫力、增强骨髓造血功能及抗辐射、抗癌、抗病毒、抗肿瘤、延缓衰老、降血脂、促进儿童生长发育等生理功能[3];还可通过非特异性途径,提高机体对抗原或微生物病原体的特异性反应[4],因而被称为“生物应答调节剂”.目前国内外对大杯蕈研究主要集中在探讨其生物学特性、化学组成成分、营养价值及高产栽培技术等,但对其含有的生物活性成分尤其是多糖的研究比较缺乏[5-6].本实验拟利用Plackett-Burmn实验(PB实验)和响应面分析法(Response surface methodology,RSM)优化大杯蕈子实体多糖(Fruting body polysaccharide,FPS)的分离提取条件,并对其体外抗氧化活性作初步分析,旨在为大杯蕈子实体多糖提取工艺的优化及构效关系的深入研究提供理论基础.
1 材料和方法
1.1 实验材料
大杯蕈(Clitocybe maxima)子实体,由山东农业大学微生物实验室提供.
1.2 实验方法
1.2.1 大杯蕈子实体多糖PB实验
(1)大杯蕈子实体多糖的提取
大杯蕈烘干后于粉碎机中粉碎成粉末,-4℃冰箱保存备用.使用DX8Trial软件绘制大杯蕈子实体多糖PB实验表格(表1),采用9因素3水平的方案,各因素对应项目如表1.分别称取0.5 g大杯蕈子实体粉末放入编号为1~17的离心管中.按照表1所示实验项目进行实验,得到17组大杯蕈多糖提取物.向17只离心管中加入20 ml水,70℃左右水浴,直至溶解.3600×g离心15 min.取1ml上清液置于试管中,稀释10倍,分别取1 ml稀释液设置三组平行试验.分别向每支平行试管中加入1 ml去离子水,1 ml新配苯酚溶液,5ml浓硫酸.反应20 min,于490nm下测定OD值.

表1 大杯蕈子实体多糖的PB试验因素水平及编码
(2)大杯蕈多糖含量测定:苯酚—硫酸法[7]
苯酚-硫酸法是利用高浓度的硫酸可以在短时间内将多糖水解成寡糖和单糖,或者多糖经脱水生成糠醛或其衍生物,苯酚类试剂可与游离的单糖、寡糖、糖醛酸或甲苯衍生物起显色反应,已糖在490 nm处,戊糖及糖醛酸在480 nm处有最大光吸收,且吸光值与糖含量成正比.
6%苯酚溶液配制:
热水浴条件下,量取6 mL苯酚溶于10 mL容量瓶中,用去离子水定容,摇匀后,即得到约为6%的苯酚溶液.置于棕色瓶中备用(现配现用).
标准曲线制作:
准确称取105℃下干燥的标准葡萄糖0.1 g,加去离子水定容至100 mL,取10 mL,再定容到100 mL,即得100 μg/mL 的标准葡萄糖溶液.精确量取葡萄糖标准溶液 0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL,分别加去离子水至2 mL,以2 mL去离子水作为空白对照,分别加入1 mL苯酚,5 mL浓硫酸,静置10 min,充分摇匀后室温放置20 min,于490 nm下测OD值,以OD值对葡萄糖含量回归,得回归曲线(图1).

式中:C—从标准曲线上查得样品测定管中葡萄糖质量(mg);
V1—样品提取时定容体积(mL);
V2—样品比色管中取样液体积(mL);
m—样品称量质量(mg).

图1 葡萄糖标准曲线
1.2.2 大杯蕈子实体多糖响应面优化
根据上述PB实验的结果,使用Design-Expert对数据进行回归分析.选择对多糖提取量影响显著的pH,提取温度,提取次数继续进行下一步实验(表2).分别称取0.5 g大杯蕈子实体粉末放入编号为1~17的离心管中.按照表2所示实验项目进行实验,得到17组大杯蕈多糖提取物.向17只离心管中加入20 mL水,70℃左右水浴,直至溶解,3600×g离心15 min.取1 mL上清液置于试管中,稀释10倍,再取1 ml稀释液设置三组平行试验,分别向每支平行试管中加入1 mL去离子水,1 mL新配苯酚溶液,5 mL浓硫酸,反应20 min后于490nm下测定OD值.

表2 大杯蕈子实体多糖的响应面试验因素水平及编码
1.2.3 大杯蕈多糖体外抗氧化能力测定
(1)还原力测定——普鲁士蓝法[8]
取1 mL样品,加入2.5 mL 0.2 mol/L的pH 6.6的磷酸缓冲液和2.5 mL 1%的铁氰化钾,混合后50℃恒温水浴20 min.用流水冷却后,加入2.5 mL 10%的三氯乙酸充分混合,3000×g离心15 min.取2.5 mL上清液加入2.5 mL去离子水和2.5 mL 0.1%的三氯化铁,静置10 min.用去离子水作为对照,于700 nm波长下测定OD值.
(2)清除羟基自由基—邻二氮菲-Fe2+氧化法[9]
取1 mL样品,加入4 mL 0.2 mol/L pH 7.4的磷酸缓冲液,1 mL 7.5 mmol/L硫酸亚铁和1.5 mL 5 mmol/L邻二氮菲,立即混匀,再加入1 mL H2O2后37℃保温1 h.以去离子水代替H2O2作为空白对照,于536 nm下测定OD值.

其中:EC50代表产生50%清除率所需的样品浓度(mg/L).
A:样品+H2O2;
Ai:无样品无H2O2;
Aj:无样品有H2O2.
(3)清除超氧阴离子自由基[10]
取1 mL样品加入4.5 mL pH 8.2的50 mmol/L Tris-HCl和3.2 mL去离子水,25℃下保温20 min,再加入0.3 mL邻苯三酚(经过25℃水浴保温20 min),反应3min后,加入1 mL 5%VC终止反应,于420 nm下的测定OD值.
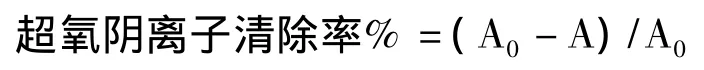
其中:A0:去离子水;
A:样品.
(4)清除2,2—二苯代苦味肼(DPPH)自由基[11]
取2mL样品加入2 mL 2×10-4mol/L DPPH溶液,混合均匀,30 min后在波长517 nm下测定OD值Ai.同法测定2 mL 2×10-4mol/L DPPH溶液与2 mL去离子水混合后的OD值Ac,以及2 mL样品与2 mL去离子水混合后的OD值Aj.
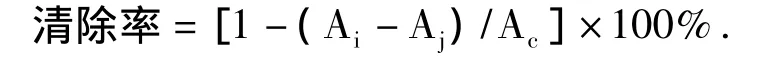
2 结果与分析
2.1 大杯蕈子实体多糖的提取优化
2.1.1 PB 实验
通过软件Design Expert对实验结果进行分析,大杯蕈子实体多糖的PB试验结果见表3,PB试验的ANOVA分析(方差分析)见表4.结果表明,该模型的回归性良好.通过P值分析,影响大杯蕈子实体多糖提取量的显著因素是醇沉时间,乙醇倍数和提取次数,其余为不显著或者是可忽略因素.

表3 大杯蕈子实体多糖的PB实验结果

表4 大杯蕈子实体多糖PB实验得率ANOVA分析
2.1.2 响应面法
在响应面实验中,利用软件Design Expert对pH,提取温度和提取次数三个因素进行优化,响应面实验设计见表5.ANOVA分析显示模型显著,失拟值不显著,说明模型和现实的拟合程度较好(表6).
对于大杯蕈子实体多糖的PB试验所得的三个主要影响因素乙醇倍数、醇沉时间和提取次数,通过计算机辅助软件Design Expert进行设计,通过模型分析得到回归方程:

方差分析显示,该模型的P-value值小于0.05,为显著水平;Lack of Fit不显著,说明该模型能很好地说明多糖的实际产量.
通过实验分析可得,大杯蕈子实体多糖提取的最佳条件是乙醇倍数3.55,醇沉时间28.77 h,提取次数2.57次,在此条件下,大杯蕈子实体多糖的理论得率是2.549%.

表5 大杯蕈子实体多糖响应面实验设计

表6 大杯蕈子实体多糖RSM实验得率ANOVA分析
大杯蕈子实体多糖的得率与各因素的关系如下图(图2、图3、图4)所示:

图2 大杯蕈子实体多糖得率与醇沉时间和乙醇倍数的关系

图3 大杯蕈子实体多糖得率与提取次数和乙醇倍数的关系

图4 大杯蕈子实体多糖得率与提取次数和醇沉时间的关系
2.2 大杯蕈子实体多糖体外抗氧化活性分析
2.2.1 大杯蕈子实体多糖还原力测定
还原力是表示抗氧化物质提供电子能力的重要指标,抗氧化物质通过提供电子可使自由基变为稳定的分子,从而失去活性.研究证实抗氧化活性同还原力是密切相关的,大杯蕈子实体多糖于700 nm下比色,以吸光值表示还原力的大小,吸光值越大,表明样品抗氧化能力越好,还原力越强.
大杯蕈子实体多糖的还原能力见图5.由图5可知,其还原能力随着浓度的增加呈上升趋势.在浓度1000~1500 μg/mL之间,OD值增长幅度很小;当浓度达到1500 μg/mL后,OD值呈直线增长;在5000 μg/mL时,大杯蕈子实体多糖的OD值为0.629.

图5 大杯蕈子实体多糖的还原力测试
2.2.2 对羟基自由基的清除能力
从图6中可以看出,随着大杯蕈子实体多糖的浓度的增加,对羟基自由基的清除能力呈上升趋势,在浓度为2000~2500 μg/mL区间时清除率增长较快;当浓度达到3500 μg/mL后,清除率增长较为平稳;当浓度为5000 μg/mL时,样品对于羟基自由基的清除率为27.19%.根据图线走势分析,其EC50约等于9500μg/mL.
2.2.3 对超氧阴离子自由基的清除能力
对于超氧阴离子自由基的清除能力如图7所示,从图7可以看出,随着样品浓度的增加,其对超氧阴离子自由基的清除率呈现上升趋势.在浓度为1500~2000 ug/mL之间时,大杯蕈子实体多糖对超氧阴离子自由基的清除率增长较为迅速;在浓度为5000 ug/mL时,大杯蕈FPS对于超氧阴离子自由基的清除率为60.101%.通过对图7分析,大杯蕈子实体多糖的EC50约等于3800 ug/mL.

图6 大杯蕈子实体多糖对羟基自由基的清除作用
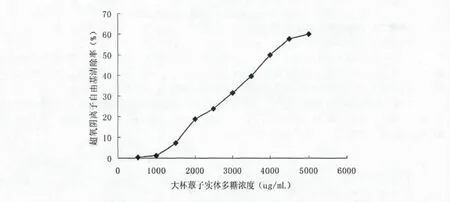
图7 大杯蕈子实体多糖对超氧阴离子的清除作用
2.2.4 对DPPH的清除作用
DPPH是二苯代苦味肼自由基,有清除剂存在时,其在最大光吸收波长处的吸光值下降,吸光度水平的降低表明抗氧化性的增加,以此可以鉴定试验样品的抗氧化能力.从图8可以看出,当浓度在1000~1500 ug/mL之间时,对DPPH清除率增长缓慢;当浓度达到1500 ug/mL以上时,清除率呈线性增长;在浓度为5000 ug/mL时,大杯蕈对于DPPH的清除率为69.7%.EC50约等于2600 ug/mL.总之,随着样品浓度的增加,大杯蕈子实体多糖对DPPH的清除率逐渐增大.
3 讨论
影响大杯蕈多糖提取量多少的因素有很多,包括加水倍数、水浴pH、提取温度、提取次数、提取时间、乙醇体积、乙醇浓度、醇沉时间、醇沉温度等.不同蕈菌影响其子实体多糖提取的显著因素有所不同,影响大杯蕈子实体多糖提取量的显著因素是醇沉时间,乙醇倍数和提取次数;有研究发现影响香菇子实体多糖提取的显著因素是pH值、提取次数、提取温度[12].本实验采用PB实验和响应面法进行优化,得到了大杯蕈多糖的最佳提取条件,为大杯蕈多糖的后续相关研究提供了基础数据.
自由基学说是Denham Harman在1956年提出的,认为机体在生命代谢过程中产生的一些自由基对生命有机体有害,生物体的衰老过程就是自由基不断积累的结果.自由基可以诱发肿瘤形成,这是自由基导致DNA损伤而造成基因突变引起的.此外,自由基可以氧化细胞中的多种物质,使生物膜受到损伤;还能够使蛋白质、核酸等大分子交联,影响其正常功能[13].因此,自由基生物学研究越来越受到人们的重视.虽然,生物体内存在酶和非酶自由基清除系统,但开发和寻找外源性自由基清除剂对预防衰老和治疗疾病具有显著医学意义.本研究证明,大杯蕈子实体多糖具有潜在的体外抗氧化活性,这一研究结果对深入认识和开发真菌多糖类药物具有一定的参考价值.

图8 大杯蕈子实体多糖对DPPH的清除作用
4 结论
通过大杯蕈子实体多糖的PB实验和响应面实验,优化了其分离提取条件.通过回归曲线得到多糖的最佳提取条件是乙醇倍数3.55,醇沉时间28.77 h,提取次数2.57次,在此条件下,大杯蕈子实体多糖的理论得率是2.549%.考虑到操作的方便性,将最佳提取条件调整为乙醇倍数3.6,醇沉时间29 h,提取次数3.00,在此条件下,大杯蕈子实体多糖的理论得率是2.329%,实际值为2.015%.
本实验测定了大杯蕈子实体多糖的还原能力以及其对羟基自由基、超氧阴离子自由基和DPPH的清除能力.当浓度为5000 μg/mL时,大杯蕈子实体多糖的还原力为0.629;样品对于羟基自由基的清除率为27.19%,其EC50约等于9500 μg/mL;对于超氧阴离子自由基的清除率为60.101%,EC50约等于3800 ug/mL;对于DPPH的清除率为69.7%,EC50约等于2600 ug/mL.随着样品浓度的增加,大杯蕈子实体多糖还原力逐渐增强,对羟基自由基、超氧阴离子自由基和DPPH的清除率也逐渐增大.
[1]白日霞.鬼毛针中碱溶多糖的结构和生物活性[J].应用化学,2001,18(6):187-189.
[2]姚金凤,吴亮,吴希哲,等.海洋真菌多糖对巨噬细胞免疫功能的影响[J].中国药科大学学报,2004,35(6):173-175.
[3]李金灿,陆辉,张相日,等.食用菌多糖特性与保健作用研究新进展[J].中国食用菌,2005,24(6):7-11.
[4]贺青提,张松.食(药)用菌多糖免疫增强作用的研究进展[J].食用菌学报,2004,11(2):52-53.
[5]杨学敏,陈仪男.微波辅助技术优化猪肚菇提取工艺的研究[J].漳州师范学院学报(自然科学版),2009,22(4):75-80.
[6]唐青,郁建平.猪肚菇水溶性多糖提取工艺的研究[J].食品科学,2008,29(2):180-183.
[7]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[8]OYAIZU A K.Antioxidative activities of products of browning reaction prepared from glucosamine[J].Studies on Products of Browning Reaction,1986(44):307-315.
[9]赵艳红,李建科,李国秀.天然抗氧化物体外活性评价方法的优越与优化[J].食品科学,2008,29(6):64-69.
[10]张小强,浦跃朴,尹立红,等.冬虫夏草及人工虫草菌丝体对超氧阴离子自由基和羟自由基清除作用的实验研究[J].中国老年学杂志,2003(11):154-156.
[11]XIAO J D,ZHANG W W,LI X M,et al.Evaluation of antioxidant property of extract and fractions obtained from a red alga,polysiphonia urceolata[J].Food Chemistry,2006,95(5):37-43.
[12]申进文,冯雅岚,庄庆利,等.香菇子实体多糖提取工艺优化研究[J].河南农业科学,2010(3):93-98.
[13]陈瑗,周玫,刘尚喜,等.营养、衰老与自由基理论[J].营养学报,2005(3):32-39.

