脓毒症患者血浆血管生成素2与(1,3)-β-D葡聚糖水平变化及其相关性分析
陈秋萍,冯永民,张媛莉,姚华国,邓烈华,何惠娟
(广东医学院附属医院,广东湛江524001)
血管生成素2(Ang-2)具有促炎及增加血管内皮渗透性等作用[1,2],可能参与脓毒症、脓毒症休克的病理生理过程。目前,关于Ang-2的研究绝大多数集中于G-杆菌感染导致的脓毒症方面,对真菌感染导致脓毒症的研究较少。近几十年,深部真菌感染发病率逐年上升[3,4]。国内外研究已证实[5,6],深部真菌感染患者(隐球菌除外)血浆中(1,3)-β-D-葡聚糖(BG)水平明显升高。2008年5月~2010年3月,我们观察了脓毒症患者血浆Ang-2、BG水平变化,并分析二者的关系,以期进一步探讨脓毒症的发病机制。
1 资料与方法
1.1 临床资料 纳入标准:①符合2001年国际脓毒症定义会议制定的脓毒症诊断标准;②G-杆菌感染诊断标准:痰、血或各种体液病原微生物学培养,连续分离培养出相同G-杆菌≥2次;③深部真菌感染诊断标准:符合中华医学会重症医学分会《重症患者侵袭性真菌感染诊断与治疗指南(2007)》;④经医院伦理委员会批准,获得患者或家属知情同意。排除标准:妊娠、恶性肿瘤、慢性肾脏疾病、系统性血管炎及G+菌感染。选择广东医学院附属医院ICU收治的符合标准的脓毒症66例,其中单纯深部真菌感染11例(A组),二重感染(G-杆菌合并真菌感染)36例(B组),单纯G-杆菌感染(C组)19例;另选性别、年龄相匹配的健康体检者20例作为对照组(D组)。
1.2 方法
1.2.1 临床资料收集 记录各组一般资料,检查血常规,计算氧合指数,检测血浆降钙素原(PCT),并进行急性生理学与慢性健康状况(APACHEⅡ)评分和序贯器官衰竭估计(SOFA)评分。
1.2.2 血浆Ang-2、BG检测 各组24 h采集空腹静脉血,离心后分离血浆,-80℃冰箱冻存。ELISA法检测血浆Ang-2、BG,人Ang-2试剂盒为美国R&D公司产品,BG试剂盒为美国安度斯生物有限公司产品,严格按照说明书步骤操作。
1.2.3 统计学方法 采用SPSS16.0统计软件。正态分布计量数据以±s表示,偏态分布数据以中位数(四分位数间距)表示;计量资料两个变量之间比较采用 Wilcoxon法,多个变量之间比较采用Kruskal-Wallis法,变量间的关系应用Spearman相关分析及多元线性回归分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组临床资料比较 见表1。
表1 各组临床资料比较(±s)
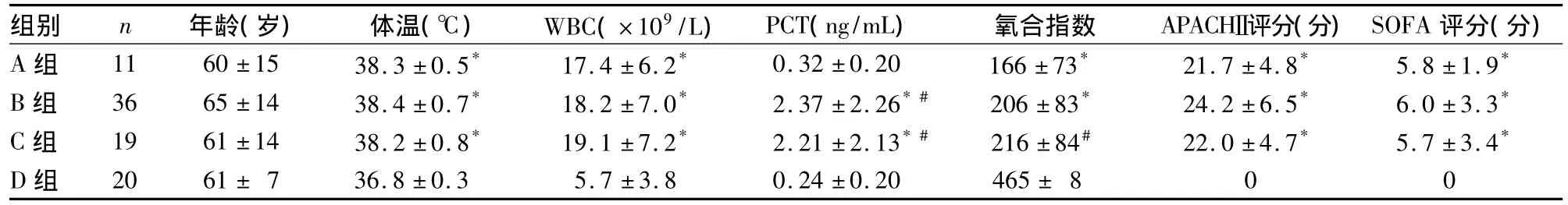
表1 各组临床资料比较(±s)
注:与 D组比较,*P <0.01;与 A 组比较,#P <0.01
组别 n 年龄(岁) 体温(℃) WBC(×109/L) PCT(ng/mL) 氧合指数 APACHⅡ评分(分)SOFA评分(分)A 组 11 60 ±15 38.3 ±0.5* 17.4 ±6.2* 0.32 ±0.20 166 ±73* 21.7 ±4.8* 5.8 ±1.9*B 组 36 65 ±14 38.4 ±0.7* 18.2 ±7.0* 2.37 ±2.26*# 206 ±83* 24.2 ±6.5* 6.0 ±3.3*C 组 19 61 ±14 38.2 ±0.8* 19.1 ±7.2* 2.21 ±2.13*# 216 ±84# 22.0 ±4.7* 5.7 ±3.4*D 组 20 61 ± 7 36.8 ±0.3 5.7 ±3.8 0.24 ±0.20 465 ± 800
2.2 各组血浆Ang-2、BG比较 见表2。
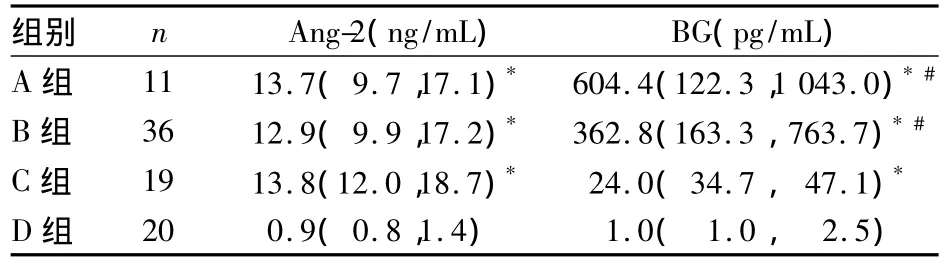
表2 各组血浆Ang-2、BG比较[M(Q1,Q3)]
2.3 脓毒症患者血浆 Ang-2、BG与 APACHEⅡ、SOFA评分的关系 脓毒症患者血浆Ang-2与APACHEⅡ、SOFA评分均呈正相关(r分别为0.599、0.723,P 均 <0.05),血浆 BG 与 APACHEⅡ、SOFA评分均无相关关系(r分别为0.103、0.218,P 均 >0.05);分别以APACHEⅡ评分及SOFA评分为因变量,以BG、Ang-2为自变量,多元线性回归分析显示,Ang-2与APACHEⅡ、SOFA评分均独立相关(β分别为0.468、0.626,P 均 <0.05)。
2.4 脓毒症患者血浆Ang-2、BG的关系 除C组外脓毒症患者血浆Ang-2与BG呈正相关(r=0.408,P <0.05);线性回归分析显示,BG 与 Ang-2独立相关(β =0.393,P <0.05)。
3 讨论
本研究中,脓毒症各组体温、WBC、氧合指数及APACHEⅡ、SOFA评分均高于 D组,A、B、C组年龄、体温、WBC、氧合指数及APACHEⅡ、SOFA评分无显著差异。B组、C组血浆PCT均高于A、D组,A、D组血浆PCT比较无显著差异,提示血浆PCT对诊断细菌所致感染具有良好指导意义,与国内外研究一致[7,8]。
血管内皮细胞损伤、血管高通透性和血管渗漏是脓毒症的一个极重要的病理表现。Ang家族包括Ang-1、Ang-2、Ang-3 和 Ang-4。Ang-1 与受体 Tie-2结合可稳定内皮细胞,调节血管通透性[9]。Ang-2主要由血管内皮合成,可通过自分泌作用结合于内皮细胞特异性Tie-2受体上,从而阻断Ang1-Tie-2信号转导,导致血管通透性升高,引起血管渗漏[10]。Harnner等[7]发现,脓毒症患者血浆 Ang-2与 TNF-α、IL-6 呈直线正相关。Fiedler 等[11,12]研究发现,Ang-2与炎症之间存在紧密联系。研究显示,转化生成因子α(TGF-α)以时间、剂量依赖性方式诱导Ang-2 mRNA表达,而且Ang-2表达可能进一步增强TGF-α诱导的炎症反应[13]。脓毒症患者血浆Ang-2较正常人显著增高[14,15]。本研究结果表明,脓毒症各组血浆Ang-2均较D组增高,而脓毒症各组间差异无统计学意义。提示不论是真菌还是G-杆菌感染所致脓毒症的病理生理过程中,Ang-2均发挥了重要作用。体外应用脓毒症患者血清或血浆可破坏内皮细胞屏障,其对内皮屏障的破坏程度与Ang-2含量相关;此外,单独应用重组Ang-2可破坏内皮屏障功能和结构[16]。结合本研究,Ang-2可能作为内皮细胞损伤标志物而参与脓毒症的病理生理过程。既往研究认为,脓毒症患者血浆Ang-2水平与疾病严重程度和预后相关[17,18]。本研究显示,脓毒症患者血浆Ang-2水平与APACHEⅡ、SOFA评分均呈正相关,Ang-2与APACHEⅡ、SOFA评分均独立相关,提示脓毒症患者血浆Ang-2水平是影响脓毒症患者病情严重程度的独立危险因素。
BG广泛存在真菌细胞壁中,并占细胞壁成分的50%以上。深部真菌感染时,真菌进入人体血液或深部组织,经吞噬细胞的吞噬、消化等处理后,BG可从细胞壁中释放出来,进入血液及其他体液中。但是,浅表真菌感染或真菌定植时血清BG常不会升高[19,20]。在本研究中结果显示,A、B 组血浆 BG均较C、D组增高;但C组血浆BG仍高于D组,其原因可能是C组中混有未能发现的真菌感染,这符合临床潜在早期真菌感染者不易发觉的情况;另外,标本数量偏小及检验过程中可能存在的误差可能导致结果偏差。对于BG在深部真菌感染中的作用,Yoshida等[19]认为可能与内毒素在G-杆菌感染中的作用类似;BG能刺激单核—巨噬细胞释放出一系列炎症介质,包括IL-6、TNF-α等。国外一些相关研究也报道[21,22],BG 能诱导人外周血单个核细胞释放炎症介质如 IL-6、IL-8、IL-1β、TNF-α 等。近来有文献报道,真菌感染是影响脓毒症预后的危险因素[23]。本研究发现,除 C组外患者血浆 Ang-2与BG呈正相关,BG与Ang-2独立相关。这提示BG是影响真菌感染脓毒症患者血浆Ang-2水平的独立危险因素。
值得注意的是,Ang-2与BG在激活炎性细胞的信号转导中存在某些共同途径。BG的主要受体树突状细胞相关C型凝集素-l特异性识别BG后,与Toll样受体(TLR2)信号转导发挥协同作用[24]。TLR2诱导NF-κB活化,启动靶基因的转录和表达,诱导多种炎症因子如IL-1、IL-6、TNF-α等释放,触发机体一系列炎症级联反应[25~27]。Ang-2竞争性地与受体Tie-2结合,抑制Tie-2酪氨酸残基磷酸化,阻断Ang1-Tie-2信号转导作用,从而激活NF-κB,启动靶基因的转录和表达,诱导多种炎症因子释放,触发机体一系列炎症级联反应。而Ang-1则与Tie-2结合后,使Tie-2的酪氨酸残基发生磷酸化,从而抑制 NF-κB 的活性[1,2,14]。这就是 Ang-2 与脂多糖在激活炎性细胞的信号转导中存在的一些共同途径。但Ang-2与BG在真菌感染导致脓毒症的发病机制中是如何相互作用并不清楚,有必要进一步研究。
综上所述,脓毒症患者血浆Ang-2水平显著升高,并与APACHEⅡ、SOFA评分均呈正相关,是影响脓毒症患者病情严重程度的独立危险因素。真菌感染脓毒症患者血浆Ang-2水平与BF水平存在正相关,BG是影响真菌感染脓毒症患者血浆Ang-2水平的独立危险因素。Ang-2在真菌感染所致脓毒症的发病机制中可能发挥重要作用。
[1]Kümpers P,van Meurs M,David S,et al.Time course of angiopoietin-2 release during experimental human endotoxemia and sepsis[J].Crit Care,2009,13(3):64.
[2]Parikh SM,Mammoto T,Schultz A,et al.Excesscirculating angiopoietin-2 may contribute to pulmonary vascular leak in sepsis in humans[J].PLoS Med,2006,3(3):356-370.
[3]武子霞.慢性阻塞性肺疾病患者继发真菌感染临床分析[J].中国中西医结合急救杂志,2010,17(6):381.
[4]Martin GS,Mannino DM,Eaton S,et al.The epidemiology of sepsis in the United States from 1979 through 2000[J].N Engl J Med,2003,348(16):1546-1554.
[5]Pickering JW,Sant HW,Bowles CAP,et al.Evaluation of a(1-3)-β-D-glucan assay for diagnosis of invasive fungal infections[J].J Clin Microbio,2005,43(12):5957-5962.
[6]Kedzierska A.(1,3)-beta-D-glucan a new marker for the early serodiagnosis of deep-seated fungal infections in humans[J].Pol J Microbiol,2007,56(1):3-9.
[7]Harnnner S,Meisner F,Dirschedl P,et al.Procalcitonin:a new marker for diagnosis of acute rejection and bacterial infection in patients after heart and lung transplantation[J].Transplant Immunology,2008,6(4):235-241.
[8]杜斌,潘家绮,彭雪,等.降钙素原与白介素-6的相关性优于传统的炎症指标[J].中国危重病急救医学,2002,14(8):474-477.
[9]胡占升.稳定表达血管生成素1的骨髓间充质干细胞对内毒素诱导急性肺损伤干预作用的研究进展[J].中国危重病急救医学,2008,20(10):627-629.
[10]Roviezzo F,Tsigkos S,Kotanidou A,et al.Angiopoietin-2 causes inflammation in vivo by promoting vascular leakage[J].J Pharmacol Exp Ther,2005,314(2):738-744.
[11]Fiedler U,Reiss Y,Scharpfenecker M,et al.Angiopoietin-2 sensitizes endothelial cells to TNF-alpha and has a crucial role in the induction of inflammation[J].Nat Med,2006,12(2):235-239.
[12]Fiedler U,Augustin HG.Angiopoietins:a link between angiogenesis and inflammation[J].Trends Immunol,2006,27(12):552-558.
[13]Satchell SC,Mathieson PW.Angiopoietins:microvascular modulators with potential roles in glomerular pathophysiology[J].J Nephrol,2003,16(2):168-178.
[14]Orfanos SE,Kotanidou A,Glynos C,et al.Angiopoietin-2 is increased in severe sepsis:correlation with inflammatory mediators[J].Crit Care Med,2006,35(1):199-206.
[15]van der Heijden M,Pickkers P,van Nieuw Amerongen GP,et al.Circulating angiopoietin-2 levels in the course of septic shock:relation with fluid balance,pulmonary dysfunction and mortality[J].Intensive Care Med,2009,35(9):1567-1574.
[16]Gallagher DC,Parikh SM,Balonov K,et al.Circulating angiopoietin 2 correlates with mortality in a surgical population with acute lung injury/adult respiratory distress syndrome[J].Shock,2008,29(6):656-661.
[17]Siner JM,Bhandari V,Engle KM,et al.Elevated serum angiopoietin 2 levels are associated with increased mortality in sepsis[J].Shock,2009,31(4):348-353.
[18]Su L,Zhai R,Sheu CC,et al.Genetic variants in the angiopoietin-2 gene are associated with increased risk of ARDS[J].Intensive Care Med,2009,35(6):1024-1030.
[19]Yoshida M,Roth RJ,Grunfeld C,et al.Soluble(1-3)-beta-D-glucan purified from Candida albicans:biological effect and distribution in blood and organs in rabbits[J].J Lab Clin Med,1996,128(1):102-114.
[20]Pickering JW,Sant HW,Bowles CAP,et al.Evaluation of a(1→3)-D-glucan assay for diagnosis of invasive fungal infections[J].J Clin Microbio,2005,43(12):5957-5962.
[21]Li M,Chen Q,Sun JJ,et al.The effect of β-glucan of cell wall from Candida albicans on interleukin-6 and interleukin-8 production by human peripheral blood mononuclear cells in vitro[J].J Clin Dermatol,2002,3(6):349-350.
[22]Castro M,Bjoraker JA,Rohrbach MS,et al.Candida albicans induces the release of inflammatory mediators from human peripheral blood monocytes[J].Inflammation,1996,20(1):107-122.
[23]戴新贵,艾宇航,刘志勇,等.影响脓毒症预后的多因素分析[J].中国危重病急救医学,2008,20(1):627-629.
[24]Gantner BN,Simmons RM,Canavera SJ,et al.Collabotive induction of inflammatory responses by dectin-1 and toll-like receptor 2[J].J ExP Med,2003,197(9):1107-1117.
[25]Underhill DM,Rossnagle E,Lowell CA,et al.Deetin-1 Activates SYK tyrosine kinase in a dynamic subset of macrophages for reactive oxygen production[J].Blood,2005,106(7):2543-2550.
[26] Steele C.Alveolar macrophage-mediated killing of Pneumoeystis carinii f.sp.muris in volves molecular recognition by the dectin-l β-glucan recptor[J].J Exp Med,2003,198(11):1677-1688.
[27]Brown GD,Herre J,Williams DL,et al.Dectin-1 mediates the biologieal effects of beta-glucans[J].J Exp Med,2003,197(9):1119-1124.

