LED光质对紫背天葵挥发油和酚类成分积累的影响
任 锦,郭双生,,沈韫赜
(1.西北工业大学生命学院,陕西西安710072;2.中国航天员科研训练中心,人因工程重点实验室,北京100094)
LED光质对紫背天葵挥发油和酚类成分积累的影响
任 锦1,郭双生2,1,沈韫赜2
(1.西北工业大学生命学院,陕西西安710072;2.中国航天员科研训练中心,人因工程重点实验室,北京100094)
为了探索促进紫背天葵在受控环境中更好地积累生物活性成分的有效光质条件,采用3种LED光源(R60B30G10/60%红光+30%蓝光+10%绿光,R70B20G10/70%红光+20%蓝光+10%绿光,R60B20G20/60%红光+20%蓝光+20%绿光)研究了光质条件对紫背天葵次级代谢物(挥发油和酚类)的影响。结果表明:与R70B20G10光质相比,R60B20G20光质显著增加了萜烯类物质(α,β-石竹烯)的积累,降低了醛类成分(绿叶挥发物)在香气物质中的比例,而R60B30G10与此结果相反;与其它光质相比,R60B30G10光质增加了总花色苷和总黄酮的含量,而在R70B20G10和R60B2OG20光质条件下这些物质的含量没有显著差异;与其它光质相比,R70B20G10光质增加了β-胡萝卜素积累和植物叶片提取物的抗氧化活性(DPPH),而R60B20G20光质则显著降低了β-胡萝卜素的含量。因此,R70B20G10为适合于紫背天葵积累更多有用次级代谢产物及提高其营养和药用价值的光质条件。
LED光质;紫背天葵;萜烯类;酚类
1 引言
长期载人航天飞行任务和月球、火星等地外星球定居与开发需要建立受控生态生保系统(controlled ecological life support system,CELSS),航天员食用该系统中富含抗氧化剂的新鲜蔬菜可有效提高抗空间辐射的能力[1]。紫背天葵,是一种具有较高营养及药用价值的沙拉型蔬菜,可成为适合于CELSS种植的一种富含抗氧化剂的可食用植物。目前的研究表明紫背天葵比其它蔬菜和常用的可食用抗氧化剂具有更高的抗氧化活性[2]。紫背天葵中较多次级代谢类活性成分在其中起到非常重要的作用,比如酚类[3]和萜烯类挥发油[4]等。因此,提高植物中这些有益活性成分是很必要的。光质是影响这些物质积累的重要因子。LED灯由于其具有体积小,波长可精确控制、低热辐射性和寿命长等优势,目前已经成为CELSS中的首选光源[5]。目前研究表明蓝色LED光质比例增加可促进樱桃番茄果实中番茄红素和类黄酮的形成[6]。红蓝LED光质对豌豆苗抗氧化活性研究表明较多红光有利于β-胡萝卜素的积累[7]。而绿色LED光质可能会通过影响植物叶片上香茅簇腺体的数量来增加或减少可挥发性物质的积累[8]。这些结果都表明通过优化光质条件可以提高植物中有益生物活性成分的含量。在前期的工作中,我们侧重研究了高CO2浓度对紫背天葵酚类及其抗氧化能力的影响[9]。而本文将深入研究红蓝绿LED复合光质对紫背天葵酚类和萜烯类挥发油积累的影响。因此,本文旨在受控环境下筛选能使紫背天葵积累较多有益生物活性成分的有效光质条件,实验结果可为航天员提供营养丰富可食的新鲜蔬菜,也可为太空农场的建立提供理论依据,甚至在民用蔬菜生产中获得推广。
2 材料与方法
2.1 植物材料及生长条件
光照系统:包括三种光源——红色LED(1 W,625~630 nm),蓝色LED(1 W,460~463 nm),绿色LED(1W,524~527 nm)。本实验中的光照处理设置为:R60B30G10(60%红光+30%蓝光+ 10%绿光),R70B20G10(70%红光+20%蓝光+ 10%绿光)和R60B20G20(60%红光+20%蓝光+ 20%绿光)。所有的光质模块区都置于一个受控环境舱中[11],使植物处于同样的环境条件下,各处理间用非反射板相隔以避免光质污染。各光质处理的具体光合有效辐射强度见表1。
本实验在一个受控环境试验舱[10]中进行。紫背天葵扦插幼苗(江苏省宿迁美利红枫园林有限公司)生长于一种大小为15 cm(高)×17 cm(上部直径)×12 cm(底部直径)的圆形塑料盆中,盆中装有多孔陶瓷颗粒和珍珠岩混合基质(1∶2),每隔一天浇灌新鲜的营养液(日本园试茼蒿配方,电导率为2~2.5 ms·cm-1,PH值为6.3~6.4)以确保足够的营养和水分供应。每盆中定植一棵健壮的幼苗,花盆在生长区内随机放置,每个生长区放置12盆植物,每个处理设置3个重复生长区。幼苗在定值后先在弱光下放置3天以适应新的环境和培养条件,然后转移至不同的光质处理区,光合有效辐射强度为250±5μmol· m-2·s-1(植物冠层上方20 cm处,并随着植物的生长做调整),光周期为16/8 h光/暗。在每个光质模块区内,花盆每隔一天随机移动位置以避免任何位置效应。舱内空气相对湿度和温度分别保持在60%±5%和24℃/19℃±1℃(昼/夜)范围内。生长周期30天。舱内风速大约为0.8 m· s-1。所有这些环境参数通过集成控制和监测数据管理系统软件(LabVIEW,USA)监控。除了光质外,每个实验的其它环境条件和植物培养方式都保持一致。
植物叶片于第30天收获,新鲜的叶片液氮立即速冻后于冻干机48 h完全冻干,以避免由于相关酶活性的变化产生的生物化学方面的改变。冻干的样品密封存于-20℃直至进行分析。
2.2 挥发油的分析及测定
挥发油的顶空固相微萃取(定性分析)和溶剂萃取(定量分析)程序及气相色谱-质谱分析(GC-MS)条件参照Ren等(2014b)[11]。
鉴定组分的相对百分比从GC(FID)峰面积的平均值获得。半定量数据通过内标法计算,FID响应因子使用内标和被分析成分的有效碳数进行理论计算,这是基于FID响应因子与化合物的有效碳数之间的正相关性。而α,-β-石竹烯的定量计算采用外标法,α,-β-石竹烯标品购买于ChromaDex。
化合物鉴定检测到的化合物的线性保留指数(RIs)使用n-烷烃类(C6-C30)作为标准品计算。挥发油组分的鉴定通过与相关文献、商业化数据库(NIST08.L)和一些已经出版的质谱比较它们的RIs和质谱(DB-5MS柱)。
2.3 酚类及其抗氧化活性测定
总花色苷,黄酮及总酚酸含量的测定参照Ren等(2014a)[9]。抗氧化活性通过自由基清除活性(DPPH)分析法测定,方法参照Ozgen(2006)[12]。Vc被用作标准品绘制标准曲线,抗氧化能力表示为每100 g植物干样中相当于Vc的毫克数。每样做三个重复。
2.4 β-胡萝卜素测定
β-胡萝卜素的测定参照国标GB/T5009.83-2003。
2.5 统计分析
所有数据采用SAS9.2(SAS Inc.,Cary,NC)统计软件ANOVA程序进行方差分析,并对不同处理的平均值进行多重比较(Duncan,P= 0.05),以P<0.05和P<0.01作为统计学显著和极显著意义。
3. 结果与讨论
3.1 挥发性成分的定性分析
本文采用顶空固相微萃取气质联用分析(HS-SPME-GC-MS)生长于不同LED光质条件下紫背天葵叶子中的挥发油成分(表2),共鉴定出28种化合物。不同光质条件下挥发性物质的组成基本相似,其中己醛、2-己烯醛、(E,E)-2,4-己二烯醛、α,β-石竹烯和双环吉马烯是主要组分。这与其它的研究结果有所不同[4],比如并未检测到大量的α-蒎烯,但是本研究中却检测到大量的绿叶挥发物成分(C6醛)及较多的抗氧化剂丁羟甲苯,这可能是由于分析方法不同,植物的基因型及生长的环境不一样造成的。C6醛属于低沸点高挥发性成分,而固相微萃取法能够尽可能减少萃取过程中高挥发性成分的损失,可以较为真实地反映植物叶片中的香气组成。
不同光质条件下,R60B20G20光质组的己醛、己烯醛和(E,E)-2,4-己二烯醛百分含量明显低于R60B30G10和R70B20G10光质组。而α,β-石竹烯和双环吉马烯的百分含量显著高于R60B30G10和R70B20G10光质组(表2)。这与图1中不同光质条件下醛类和萜烯类占总挥发油的比例变化相一致。R60B30G10和R70B20G10光质组醛类和萜烯类占总挥发油的比例没有显著性差异。结果说明,绿光从10%升到20%显著增加了萜烯类物质的比例,而减少了醛类物质的百分含量。而当绿光为10%时,红蓝光比例的变化并没有显著影响到萜烯类和醛类物质的组成变化。即较多的绿光明显影响了植物挥发性物质的组成。醛类比例随着绿光比例
增加而降低是可能由于萜烯类挥发性油实际含量增加导致的,也可能是实际含量降低导致的。
醛类成分,这里主要是C6和C9醛,也称绿叶挥发物,由于它的新鲜绿色气味被广泛用于食物香料。这些短链醛类由植物体内的亚油酸和亚麻酸经一系列酶促反应快速形成,在伤口愈合和抗虫性方面起到重要作用[13]。其一方面是植物防御反应的信号分子,另一方面它是吸引传粉者和天敌的重要信号分子。由于光质比例变化会明显影响紫背天葵叶片的香气组成变化,特别是绿光的加入,减少了那些易挥发性香气成分的积累,这可能会对将来的受控生态系统产生一定的影响。

图1 不同光质条件紫背天葵叶片中不同类挥发性物质的百分比(%)变化Fig.1 Proportion(%)of volatile compounds classes in essential oils from G.bicolor leaves under different light qualities
3.2 挥发油成分的定量分析
萜烯类挥发油含量在不同光质处理下具有显著差异(表3),从表4可以看出萜烯类挥发油含量在R60B20G20光质处理下最高,R70B20G10光质处理下其次,而在R60B30G10光质处理下最低。与R60B30G10光质组相比,R60B20G20光质组的总萜类含量增加了25.9%,R70B20G10光质组增加了17.4%。与R70B20G10光质组相比,R60B20G20光质组的总萜类含量增加了7.3%。即较多的绿光有利于萜烯类物质的积累,红光次之,而较多的蓝光与此相反。
由于固相微萃取定性分析挥发性物质时仅表明了各组分的相对含量,不能反映各组分的真实含量,因此我们采用溶剂萃取法对主要的萜烯类物质进行了定量分析。由于醛类属于低沸点高挥发性成分,溶剂萃取过程中其已经完全损失,因此醛类成分未能出现在定量分析的数据表中。表5列出了一些主要的挥发性萜类成分在不同光质条件下的绝对含量变化。主要萜类成分(α,β-石竹烯)在不同光质处理条件下的表现趋势与总萜类成分的产量相一致。其中,与R60B30G10光质组相比,R60B20G20光质组的β-石竹烯含量增加了38.2%,R70B20G10光质组增加了19.3%;α-石竹烯含量在R60B20G20光质组增加了19.5%,R70B20G10光质组增加了11.4%。
光质处理条件对各萜类成分的含量影响较为复杂,目前关于光质条件对植物挥发性成分的研究较少[14]。然而,有研究指出红光增加了薄荷脑的含量,它是野生薄荷挥发油的主要成分。而紫苏叶子中紫苏醛和柠檬烯的含量在绿光处理时高于其它富含红光的光质处理,而接近于蓝光和蓝绿光处理[12]。Yoshida等(1968)的研究[15]发现绿色叶片的紫苏植物挥发油含量会随着单位叶面积上盾状腺毛体数量的增加而增加。盾状腺毛体源于叶表面细胞,它是挥发性油合成和积累的主要位点[16,17]。因此,Nishimura等(2009)[8]推断绿光处理会增加植物表面盾状腺毛体数量,使得挥发油含量也随之增加。这可能是本研究中较多绿光处理时萜烯类挥发油比其它处理高的原因之一。

表3 不同光质条件下紫背天葵叶片的生物化学特性的单因子ANOVA统计显著性Table3 Significance of a one-way ANOVA of biochemistry traits of G.bicolor leaves under different light qualities

表4 紫背天葵次级代谢产物含量在不同光质条件下的变化Table 4 Changes of secondary metabolites contents in G.bicolor under different light qualities
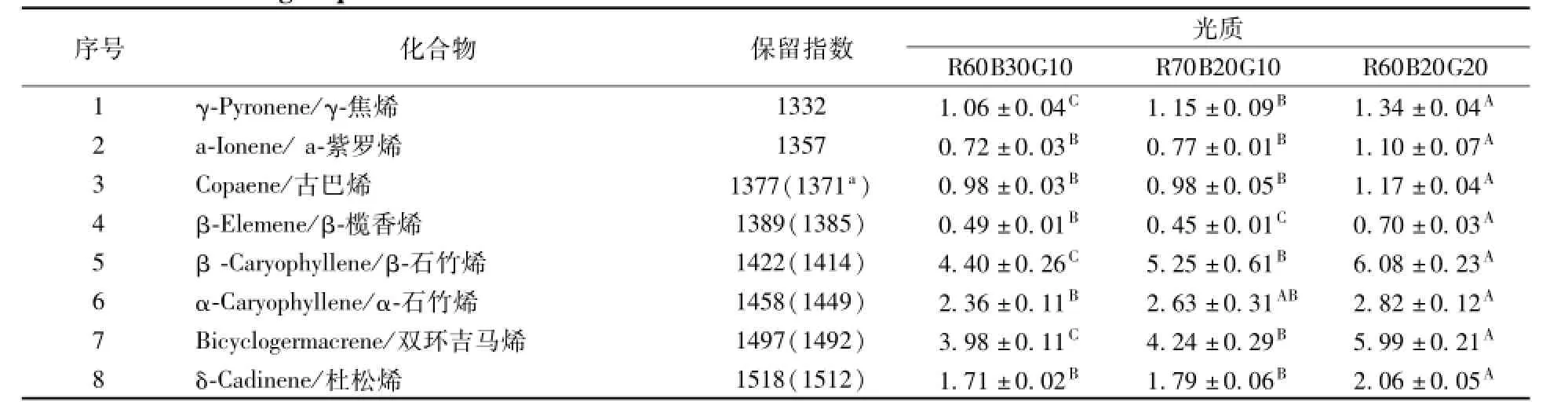
表5 紫背天葵主要萜类成分的定量(m g g-1DW)变化受到不同光质的影响Table5 Quantitative(mg g-1DW)changes ofmain volatile terpenoids components in G.bicolor as influenced under different light qualities
萜烯类挥发性油同样被用作天然香料,一些生物活性成分物质对人类的健康有益,除了这些,萜烯类挥发性油在直接和间接植物防御植食性昆虫及病菌方面起到重要作用。紫背天葵中的主要萜烯类成分α,β-石竹烯,研究已经表明其具有重要的药理活性,例如抗菌,消炎,抗癌,抗氧化及局部麻醉活性。最近的研究表明石竹烯是一种可食用大麻素[18],是食物中存在的一种非精神性的大麻素受体(CB2)激动剂,与经典大麻素的结构不一样,不具有任何精神副作用,能够保护大脑细胞缺血带来的损伤[19]。由于它在不同疾病组织能活化大量的CB2受体,因此,它在临床上的治疗性是比较广泛的。绿光比例增加时其含量也显著增加,一方面,增加了该植物的有效药用成分,提高其药用价值,另一方面,这些物质的增加还能使植物更好的防御外来植食性昆虫及病菌带来的伤害,使植物健康生长。
3.3 酚类及抗氧化活性
紫背天葵中的酚类,包括花色苷,黄酮及其它酚酸类,天然抗氧化剂,是苯丙烷代谢途径中的的产物,在人类对抗活性氧带来的伤害时具有重要的作用。表3所示,不同光质处理对植物叶子中的花色苷,黄酮含量及叶片提取物的抗氧化活性(DPPH法)有显著影响,而对多酚含量没有显著性差异。
花色苷和黄酮含量在R70B20G10和R60B20G20光质组间没有显著差异,而R60B30G10光质组与R7020G10相比,花色苷含量增加了13.8%,黄酮含量增加了6.5%(表4)。R7020G10光质组的叶片提取物的抗氧化活性(DPPH)分别高于R60B30G10光质组7.2% R60B20G20光质组6.5%。这些结果说明蓝光有利于花色苷,黄酮的积累,而在蓝光一定的基础上,红绿光的增加与否对其没有显著性影响。花色苷和黄酮的生物合成属植物次生代谢的苯丙烷代谢途径,研究表明蓝光会刺激苯丙烷途径中物质的生物合成[20],因为在此生物合成途径中的两个关键酶CHS和DFR基因表达量受到蓝光调控[21]。研究表明蓝光比例增加可促进樱桃番茄果实中番茄红素和类黄酮的形成,且蓝光比例占60%的红蓝光组合光源是樱桃番茄果实品质相对较好的光源[6]。较多红光似乎增加了植物叶片提取物的自由基清除活性(抗氧化能力),这与Wu等(2007)[7]的研究一致,即豌豆幼苗的丙酮和乙醇提取物的TEAC值在红光辐射下明显增加。由于红光能够增加植物体内的细胞分裂素水平[22],从而刺激酚酸类物质的合成积累[23],然而,多酚类物质在各光质处理间没有显著性差异的原因可能是本研究中红光对酚类物质的影响已达到饱和,因为本文中红光比例占到60%以上。
3.4 β-胡萝卜素
表3可看出,不同光质处理对植物β-胡萝卜素含量有极显著影响(p<0.0001)。R7020G10光质组的β-胡萝卜素含量分别高于R60B30G10光质组6.5%,R60B20G20光质组50.1%。这说明较多红光有利于β-胡萝卜素的积累,蓝光次之,而绿光显著降低了β-胡萝卜素的合成(表4)。有研究[21]表明LED辐射下的豌豆幼苗的β-胡萝卜素在红光下最高,蓝光次之,白光随后,即红光刺激了β-胡萝卜素的积累。这与本研究一致。但是也有研究[24]证明β-胡萝卜素的含量会随着蓝光的增加而增加,因为β-胡萝卜素的吸收光谱在蓝光波段(460 nm)。但是β-胡萝卜素在红蓝光下的具体机制不清楚。此外,β-胡萝卜素一方面可以作为捕光色素参与光合作用,另一方面可以保护叶绿素免受强光降解。由于在红蓝光背景中加入绿光时生长的植物会具有遮荫下植物的表现特征[25],植物不需要合成较多的β-胡萝卜素进行非光化学猝灭以避免强光对叶绿体带来的损伤,这可能是较多绿光下β-胡萝卜素显著降低的原因。
4 结论
总之,受控环境中,红蓝绿光质比例变化显著地影响了紫背天葵中不同类次级代谢产物的积累。绿光比例升高增加了萜烯类物质的积累,降低了醛类成分(绿叶挥发物)在叶片香气中的比例;蓝光比例升高增加了花色苷和黄酮类物质的含量;红光比例升高增加β-胡萝卜素的含量及植物提取物的抗氧化活性(DPPH);但是较多蓝光不利于萜烯类物质的积累,较多绿光不利于β-胡萝卜素的合成积累,又因为植物生物量在这三种光质下没有显著性差异(数据未显示),因此,综合来讲,R70B20G10为较适合于紫背天葵积累较多有益生物活性成分的光质条件。这些研究成果可以帮助我们在未来的植物舱中有效地设计合适的光环境使这种蔬菜具有更好的营养及药用价值。另一方面,还可以为使紫背天葵成为航天员新鲜蔬菜饮食单的一员提供理论根据。
[1] Smith S M,Zwarts S R.Nutritional biochemistry of spacefl ight[J].Adv.Clin.Chem.2008,46:87-130.
[2] Maeda G.Anti-oxidation activity of okinawa traditional vegetables[J].Bull Okinawa Agric.Res.Cntr.2006,8:65-70.
[3] Shimizu Y,Imada T,Zhang H,et al.Identification of novel poly-acylated anthocyanins from Gynura bicolor leaves and their antioxidative activity[J].Food Sci.Technol.Res. 2010,16:479-486.
[4] Shimizu Y,Imayoshi Y,Kato M,et al.Volatiles from leaves of field-grown plants and shoot cultures of Gynura bicolor DC[J].Flavour Fragr.J.2009,24:251-258.
[5] Barta D J,Tibbits TW,Bula R J,et al.Evaluation of light emitting diode characteristics for a space-based p lant irradiation source[J].Adv Space Res.1992,12:141-149.
[6] Nishimura T,Ohyama K,Goto E,et al.Concentrations of perillaldehyde,limonene,and anthocyanin of Perilla plantsas affected by light quality under controlled environments[J]. Sci.Hortic.2009,122:134-137.
[7] Liu X Y(刘晓英),Chang T T(常涛涛),Guo S R(郭世荣),et al.Effect of irradiation with blue and red LED on fruit quality of cherry tomato during growth period(红蓝LED光全生育期照射对樱桃番茄果实品质的影响)[J].China vegetables(中国蔬菜),2010,1:21-27.
[8] Wu M C,Hou C Y,Jiang C M,et al.A novel approach of LED light radiation improves the antioxidant activity of pea seedlings[J].Food Chem.2007,101:1753-1758.
[9] Ren J,Guo SS,Xu C L,et al.Effects of different carbon dioxide and LED lighting levels on the anti-oxidative capabilities of Gynura bicolor DC[J].Adv Space Res,2014a,53:353-361.
[10] Guo S,Tang Y,Zhu J,et al.Development of a CELSS experimental facility[J].Adv.Space Res.2008,41:725-729.
[11] Ren J,Guo SS,Xin XL et al.Changes in volatile constituents and phenols from leaves of Gynura bicolor DC grown in elevated CO2 and LED lighting[J].Sci.Hortic.2014b,175:243-250.
[12] Ozgen M,Reese R N,Tulio Jr A Z,et al.Modified 2,2-Azino-bis-3-ethylbenzothiazoline-6-sulfonic Acid(ABTS)method tomeasure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power(FRAP)and 2,2'-diphenyl-1-picrylhydrazyl(DPPH)methods[J].JAgric.Food Chem.2006,54:1151-1157.
[13] Noordermeer M A,Veldink G A,Vliegenthart J F G.Fatty acid hydroperoxide lyase:a plant cytochrome P450 enzyme involved in wound healing and pest resistance[J].Chembiochem.2001,2:494-504.
[14] Giuliana M,Craker L E.Effect of lightquality on growth and essential oil composition in rosemary[J].Acta Horttic. 2005,40:1062.
[15] Yoshida T,Higashi F,Ikawa S.On the oil containing tissue,the essential oil contents and the chemical composition of essential oil in Perilla species[J].Nippon Sakumotsu Gakkai Kiji,1968,37:118-122.
[16] Yoshid T,Morisada S,Kameoka K.On the distribution of oil gland and the accumulation of essential oil in Perilla species[J].Nippon Sakumotsu Gakkai Kiji,1969,38:333-337.
[17] Nishizawa A,Honda G,Kobayashi Y,et al.Genetic control of peltate glandular trichome formation in Perilla frutescens[J].Planta Med.1992,58:188-191.
[18] Gertsch J,LeontiM,Raduner S,etal.Beta-Caryophyllene is a dietary cannabinoid[J].PANS,2008,105:9099-9104.
[19] Choi IY,Ju C,Jalin A M,et al.Activation of cannabinoid CB2 receptor-mediated AMPK/CREB pathway reduces cerebral ischemic injury[J].Am.J.Pathol.2013,182:928-939.
[20] EbisawaM,Shoji K,Kato M,etal.Supplementary ultraviolet radiation B togetherwith blue lightatnight increased quercetin content and flavonolsynthase gene expression in leaf lettuce(Lactuca sativa L.)[J].Environ.Control Biol.2008,46:1-11.
[21] Noh B,Spalding E P.Anion channels and the stimulation of anthocyanin accumulation by blue light in Arabidopsis seedlings[J].Plant Physiol.1998,116:503-509.
[22] Qamaruddin M,Tillberg E.Rapid effects of red-light on the isopentenyladenosine content in scots pine seeds[J].Plant Physiol.1989,91:5-8.
[23] Galuszka P,Frebortova J,Luhova L,et al.Tissue localization of cytokinin dehydrogenase in maize:possible involvement of quinone species generated from plant phenolics by other enzymatic systems in the catalytic reaction[J].Plant Cell Physiol.2005,46:716-728.
[24] Li Q,Kubota C.Effects of supplemental light quality on growth and phytochemicals of baby leaf lettuce[J].Environ. Exp.Bot.2009,67:59-64.
[25] Zhang T T,Maruhnich SA,Folta K M.Green light induces shade avoidance symptoms[J].Plant Physiol.2011,157:1528-1536.
Effects of LED Light Quality on the Accumulation of Essential Oils and Phenols in Gynura Bicolor DC
REN Jin1,GUO Shuangsheng2,1,SHEN Yunze2
(1.Faculty of Life Sciences,Northwestern Polytechnical University,Shaanxi Xi'an 710072,China;2.National Key Laboratory of Human Factors Engineering,China Astronaut Research and Training Center,Beijing 100094,China)
To explore the efficient illuminant for Gynura bicolor DC to producemore bioactive compounds under controlled environments,three LED illuminants of R60B30G10(60%Red lights+ 30%Blue lights+10%Green lights),R70B20G10/(70%Red lights+20%Blue lights+10% Green lights)and R60B20G20(60%Red lights+20%Blue lights+20%Green lights)were applied to investigate the effects of light quality on the accumulation of secondary metabolites(essential oils and phenols).Results showed that R60B20G20 light treatment significantly increased the accumulation of terpenes(α,β-caryophyllene)and reduced the proportion of aldehydes(green leaf volatiles)in total volatiles,but such trend conversed in R60B30G10 light group.The contents of total anthocyanins and flavonoidswere promoted in R60B30G10 light treatment as compared with other light groups,and there were no difference between R70B20G10 and R60B2OG20 light conditions.In comparison to other light conditions,R70B20G10 lightgroup enhanced the accumulation of β-carotene and antioxidative capacity(DPPH assay)of leaf extract,whereas R60B20G20 light group evidently decreased the accumulation ofβ-carotene.Therefore,artificial LED lighting of R70B20G10 was a suitable condition for Gynura bicolor DC to produce more beneficial secondary metabolites and improve nutritional and medicinal value under controlled environment.
LED light quality;Gynura Bicolor DC.;terpenes;phenols
V524.2
A
1674-5825(2014)04-0386-07
2014-04-0;
2014-06-20
人因工程重点实验室自主研究基金(HF11ZZB06)
任锦(1986-),女,博士研究生,研究方向为受控生态生保系统。Email:yanjiushengrj@126.com

