国内外运动训练对成年大脑海马的影响综述
方春露,魏 源
(广州体育学院,广东 广州 510000)
国内外运动训练对成年大脑海马的影响综述
方春露,魏 源
(广州体育学院,广东 广州 510000)
采用文献资料法对运动训练对大脑海马齿状回(Dentate Gyrus/DG)、CA1、CA2、CA3区的神经元树突的数量、密度、长度等形态变化,运动训练影响海马发挥生理功能的脑源性神经营养因子(BDNF)、Ca2+、酪氨酸激酶受体(TrkB)等介质,以及各生理因子信号通路的研究进展进行综述。为进一步研究有氧运动训练对FMRP蛋白表达的影响及其对海马神经元可塑性的影响,进一步探究饮食与体育锻炼的关系提供理论参考。
大脑海马;运动训练;脑源性神经营养因子;齿状回
在神经解剖学上,把位于脑区颞叶内,且为脑边缘系统的组成部分,具有记忆和空间定位的功能,形态似“海马”的区域称为海马组织[1]。阿兹海默病患者海马组织机能异常,表现为无方向知觉且记忆衰退的症状。大脑有缺氧症状的患者海马区常伴随着损伤痕迹[2]。学者们根据海马组织的机能特征,将海马组织划分为齿状 回(Dentate Gyrus/DG)、CA1、CA2、CA3 4个 主要区域。哺乳动物大脑海马组织不同区域(DG、CA1、CA2、CA3区)的神经干细胞在生命过程中不断生成神经元,运动训练对海马组织神经元的再生具有重要影响,且不同程度地影响着齿状回(Dentate Gyrus/DG)、CA1、CA2、CA3 4个主要区域神经元的再生及其机体功能[3-9]。
通过文献资料法查阅20多篇国内外关于“运动训练”、“大脑海马”、“齿状回”方面的文献,论述运动训练对海马神经元机体功能的影响,进一步探究有氧运动训练对FMRP蛋白表达的影响,揭示对敲除控制FMRP蛋白表达的基因后有氧运动对海马神经元可塑性的影响,探索饮食与体育锻炼的关系对人体健康发展的重要意义。
1 运动训练对成年大脑海马DG、CA1、CA2、CA3区神经元形态的影响
Kuczewski等[4]通过动物实验证实了海马神经元的树突能够释放脑源性神经营养因子(BDNF),运动训练能够增加脑源性神经营养因子的mRNA水平,促进脑源性神经营养因子(BDNF)的生成,BDNF促进突触发生[5-7],而且其附加的分泌物质促成CA3区神经元前体的形成[8],加快基底树突的分化和轴突的分支,生理选择性地增加海马CA3区神经元的顶树突,促进DG区颗粒细胞发出新的向CA3区蔓延的轴突[9](图2,blue axons),CA3神经元可能为突触源性生长提供营养支持,并促使与苔状纤维突触的连接,被运输到苔状纤维的BDNF通过PI3 K信号分子机制增加CA3区神经元的脑源性神经营养因子mRNA量,从而促进CA3区神经元BDNF的树突突触的形成[10]。运动训练增加海马CA3区和DG区神经元的突触蛋白I含量,增加在CA3区的锥体神经元树突的长度和密度[11-12]。
动物小鼠实验(实验组:8只成年雄性小鼠进行60 d的运动训练;对照组:8只成年雄性小鼠不进行运动训练)的实验结果见图1。
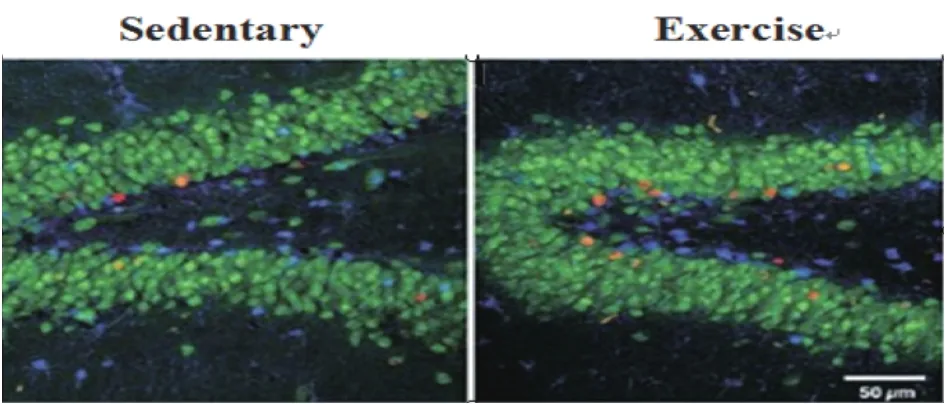
图1-1 小鼠海马DG区BrdU阳性细胞的共焦图像

图1-2 细胞数量
由图1-1可以看出参加运动训练的成年小鼠海马DG区BrdU阳性细胞(BrdU标记为红色)的形态学与安静组的相比有明显差异。大多数被BrdU标识的细胞在实验组和对照组的成年小鼠均表现NeuN阳性,但是参加运动训练的成年小鼠海马DG区生成了更多新的神经膜条。由统计学分析大脑海马DG区的细胞数量得条形图(图1-2),可知实验组和对照组的成年小鼠海马DG区的细胞数量存在显著性差异(P<0.05)。
经过动物小鼠实验证明海马区DG-CA3轴作为抗抑郁治疗的主要生物基[5、13]。由动物实验得图2 。
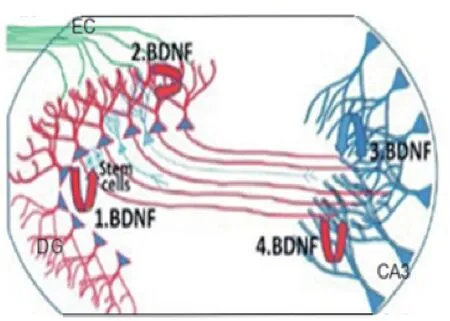
图2 海马齿状回(DG)神经营养的模型
在图2中,从齿状回(DG区)的颗粒细胞内释放的脑源性神经营养因子是红色的,然而从海马CA3区神经元内释放的脑源性神经营养因子是蓝色的。运动训练与抗抑郁药刺激齿状回内颗粒细胞产生和分泌脑源性神经营养因子,被运送到苔状纤维内的脑源性神经营养因子将会进一步支持树突的分裂(图2修改了仅抗抑郁药起神经营养作用的模型)。
成年大脑海马齿状区(GD区)神经再生是一种构造活动,在大脑海马齿状区颗粒下层生成新细胞。成年哺乳动物的大脑海马每天有数以千计的新颗粒细胞产生,细胞具体数值取决于运动训练和生理内环境。当细胞成熟时,将会从海马齿状区(GD区)颗粒下层向外迁移到细胞层的边缘,颗粒细胞的内层(Inner Granule Zone:IGZ)和外层(Outer Granule Zone:OGZ)均存在神经再生[13]。
由图3可得知,是否参加运动训练,其神经再生的状况是有所差异的,主树突的数量、树突的复杂程度和树突总长度在海马齿状回颗粒下层(The Subgranular Zone:SGZ)是最低的,在颗粒细胞内层略高,在颗粒细胞外层则最高。尤其颗粒细胞的内层(Inner Granule Zone:IGZ)和颗粒细胞的外层(Outer Granule Zone:OGZ),参加运动训练的树突分支数的平均值、树突总长度值与未参加运动训练的树突分支数的平均值、树突总长度值存在显著性差异(P<0.05)。在颗粒下层单一的、不成熟的树突通常会发展成一个主树突,而颗粒细胞外层的颗粒细胞主树突的数量增加较快,树突复杂性增强,树突总长度增加。
在所有的颗粒细胞区新增的细胞中有1个或2个主要的树突细胞的比例将会增加。这些细胞的树突将会变得更加复杂且其树突总长度整体有所提升,颗粒细胞树突形态可能反映着1个细胞的年龄以及在颗粒细胞层的位置。齿状回的细胞层的所有区域均能看到细胞分裂与未成熟的细胞。
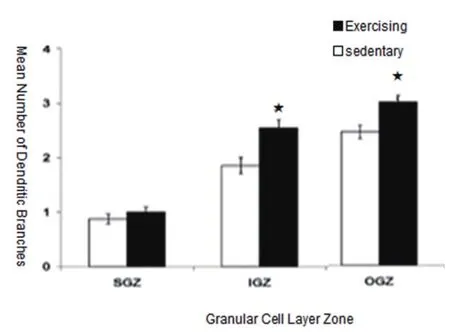
图3-1 树突分支数的平均值

图3-2 树突总长度
运动训练能够增加成年大脑海马CA1区、CA3区和GD区神经元的数量,改变新生颗粒细胞的树突结构,增加锥体神经元“树突网络”的复杂性,确保完整的神经回路,而CA2区神经元的长度、密度以及其树突的网络结构均无明显差异。
2 运动训练对成年大脑海马区神经元机体功能的影响
2.1 分子机制的研究 S.Vaynman等[14]研究运动训练影响成年大脑海马区域神经突触可塑性的分子机制,脑源性神经营养因子(BDNF)在调解运动训练对突触可塑性的影响可能发挥主要作用。已有学者通过动物实验发现BDNF可调节mRNA水平,其水平可至两极端,且研究了对神经元机体功能有重要调节影响的物质——环磷酸腺苷反应结合蛋白(cAMP-response element binding proteins,CREB)和突触蛋白I,以调节基因的转录和影响突触传递2种方式来调节神经元的机体功能。BDNF可提高CREB蛋白与突触蛋白I的mRNA水平,可增加其酪氨酸激酶受体(TrkB),运动训练能使机体通过介质反馈回路,增强BDNF对突触可塑性的影响,使用分子或是离子注摄法运用信号回馈通路实验和Taqman探针法反向转录为RNA聚合酶反应(rt -pcr)量化。
S.Vaynman等[14]研究了运动训练提高BDNF、TrkB、CREB以及突触蛋白I的mRNA水平,冬氨酸受体,钙或钙调蛋白的蛋白激酶II与有丝分裂原激活蛋白激酶,调节BDNF这一介质诱导海马区神经元再生的影响。运动训练通过调节海马组织中BDNF mRNA水平、CREB的活性、 MAPK的活性,通过影响与基因转录调控和突触功能息息相关的分子,如NMDA-R、CAMKII、MAP-K等分子,以BDNF信号通路塑造海马区神经元[14]。
Famer等[15]通过动物实验观察到运动训练过程中转化为神经元的细胞百分比,这表明不同的运动干预对细胞分裂有着不同程度的影响效果,在早期的研究中,在试管中用成年小鼠的海马组织切片实验发现运动训练能加强海马组织DG区LTP的能力,Famer等[15]发现用Water Treatment Plant Sludge(WTPS)实验法诱导体内产生机体感应程序,仅能够感应参加过长期的运动训练的小鼠的LTP,当应用一个更强的条件刺激时,观察到参加过运动训练的成年小鼠比安静组的成年小鼠具有更强的STP和LTP作用。这2个生理机制的主要区别是刺激的频率达到各种不同的阈值。在较强的机体感里可达100 hz阈值,而较弱的机体感应可达400 hz阈值[15]。
Raffaella等[16]用基因芯片技术(也称阵列技术)检测主观运动3 d、7d、28 d后1 176种基因在大脑中的表达,Taqman探针RT-PCR(逆转录+荧光定量PCR)实验和核糖核酸酶保护分析实验量化选择性表达的基因,突触前递质释放装置的发育成熟和突触后受体的转运是中枢神经系统突触发育过程中非常重要的2个方面。
调控突触后受体转运突触蛋白I、突触结合蛋白、突触融合蛋白、细胞外信号调节激酶、MAPK ERK(丝裂原活化蛋白激酶mitogen-activated protein kinases,MAPKs)信号通路、Ca2+/钙调蛋白蛋白激酶信号传导通路,Ca2+分裂酶原、胞外信号调节激酶I和胞外信号调节激酶II、蛋白激酶C(PKC)转录调节因子(CREB),谷氨酸系统中的有关基因受N-methyl-D-天冬氨酸受体NMDAR-2 ANMDAR-2 B和兴奋性氨基酸载体EAAC1的调控,虽然基因与γ-氨基丁酸(GABA)系统被抑制,但GABA受体、谷氨酸脱羧酶GAD65、BDNF是唯一的可持续上调的营养因子,大多数调控基因的因子均与BDNF有相互作用,在运动训练诱发海马神经元的塑造过程中BDNF起着决定性的作用,基因表达的时域剖面上似乎暗示着运动训练方能开通特殊的分子通道,在进行急性或慢性的运动训练后CaM-K信号系统均能被激活,但是在进行长期的运动训练后,MAP-K 系统才能被激活。
2.2 Ca2+的特定作用 运动训练可以刺激钙代谢激素,由于突触感应阈、T-type、Ca2+通道能够产生孤立的Ca2+的峰值,提高血钙水平,促进快速Na+的动作电位,Ca2被运送到大脑,通过Ca2的钙调素依赖系统,促进大脑中多巴胺(DA)的合成,进而改善大脑的生理功能,降低各种神经退行性疾病的发生率,目前已经有研究证实了运动能够有效减轻帕金森病、老年性痴呆的症状[17]。
2.3 大脑海马区域的学习、记忆、意识机能 S. Vaynman等[14]提出:不断地学习提高了成年大脑海马区域的神经元再生能力;相反,成年大脑海马神经元的再生提高了学习能力。新生成的神经元可能促进学习这一特定机能,且海马区的大小与学习和记忆能力有关。成年大脑海马区域中新生的颗粒细胞在主动和被动膜生理属性上明显不同于老化的颗粒细胞。成年大脑海马组织内新生的神经元的生理功能长时程增强(LTP)的能力比老化的神经元的LTP强,新生成的神经元对促进突触的可塑性表现出独特的机制,这对于形成新的记忆是很重要的。
Gabriele等[18]研究表明:尤其在运动训练过程中,BDNF能够循环利用,增强海马组织记忆与学习的机体功能,BDNF且能延缓随年龄增大而学习、记忆、认知能力的衰退,促进受损大脑的机体功能的快速恢复。
Nazan Uysal等[19]的动物实验的研究表明:成年小鼠参加运动训练,并未改变大脑海马区细胞的凋亡实况,以增加海马区细胞密度的方式提高大脑的认知能力,提高空间记忆能力。
Suk等[20]的动物实验研究表明:成年小鼠参加运动训练可以抵抗压力对大脑海马区神经元的抑制作用,保持愉悦心情。
3 进一步探究有氧运动训练对FMRP蛋白的影响
3.1 探究有氧运动训练对FMRP蛋白表达的影响 目前已经有文献报道FMRP蛋白与海马发挥空间记忆密切相关,但有氧运动训练对FMRP蛋白表达的影响尚未见报道。
3.2 探究有氧运动训练对敲除控制FMRP蛋白表达的基因的小鼠的神经元的可塑性的影响 尚未见文献报道过有氧运动训练对敲除控制FMRP蛋白表达的基因的小鼠的神经元的可塑性的影响。观察海马CA1、CA2、CA3、齿状回(Dentate Gyrus/DG)区域的神经元切片(显微镜成像),从形态学的角度对比分析有氧运动训练对正常鼠与敲除鼠的神经元的影响,明晰其影响具有重要意义。
3.3 饮食与体育锻炼的关系 很大程度上,人体通过消耗如Omega-3脂肪酸或植物多酚类的天然产物来强化体育锻炼对大脑的“净化作用”。饮食和体育锻炼之间存在着潜在的协同作用,其可以激活大多数的信号通路,提高神经元的再生能力和细胞存活能力,增强突触可塑性,提高心血管机体功能。营养对大脑功能可能有直接影响,体育锻炼的效果可以通过补充膳食来增强。对大脑最好的保养可能取决于体育锻炼和消耗天然产品。某种天然产品可增强体育锻炼对大脑的积极作用。未来的研究可以把重点放在具有单个或多个活性分子且能够提高大脑的认知能力的天然物质上,并可选择最有可能的天然化合物进行深入地探究。饮食和体育锻炼之间的潜在协同作用是否存在于大多数的细胞中,以及其分子机制均有待进一步明确。
[1]赵永寿,田振军,白建超.长期停训大鼠海马神经元细胞凋亡因子Bax、Bcl-2的表达[J].陕西师范大学学报:自然科学版,2012,40(1):104-108.
[2]朱向阳,牛保峰,董政协,等.2型糖尿病和阿尔茨海默病关系的研究进展[J].医学综述,2011,17(10):1528-1531.
[3]孙国欣,田振军,何江明.不同负荷运动对大鼠海马CAⅠ区一氧化氮合酶表达的影响[J].天津体育学院学报,2006,21(1):18-20.
[4]Kuczewski N,Porcher C,Lessmann V,Medina I,Gaiarsa JL.Activity-dependent dendritic release of BDNF and biological consequences[J].Mol Neurobiol,2009(39):37-49.
[5]Cohen-Cory S,Kidane AH, Shirkey NJ,Marshak S. Brain-derived neurotrophic factor and the development of structural neuronal connectivity[J]. Dev Neurobiol, 2010(70):271-288.
[6]Jeanneteau F, Deinhardt K,Miyoshi G,Bennett AM, Chao MV.The MAP kinase phosphatase M K P-1 r e g u l a t e s B D N F-i n d u c e d a x o n branching[J].Nat Neurosci ,2010(13):1373-1379.
[7]M a g a r i n o s A M,L i C J,G a l T o t h J,B a t h KG,Jing D,Lee FS et al.Effect of brain-derived neurotrophic factor haploinsuffi-ciency on stressinduced remodeling of hippocampal neurons[J]. Hippocampus,2011,21:253-264.
[8]Santarelli L,Saxe M,Gross C,Surget A,Battaglia F,Dulawa S et al.(2003).Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants[J].Science, 2003,301:805-809.
[9]Castren E.the effect of exercise training on plasticity of hippocampal neurons[J].Curr OpinPharmacol,2004,4: 58-64.
[10]Righi M,Tongiorgi E,Cattaneo A (2000).Brainderived neuro-trophic factor (BDNF) induces dendritic targeting of BDNF and tyrosine kinase B mRNAs in hippocampal neurons through a phosphatidylinositol-3 kinase-dependent pathway[J].J Neurosci,2000,20:3165-3174.
[11]Vaynman S,Ying Z,Gomez-Pinilla F (2004). Exercise induces BDNF and synapsin I to specific hippocampal subfields[J].J Neurosci Res,2004,76:356-362.
[12]Yau SY,Lau BW,Tong JB,Wong R,Ching YP,Qiu G et al.(2011).Hippocampal neurogenesis and dendritic plasticity support running-improved spatial learning and depression-like beha-viour in stressed rats[J].PLoS One ,2011,6:e24263.
[13]Castren E,Rantamaki T.The role of BDNF and its receptors in depression and antidepressant drug action: reactivation of developmental plasticity[J]. Dev Neurobiol, 2010,70:289-297.
[14]S.VAYNMAN,Z.YING AND F.GOMEZ-PINILLA. Interplay between brain-derived neurotrophic factor and signal transduction modulators in the regulation of the effects of exercise on synaptic-plasticity[J]. Neuroscience,2003,122:647-657.
[1 5]J.F A R M E R,X.Z H A O,H.V A N P R A A G,K. W O D T K E,F.H.G A G E A N D B.R.C H R I S T I E. Effects of voluntary exercise on synaptic plasticity and gene expression in the dentate gyrus of adult male sprague-dawley rats in vivo[J]. Neuroscience,2004,124:71-79.
[16]Raffaella Molteni,Zhe Ying and Femando Gomez-Pinilla.Differential effects of acute and chronic exercise on plasticity-related genes in the rat hippocampus revealed by microarray[J].European Journal of Neuroscience,2002,16:1107-1116.
[17]Den,etsu Sutoo and Kayo Akiyama. Regulation of brain function by exercise[J].Neurobiology of Disease,2003,13:1-14.
[18]Gabriele Baj,Valentina D,Alessandro,Laura Musazzi, Alessandra Mallei,Cesar R Sartori,Marina Sciancalepore, Daniela Tardito,Francesco Langone,Maurizio Popoli and Enrico Tongiorgi. Physical exercise and antidepressants Enhance B D N F t a r g e t i n g i n h i p p o c a m p a l C A 3 dendrites:further evidence of a spatial code for BDNF splice variants[J].Neuropsychopharmacology, 2012,37:1600-1611.
[19]Nazan Uysal,Kazim Tugyan,Berkant Muammer Kayatekin,et al.The effects of regular aerobic exercise in adolescent period on hippocampal neuron density,apoptosis and spatial memory[J]. Neuroscience Letters,2005,383:241-245.
[20]Suk-Yu,Benson Wui-Man Lau,Kwok-Fai So.Adult hippocampal neurogenesis:a possible way how physical exercise counteracts stress[J].Cell Transplantation,2011,20:99-111.
Summary on Influence of Domestic and Overseas Sports Training to Adult Hippocampus
FANG Chun-lu, WEI Yuan
(Guangzhou Institute of Physical Education, Guangzhou 510500, Guangdong China)
Adopting method of literature consultation, this thesis summarizes variation of neuronal dendrite quantity, density and length in hippocampus dentate Gyrus/DG, CA1, CA2 and CA3 caused by sports training. This paper also studies mediums like brain derived neurotrophic factor (BDNF), Ca2+、tyrosine kinase receptor (TrkB) affecting physiological function of hippocampus, as well as research progress of physiological signal path. To further study effect of aerobic exercise training to FMRP protein expression, and its effect to plasticity of hippocampal neuron, so as to provide reference to further exploration of relationship between diet and physical exercise.
hippocampus; sports training; brain derived neurotrophic factor; dentate gyrus
G804.21
A
1004-7662(2014 )12-0088-05
2014-11-06
科技部科研院所专项资金项目“高准确度运动能量消耗模型构建及样机研制”(项目编号:NO 2013 EG145136)。通信作者:魏源。
方春露,硕士研究生,研究方向:体育教育训练学。

