响应面分析优化加压溶剂法提取甜菊糖苷工艺
俞坚
(杭州职业技术学院,杭州市绿色精细化工研究与技术转化重点实验室,浙江杭州310018)
甜菊糖苷是甜叶菊(Stevia rebaudiana Bertoni leaves)中提取的天然甜味剂[1],2012年国家卫生部批准其作为冷冻饮品、果冻等食品的添加剂。与蔗糖相比,甜菊糖苷是非发酵性物质,对高温、酸、碱相对稳定[2]。它在食品加工过程中,不会像蔗糖那样发生褐变现象,应用成本比蔗糖低50%,热值仅为蔗糖的1/300,甜度是蔗糖的250倍~300倍[3]。目前,国内外提取甜菊糖苷的工艺主要采用热水蒸煮法,该法简单易行,提取成本较低,因此一直以来都被广泛使用,此外,还有水提法[4]、酶法[5]等,但是由于这些传统提取法存在提取时间长、溶剂用量大、原料利用率低等缺点,因此,不少学者对甜菊糖苷的提取进行了多方面的探索,越来越多新的工艺技术被引进,如超声波提取技术[6]、超临界提取技术[7]、微波提取技术[8]、超高压提取技术[9]等。
加压溶剂提取技术自1995年Richter等学者[10]提出方法以来,其应用涉及食品、药物分析、环境等诸多领域。与传统热水蒸煮法相比,加压溶剂提取技术具有提取时间短、提取效率高、操作简便、省时经济等优点[11]。目前,已在植物有效成分的提取中得到了一定的应用,但将其应用于提取甜菊糖苷未见报道。本文尝试采用加压溶剂提取甜菊糖苷,并结合Box-Benhnken中心组合试验和响应面分析法对提取工艺进行优化,以期为甜菊糖苷的快速高效提取提供一种新工艺技术。
1 材料与方法
1.1 材料、试剂与仪器
甜叶菊:购自于杭州艺福堂茗茶旗舰店,阴干后粉碎过80目标准筛。
氢氧化钾、硫酸、酚酞等化学试剂均为分析纯,实验用水为双蒸馏水。
Dionex-ASE200加压溶剂提取仪:美国Dionex公司;AE240S分析天平:梅特勒-托利多上海有限公司;碱性滴定管:华东医药有限公司;布氏漏斗、小型粉碎机和超声波清洗器等。
1.2 方法
1.2.1 甜菊糖苷提取得率的测定[12]
取甜叶菊2.000 g,加入30.0 mL水,经加压溶剂提取后,上清液减压浓缩,移置250 mL锥形瓶中,加入稀硫酸25.0 mL与水25.0 mL,振摇溶解后,加热至微沸,水解30 min,冷却,过滤,滤渣用水洗至中性后,加中性乙醇50.0 mL,溶解后,再加酚酞指示剂2滴,用0.05 mol/L氢氧化钾滴定至溶液显红色,10 s内不褪色。每1.0毫升乙醇制氢氧化钾滴定液相当于40.24 mg的C38H60O18。按下式求出甜菊糖苷得率:
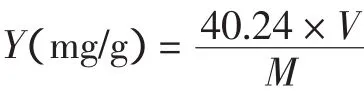
式中:Y为甜菊糖苷得率,(mg/g);V为消耗的氢氧化钾体积,mL;M为甜叶菊质量,g。
1.2.2 单因素试验设计
依据前期预试验结果,取甜叶菊2.000 g,加入30 mL水,设定加压溶剂提取仪提取压力8 MPa、提取时间10 min、提取温度100℃中的3个因素,改变其中一个因素,进行单因素试验,各因素梯度设计为:提取压力 4、6、8、10、12 MPa;提取时间 1、5、10、15、20 min;提取温度 60、80、100、120、140 ℃。
1.2.3 响应面试验设计
依据单因素试验结果,采用Box-Behnken设计方案做响应曲面研究[13]。3个自变量提取压力、提取时间和提取温度分别以A,B和C代表,以+1,0,-1分别代表各自的不同水平,编码因素及水平、试验设计方案见表1。

表1 响应面分析因素及水平Table 1 Factors and levels of Box-Behnken experiment
1.3 数据处理
响应面试验数据采用Design Expert 8.0软件绘图并作方差和显著性分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 提取压力对甜菊糖苷提取得率的影响
不同提取压力对甜菊糖苷提取得率的影响,见图1。
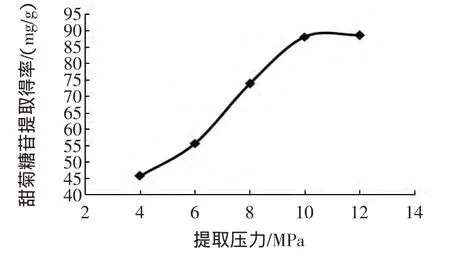
图1 不同提取压力对甜菊糖苷提取得率的影响Fig.1 Effect of treatment pressure on stevioside extraction rate
料液比为1∶15 g/mL,提取时间10 min,提取温度100℃,考察提取压力分别为4 MPa~12 MPa时对甜菊糖苷提取得率的影响。从图1可知,加压溶剂法提取甜菊糖苷,随着提取压力从4 MPa提高到12 MPa,甜菊糖苷提取得率不断提高。当提取压力达到10 MPa后,甜菊糖苷提取得率变化趋缓。初步推断,提取高压一方面保证了提取溶剂在100℃高温下始终处于液体状态;另一方面高压可能会使提取样品甜叶菊表面孔隙变多、变大,与提取溶剂接触的比表面积增大。但是,过高的压力会增加设备的维护费用。因此,选择8 MPa~12 MPa区间作为响应面优化考察范围。
2.1.2 提取时间对甜菊糖苷提取得率的影响
不同提取时间对甜菊糖苷提取得率的影响,见图2。

图2 不同提取时间对甜菊糖苷提取得率的影响Fig.2 Effect of treatment time on stevioside extraction rate
料液比为1∶15 g/mL,提取压力8 MPa,提取温度100℃,考察提取时间分别为1 min~20 min时对甜菊糖苷提取得率的影响。从图2可知,加压溶剂法提取甜菊糖苷,随着提取时间从1 min延长到10 min,甜菊糖苷提取得率提高明显;而10 min到20 min,甜菊糖苷提取得率几乎没有增加,反而略有下降。初步表明,在提取压力8 MPa和提取温度100℃下,提取10 min甜菊糖苷提取基本达到平衡。因此,选择5 min~15 min区间作为响应面优化考察范围。
2.1.3 提取温度对甜菊糖苷提取得率的影响
不同提取温度对甜菊糖苷提取得率的影响,见图3。
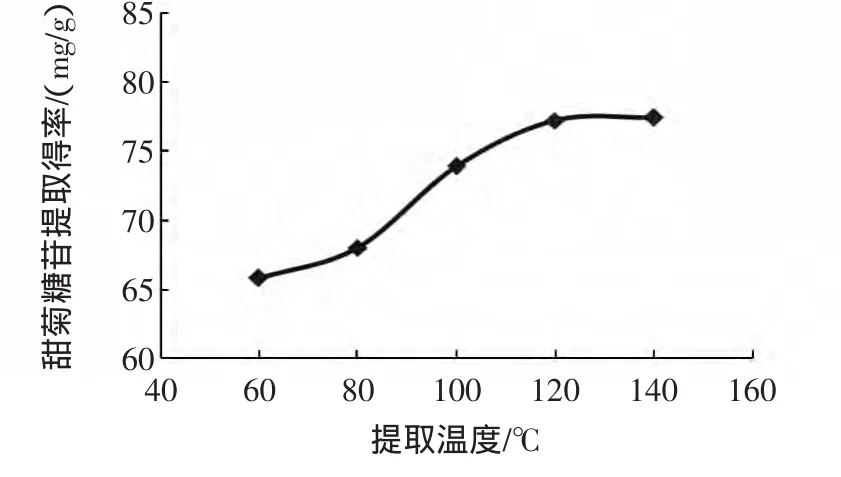
图3 不同提取温度对甜菊糖苷提取得率的影响Fig.3 Effect of treatment temperature on stevioside extraction rate
料液比为1∶15 g/mL,提取压力8 MPa,提取时间10 min,考察提取温度分别为60℃~140℃时对甜菊糖苷提取得率的影响。从图3可知,加压溶剂法提取甜菊糖苷,随着提取温度从60℃上升到140℃,甜菊糖苷提取得率逐步提高。初步推测,温度越高,提取溶剂扩散速度越快,且对样品甜叶菊的破坏作用越大,有利于甜菊糖苷溶出。但是,温度过高会使水溶性杂质的溶出量增加,给后续甜菊糖苷的分离纯化带来困难。因此,选择80℃~120℃区间作为响应面优化考察范围。
2.2 响应面试验结果与分析
以提取压力(A)、提取时间(B)和提取温度(C)为自变量,甜菊糖苷提取得率(R)为响应值,进行响应面优化试验,试验方案及结果见表2。

表2 响应面优化试验结果Table 2 Program and results of Response Surface Analysis
应用Design Expert 8.0软件进行多元回归拟合分析,各试验因子对响应值的影响可用如下多元二次回归方程表示:R=88.17+5.49 A+3.54 B+4.53 C-0.25 AB+0.47 AC+0.12 BC-7.43 A2-5.03 B2-2.71 C2
图4~图6直观地反映了提取压力、提取时间和提取温度等3个因素两两交互对甜菊糖苷提取得率的影响。

图4 提取压力和提取时间对甜菊糖苷提取得率影响的响应面图Fig.4 Response surface plot showing the interactive effect of treatment pressure and time on stevioside extraction rate
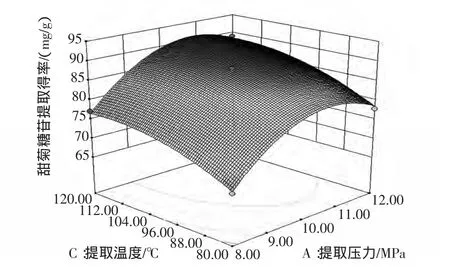
图5 提取压力和提取温度对甜菊糖苷提取得率影响的响应面图Fig.5 Response surface plot showing the interactive effect of treatment pressure and temperature on stevioside extraction rate
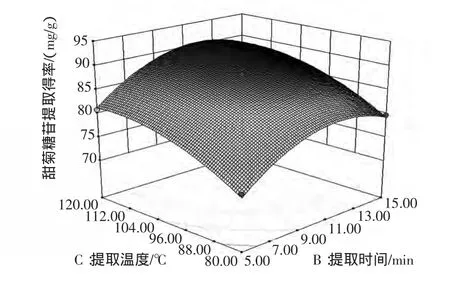
图6 提取时间和提取温度对甜菊糖苷提取得率影响的响应面图Fig.6 Response surface plot showing the interactive effect of treatment time and temperature on stevioside extraction rate
从图4可以看出,提取压力与提取时间交互作用中,沿提取压力轴变化密集,而沿提取时间轴变化稀疏,故提取压力对响应值峰面积的影响较提取时间的影响大。从图5可以看出,提取压力与提取温度交互作用中,沿提取压力轴变化密集,而沿提取温度轴变化稀疏,故提取压力对响应值峰面积的影响较提取温度的影响大。从图6可以看出,提取时间与提取温度交互作用中,沿提取时间轴变化密集,而沿提取温度轴变化稀疏,故提取时间对响应值峰面积的影响较提取温度的影响大。
对表2中的试验结果进行统计分析,得到的方差分析结果如表3所示。

表3 响应面优化试验结果方差分析Table 3 Analysis of variance for response surface regression equation
由表3可知,提取压力、提取时间和提取温度的一次项均达到极显著水平(P<0.000 1),整体模型的“Prob>F”值小于0.000 1,表明该二次方程模型达到极显著水平,并且失拟项不显著,说明该方程对加压溶剂法提取甜菊糖苷试验拟合较好。
2.3 较优工艺与验证实验
对回归方程求导,并令R值等于零,可以得到曲面的最大点,即3个主要因素的最佳水平值,转换后得到加压溶剂法提取甜菊糖苷的最佳条件为:提取压力10.8 MPa、提取时间11.8 min和提取温度117.6℃,此时甜菊糖苷提取得率达91.9 mg/g。对预测值进行验证,选择的条件取整后提取压力11 MPa、提取时间12 min和提取温度118℃,甜菊糖苷的得率实际分别为91.7、91.6、91.7、91.9、91.8 mg/g,平均为 91.7 mg/g(标准偏差为0.11)。试验测量值稳定,数据重现性良好,标准偏差较小,说明每次测定的甜菊糖苷得率稳定,结果合理可靠。
3 结论与讨论
加压溶剂法提取甜菊糖苷经单因素试验和响应面分析寻优试验,优化了提取工艺参数(提取压力、提取时间、提取温度)最终获得较优的提取方案为:提取压力11 MPa、提取时间12 min和提取温度118℃,在此条件下甜菊糖苷提取得率达91.7 mg/g。加压溶剂法提取甜菊糖苷具有效率高、设备操作简单和污染小等优点,符合当前甜叶菊提取物现代生产工艺技术的发展方向。
加压溶剂提取功能性成分是近几年来发展起来的较为高效的提取技术。Selim等学者[14]成功地用加压溶剂法从安纳托利亚蜂胶中获得了具有抗氧化活性的酚类化合物。Diego等学者[15]证明了采用加压溶剂技术从嘉宝果表皮提取酚类化合物具有良好的经济可行性和工业化前景。范晓良等学者[16]采用高压溶剂萃取法提取香菇多糖,证明了该技术具有提取率高、省时、耗能少,操作方便等优点。
本研究采用的加压溶剂法提取甜菊糖苷的工艺方案是在实验条件下获得,工艺除了对提取压力和提取时间的选择外,提取温度的选择也至关重要,都直接关系到了甜菊糖苷提取得率的高低,若是提取压力过高,保压时间过长,会显著增加设备的制造和维护成本;若是提取温度过高,会使甜叶菊水溶性杂质的溶出量增加,给甜菊糖苷后续的分离纯化带来困难。因此,对于加压溶剂法提取甜菊糖苷的现代化工业实际应用还须有一些需要改进的地方。
[1] Geuns J M C.Stevioside[J].Phytochemistry,2003,64(5):913-921
[2] Gerhard Kroyer.Stevioside and Stevia-sweetener in food:application,stability and interaction with food ingredients[J].Journal für Verbraucherschutz und Lebensmittelsicherheit,2010,5(2):225-229
[3] Varanuj Chatsudthipong,Chatchai Muanprasat.Stevioside and related compounds:Therapeutic benefits beyond sweetness[J].Pharmacology&Therapeutics,2009,121(1):41-54
[4] Chhaya Rai,G C Majumdar,Sirshendu De.Optimization of Process Parameters for Water Extraction of Stevioside using Response Surface Methodology[J].Separation Science&Technology,2012,47(7):1014-1022
[5] Munish Puri,Deepika Sharma,Ashok K Tiwari.Downstream processing of stevioside and its potential applications[J].Biotechnology Advances,2011,29(6):781-791
[6] Jie Liu,Jin-wei Li,Jian Tang.Ultrasonically assisted extraction of total carbohydrates from Stevia rebaudiana Bertoni and identification of extracts[J].Food and Bioproducts Processing,2010,88(2/3):215-221
[7] A Erkucuk,I H Akgun,O Yesil-Celiktas.Supercritical CO2extraction of glycosides from Stevia rebaudiana leaves:Identification and optimization[J].The Journal of Supercritical Fluids,2009,51(1):29-35
[8]俞坚,蔡靓.响应面法优化微波辅助提取甜菊糖苷工艺的研究[J].食品工业科技,2012,33(15):280-283
[9] 李宾,贾士儒,钟成,等.采用超高压技术从甜叶菊中提取甜菊糖甙的工艺研究[J].现代食品科技,2010,26(10):1117-1120
[10]Richter BE,Ezzell JL,J Fexlix,et al.A comparison of accelerated solvent extraction for organophosphorus pesticides and herbicides[J].LC-GC The Magazine of Separation Science,1995,13:390-398
[11]Arwa Mustafa,Charlotta Turner.Pressurized liquid extraction as a green approach in food and herbal plants extraction:A review[J].Analytica Chimica Acta,2011,703(1,3):8-18
[12]国家药典委员会.中华人民共和国药典二部[M].北京:中国医药科技出版社,2010:1221
[13]李西腾.响应面法优化蒲菜总黄酮提取工艺[J].食品研究与开发,2011,32(12):36-39
[14]Selim Erdogan,Burhan Ates,Gokhan Durmaz,et al.Pressurized liquid extraction of phenolic compounds from Anatolia propolis and their radical scavenging capacities[J].Food and Chemical Toxicology,2011,46(7):1592-1597
[15]Diego T Santos,Priscilla C.Veggi,M.Angela A,et al.Optimization and economic evaluation of pressurized liquid extraction of phenolic compounds from jabuticaba skins[J].Journal of Food Engineering,2012,108(3):444-452
[16]范晓良,李行诺,楚楚,等.响应面法优化加压溶剂萃取香菇多糖工艺研究[J].中国食品学报,2012,12(2):98-103

