银杏叶中黄酮类物质的酶法提取研究
张伟,张焕新,施帅
(江苏农牧科技职业学院,江苏泰州225300)
银杏叶,形似扇,又像飞蛾或鸭脚形,江苏泰州是我国银杏四大主要产区之一,素有“银杏之乡”的美誉,栽植银杏近800万株,占全国的三分之一。银杏叶中含有160多种化学成分,其中黄酮类化合物、萜类内酯被认为是主要活性成分,银杏酚酸为主要毒性成分[1],黄酮类化合物具有极强的清除自由基能力和抗氧化能力,具有良好的防治心血管疾病的功效,因而受到国内外的广泛研究[2-3]。银杏叶中黄酮类物质主要包裹在细胞壁内(由β-D-葡糖以1,4-β-葡糖苷键连接),传统方法大多不能完全破碎细胞壁,限制了黄酮类物质的溶出,严重影响了提取效率[4]。纤维素酶是一类复合酶,它能将组成细胞壁的纤维素骨架逐级降解成葡萄糖,进而破坏细胞壁骨架结构,增加细胞内活性成分的溶出[5]。因此,本文拟探索纤维素酶法提取银杏叶总黄酮的最佳工艺,以期提高提取得率,并进一步探索银杏叶提取物中黄酮类物质的种类。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料
银杏叶:大佛指品系,采自江苏畜牧兽医职业技术学院校内;HCl、乙醇、硝酸铝、亚硝酸钠、NaOH、H3PO4、氯化铁、磷酸、高硫酸钾均为分析纯:中国医药集团上海化学试剂有限公司;甲醇(色谱纯):中国医药集团上海化学试剂有限公司;芦丁标准品、槲皮素对照品、山奈酚对照品、异鼠李素对照品:中国药品生物制品检验所;纤维素酶(酶活35 000 IU/g):Sigma中国。
1.1.2 主要仪器设备
JH722可见分光光度计:上海菁华科技仪器有限公司;Fw 177型中草药粉碎机:上海隆拓仪器设备有限公司;RE-52D旋转蒸发器:上海青浦沪西仪器厂;Empower色谱工作站、Sunfire C18反相柱(4.6×150 mm,2.5 μm)、1525 μ 型二元泵、2996 紫外光检测器:美国Waters公司。
1.2 试验方法
1.2.1 提取工艺
新鲜银杏叶经过低温烘干后,用中草药粉碎机粉碎后过60目筛,准确称取2.0 g,酶水解后灭酶,加入乙醇溶液浸提24 h,冷藏后过滤,计算银杏叶总黄酮提取得率。
1.2.2 酶解工艺
以酶解温度、酶处理pH、酶浓度和酶解时间为4个考察因素,以银杏叶总黄酮提取得率为考察指标,进行L9(34)正交试验设计,考察各因素对银杏叶总黄酮提取得率的影响,以确定酶处理的最佳条件。正交试验因素水平表见表1。
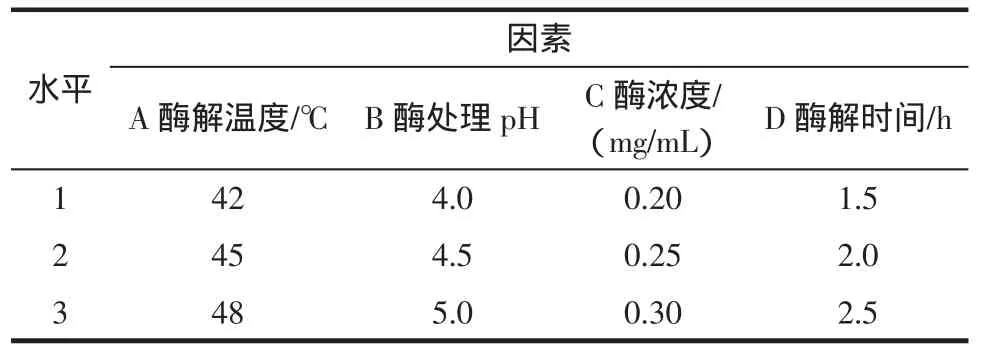
表1 正交试验因素水平表Table 1 Parameters and test levels for orthogonal experiment
1.2.3 银杏叶中黄酮类物质的测定方法
以芦丁为标样,采用亚硝酸钠-硝酸铝显色法[6-7]测定银杏叶中黄酮类物质含量。标准曲线的回归方程为:A=11.679C-0.00128,式中:C为芦丁浓度,(mg/mL);A为吸光度,相关系数R2=0.997 4,在浓度为0 mg/mL~0.056 mg/mL范围内,有良好的线性关系。

式中:C为由标准曲线计算得出的样品的总黄酮浓度,(mg/mL);V为样品溶液的体积,mL;N为样品的稀释倍数;M为银杏干叶质量,mg。
1.2.4 银杏叶提取物中黄酮种类的鉴定
移取银杏叶提取物1 mL至50 mL的圆底烧瓶中,加入5 mL 25%的HCl溶液,在90℃水浴中回流加热30 min。迅速冷却,用甲醇定容至50 mL。用0.45 μm的微孔滤膜过滤。
色谱条件:选用反相柱进行洗脱。分析采用美国Waters公司1525μ型二元泵和2996型二极管阵列检测器和Empower色谱工作站。
色谱柱为Waters公司的sunfire C18反相柱(4.6×150mm,2.5μm)。流动相为A∶B=50∶50(体积比,A为100%的甲醇,B为0.4%H3PO4水溶液),流速为1.0 mL/min,进样量为 10 μL。
在线进行紫外检测,200 nm~400 nm全扫描,分辨率1.2 nm。检测波长为360 nm。
2 结果与讨论
2.1 酶解工艺条件的确定
2.1.1 酶解温度对银杏叶总黄酮提取得率的影响
准确称取2 g粉碎过筛的银杏粉末放入50 mL容量瓶,加入20 mL HAc-NaAc缓冲溶液,调节pH为4,酶浓度为 0.3 mg/mL,调节酶解温度为 30、35、40、45、50、55、60℃,酶解 2 h后灭酶,70%乙醇定容、提取、过滤,计算银杏叶总黄酮提取得率,结果见图1。

图1 酶解温度对总黄酮提取得率的影响Fig.1 Effect of temperature on flavonoids extraction yield
由图1可知,随着温度的升高,银杏叶总黄酮提取得率增大,在45℃时达到最大值,50℃保持在相似水平略有下降,随后,随着温度升高,总黄酮提取得率显著下降,当温度达到55℃后,总黄酮提取得率随温度变化下降不明显。这是由于纤维素酶在45℃~50℃之间有最大活力,同时也能保持较好的稳定性,如温度进一步加大,由于蛋白质变性,酶的活性降低,浸提效果反而变差。
2.1.2 酶处理pH对银杏叶总黄酮提取得率的影响
溶液的pH影响着酶的活性,纤维素酶的活性中心偏酸性条件[8]。故准确称取2 g粉碎过筛的银杏粉末放入50 mL容量瓶,加入20 mL HAc-NaAc缓冲溶液,调节酶解温度为45℃,酶浓度为0.3 mg/mL,酶解2 h后灭酶,70%乙醇定容、提取、过滤,考察pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0 时,银杏叶总黄酮提取得率的变化,结果见图2。

图2 pH对总黄酮提取得率的影响Fig.2 Effect of pH on flavonoids extraction yield
由图2可知,当pH 4.5时,总黄酮提取得率最高,且呈现向两边递减的趋势。由于pH既能影响酶的构象,也会影响底物的解离状态,当pH4.5时,纤维素酶活力最大,可最大限度的破坏细胞壁纤维素β-1,4葡萄糖苷键,使传质阻力减小,从而浸提效率最高[9]。
2.1.3 酶浓度对银杏叶总黄酮提取得率的影响
准确称取2 g粉碎过筛的银杏粉末放入50 mL容量瓶,加入20 mL HAc-NaAc缓冲溶液,分别调节酶解温度为45℃,酶解pH为4,调整酶浓度分别为0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4 mg/mL,酶解 2 h 后灭酶,70%乙醇定容、提取、过滤,分别计算银杏叶总黄酮提取得率,结果见图3。

图3 酶浓度对总黄酮提取得率的影响Fig.3 Effect of enzyme consumption on flavonoids extraction yield
由图3可知,酶浓度增大,总黄酮提取得率提高。但当酶浓度增大到0.25 mg/mL时,总黄酮提取得率几乎不再提高,保持在相似水平并略有波动。
2.1.4 酶解时间对银杏叶总黄酮提取得率的影响
准确称取2 g粉碎过筛的银杏粉末放入50 mL容量瓶,加入20 mL HAc-NaAc缓冲溶液,调整pH为4、酶浓度为0.3 mg/mL,保持温度为45℃,分别酶解0.5、1、1.5、2、2.5、3 h 后灭酶,70%乙醇定容、提取、过滤,计算银杏叶总黄酮提取得率,结果见图4。
由图4可知,随着酶解时间的延长,银杏叶总黄酮提取得率显著增大,但当酶解时间达到2 h后,银杏叶总黄酮提取得率增加不明显,因为酶解产物的浓度增加,抑制了水解过程。

图4 酶解时间对总黄酮提取得率的影响Fig.4 Effect of hydrolysis time on flavonoids extraction yield
2.1.5 正交优化试验结果与分析
在单因素实验的基础上,利用正交法“均衡分散”的特点[10],以酶解温度、酶处理pH、酶浓度、酶解时间为考察因素,以银杏叶总黄酮提取得率为考察指标,进行正交设计,试验结果见表2。

表2 L9(34)正交试验结果Table 2Result of L9(34)orthgonal test
由表2可知,各因素对银杏叶总黄酮提取得率的影响依次是:酶解温度>酶浓度>酶解时间>酶处理pH。
采用SPSS 13.0 for windows对正交试验结果进行方差分析,结果见表3。
由表 3 可知,酶解温度(p<0.01)、酶浓度(p<0.05)、酶解时间(p<0.05)对银杏叶总黄酮提取得率有显著影响。酶处理pH对银杏叶总黄酮提取得率影响很小,作为误差项。
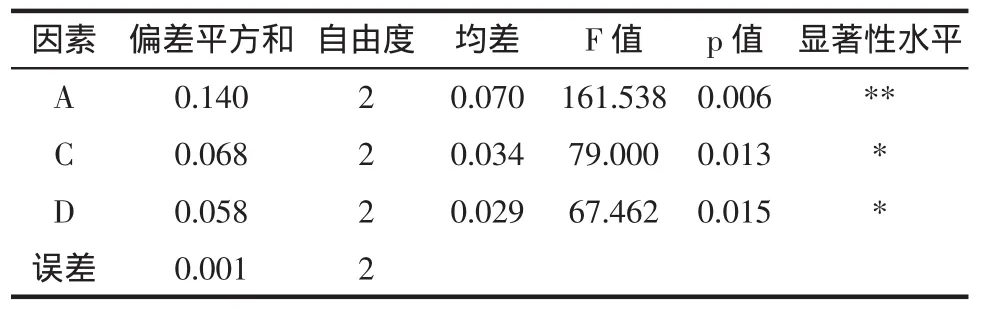
表3 方差分析Table 3 Analysis of variance
根据银杏叶总黄酮提取得率高的要求,本实验确定最佳酶解条件为A2B1C3D2,即在酶解温度为45℃、酶处理pH为4、酶浓度为0.3 mg/mL、酶解时间2 h时,银杏叶总黄酮得率最高。根据最佳酶解条件,做3组验证性试验,同时做3组为未添加纤维素酶的空白试验,结果见表4。
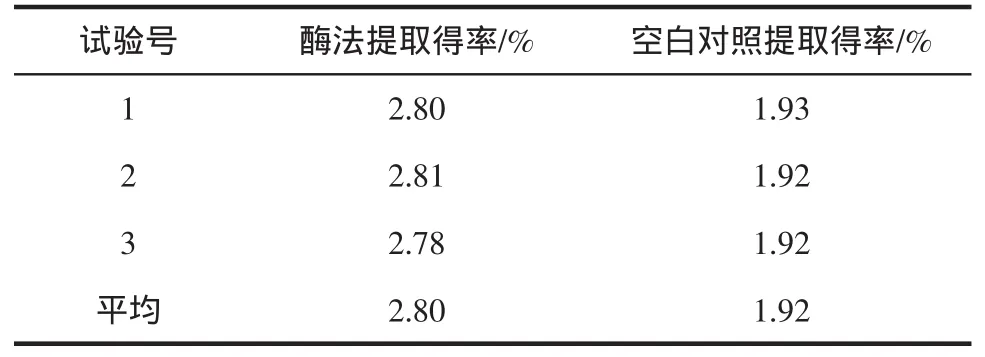
表4 酶法提取与空白试验提取率比较Table 4 Comparison of extraction yield by cellulase and noncellulase
由表4可知,未添加纤维素酶的空白对照试验,黄酮类物质提取平均得率为1.92%,而酶法提取试验,黄酮类物质平均得率为2.80%,显著提高了45.83%。对比试验表明:纤维素酶在银杏叶总黄酮提取过程中发挥了重要作用,随着酶解进程的推进,纤维素酶不断地将银杏叶细胞壁裂解,促使包藏在细胞壁中的总黄酮不断释放出来,提高了总黄酮提取效率[11]。
2.2 银杏叶提取物中黄酮种类的鉴定
银杏叶提取物中黄酮类物质的HPLC检测结果见图5。

由图5可以知,银杏叶提取物中黄酮苷的3个峰与槲皮素,山奈酚,异鼠李素3个峰出峰时间一致,可以判断为银杏叶提取物中黄酮类物质成分主要是槲皮素,山奈酚,异鼠李素及其相对应的衍生物。
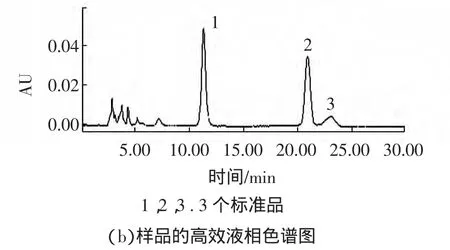
图5 黄酮的高效液相分析图谱Fig.5 The HPLC chromatogram of the flavonoid
3 结论
1)采用纤维素酶水解破壁,通过单因素试验和正交试验确定了纤维素酶水解破壁的最佳工艺为:酶解温度为45℃、酶处理pH为4、酶用量为0.3 mg/mL、酶解时间为2 h时,在此条件下,银杏叶总黄酮提取得率为2.80%,比空白对照组显著提高了45.83%。
2)通过比较银杏叶提取物和黄酮苷元对照品的高效液相图谱得出,银杏叶提取物中黄酮类物质主要是槲皮素、山奈酚和异鼠李素。
3)银杏叶粗提物中除了含有黄酮类物质之外,还含有大量的银杏内酯、银杏多糖、优质蛋白质等活性物质,可进一步探索银杏叶提取残渣内银杏内酯、银杏多糖和蛋白质的提取利用,以增加银杏叶的综合利用度。
[1] 柳闽生,陈晔,徐常龙.银杏叶有效成分的研究与资源的开发利用[J].江西林业科技,2006(2):28
[2] 李旭升,蒋磊,陈国荣,等.银杏叶提取物对糖尿病大鼠巨噬细胞脂质过氧化作用和一氧化氮水平的影响[J].中华内分泌代谢杂志,2005,21(1):79-80
[3]姚碧文,陈伟.银杏叶药理研究进展[J].浙江中西医结合杂志,2005,15(3):391-392
[4] 韩颂,徐颖,于喜水.纤维素酶在甘草提取工艺中的应用总结[J].中医药学报,2003,31(3):46
[5] Väljamäe P.The kinetics of cellulose enzymatic hydrolysis:implications of the synergism between enzymes[D].The Sweden:Uppsala U-niversity,2002
[6] 钟秋平,林美芳.黄皮果中总黄酮含量的测定及其黄酮种类的鉴别[J].食品科学,2007,28(8):411-414
[7] 董华强,宁正祥,崔志新,等.微波辅助提取多穗柯嫩叶黄酮工艺研究[J].农业工程学报,2007,23(2):213-217
[8] 王晖,刘佳佳.银杏黄酮的酶法提取工艺研究[J].林产化工通讯,2004(38):14-16
[9] 吴梅林.银杏叶中活性成分提取分离与测定研究[D].湖南:中南大学化学化工学院,2005
[10]李晓军.超生波辅助提取金银花黄酮类化合物的研究[D].陕西:陕西师范大学食品工程与营养科学学院,2009
[11]丁兴红,孙杰,喻治霞,等.纤维素酶辅助提取银杏叶总黄酮的工艺条件[J].林业科技开发,2009,23(4):66-68

