抗新型隐球菌荚膜相关蛋白CAP10单克隆抗体的制备及鉴定
于虹,王欣,,杨裔,陈万荣,郭彦,周育森,高基民 ,寇志华
1.军事医学科学院 微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071;2.温州医科大学检验医学与生命科学学院,浙江 温州 325035
随着临床上广谱抗生素、糖皮质激素、抗肿瘤药物、免疫抑制剂的应用,各种侵入性诊疗技术的开展及HIV-1感染人群的日益增多,深部真菌感染的发病率自20世纪80年代以来上升了3~5倍[1],在儿童中的感染报道也逐年增多[1-2]。真菌感染中以隐球菌感染最常见,其较高的病死率及呈上升趋势的发病率已引起临床医师高度重视。隐球菌属包括17个种和8个变种,其中新型隐球菌是主要的致病菌,包括新生隐球菌(Cryptococcus neoformans)和格特隐球菌(C.gattii)。
新型隐球菌的致病力主要由其细胞壁的多糖荚膜所介导,荚膜相关蛋白是荚膜的必需组分[3-4],包括CAP59[5]、CAP60[6]、CAP64[7]和 CAP10 等。继 CAP59、CAP60、CAP64之后,CAP10于1999年被发现并报道,其编码基因全长3150 bp,含3个内含子,表达产物为包含640个氨基酸残基的蛋白质,相对分子质量为73×103[8],定位于细胞质,是新型隐球菌侵袭力的重要因素,但其功能尚不十分清楚。生物信息学分析表明,CAP10的N端70~250残基(aa)为主要致病菌新型隐球菌(血清型A、D、AD)的保守性片段[8],在新型隐球菌感染诊断中可能具有重要的应用价值。因此,我们选择荚膜相关蛋白CAP10(70~250 aa)作为研制单抗的靶抗原,制备特异性抗CAP10抗体,同时对其进行鉴定,为临床新型隐球菌的检测和血清型分析奠定基础。
1 材料与方法
1.1 材料
6~8周龄BALB/c雌性小鼠由军事医学科学院实验动物中心提供;小鼠骨髓瘤细胞系Sp2/0为本室保存。HRP-山羊抗小鼠IgG购自北京中杉金桥公司;ELISA显色液A、B及终止液购自北京万泰生物制药公司;弗氏佐剂、免疫球蛋白标准亚类鉴定试剂盒购自Sigma公司;PEG-1500购自Roche公司;HAT培养基、HT培养基、DMEM培养基、RPMI-1640培养基均购自北京钮因华信科技发展有限公司。
1.2 重组蛋白的制备与纯化
[9]的方法,以IPTG诱导表达新型隐球菌抗原表位集中且保守性好的CAP10 70~250 aa片段(为与全长蛋白相区分,命名为CAP10-1),经镍柱纯化、复性,测定浓度后保存于-20°C备用
1.3 动物免疫
取纯化的重组蛋白与弗氏佐剂等体积混合、乳化,皮下注射途径免疫6只6~8周龄BALB/c雌性小鼠,10 μg/只,共免疫3次,每次间隔2周,首次免疫使用弗氏完全佐剂,加强免疫使用弗氏不完全佐剂,融合前3 d用无佐剂纯化蛋白10 μg加强免疫一次。首次免疫前和每次免疫后2周于尾静脉取血分离血清,-70℃冻存,分别作为阴性对照和每次抗体效价检测的血清标本,用ELISA方法检测血清抗体的效价。
1.4 杂交瘤细胞的融合及筛选
参考文献[10]的方法进行杂交瘤细胞融合与筛选。简言之,无菌条件下取免疫小鼠脾脏,制备脾细胞悬液,用PEG-1500按常规方法与Sp2/0骨髓瘤细胞融合,用含HAT的1640完全培养基置37℃ 5%CO2的培养箱中;第4 d换液,7~10 d后以ELISA方法检测培养上清有无抗体产生,筛选阳性孔;进一步采用有限稀释法对阳性克隆进行连续3次的亚克隆,每次亚克隆采用含HT的1640培养基培养7~10 d,筛选出稳定、高水平表达特异性单克隆抗体的杂交瘤细胞株。
1.5 腹水制备及效价测定
筛选出的高表达阳性细胞经扩大培养,收集细胞,用生理盐水洗涤3次,并配制1×106/mL细胞悬液,腹腔接种于事先用石蜡油致敏的BALB/c雌性小鼠,0.5 mL/只,10~12 d 后开始采集腹水并离心分离,置-20℃保存;用纯化的重组CAP10-1包被,采用间接ELISA法检测腹水中的抗体效价。
1.6 单克隆抗体特异性鉴定
应用ELISA方法,分别用重组CAP10-1、大肠杆菌裂解蛋白、商品化的荚膜相关蛋白CAP59等抗原进行包被,以测定所制备单抗的特异性。以无关单抗腹水为阴性对照,HRP-山羊抗小鼠IgG为二抗,测定D450nm值,以D450nm≥2倍对照组D450nm平均值判断为阳性。
1.7 单克隆抗体亚类鉴定
用Sigma公司的免疫球蛋白标准亚类鉴定试剂盒经间接ELISA鉴定制备的单克隆抗体的抗体亚类。以纯化后的重组CAP10-1为靶抗原,一抗为杂交瘤细胞上清,二抗为IgG亚类鉴定试剂盒里的酶标抗体(IgG1、IgG2a、IgG2b、IgG3、IgA、IgM、lambda、kappa),测定D450nm值。
1.8 酶联免疫法(ELISA)
用纯化的CAP10-1以终浓度2 mg/mL包被酶标板(Corning公司),50 μL/孔,置4℃过夜,次日用含10%小牛血清和0.05%Tween-20的PBS于37℃封闭1 h,用PBST(含0.05%Tween-20的PBS)洗涤3次后加入稀释至一定浓度的样品(血清、细胞培养上清和腹水),50 μL/孔,37℃孵育1 h,洗涤3次后加入1∶5000稀释的HRP-山羊抗小鼠IgG,37℃孵育1 h,用PBST洗涤5次后TMB显色,判断结果。以D450nm≥2倍阴性对照D450nm平均值判断为阳性。
2 结果
2.1 BALB/c小鼠免疫后抗CAP10抗体的效价
按照前述方法免疫小鼠,初免前和加强免疫后2周自尾静脉取血分离血清,进行间接ELISA检测。从1∶4000进行倍比稀释,结果见图1,加强免疫后血清抗体效价大于50万。
2.2 杂交瘤细胞融合与单克隆抗体细胞株的筛选
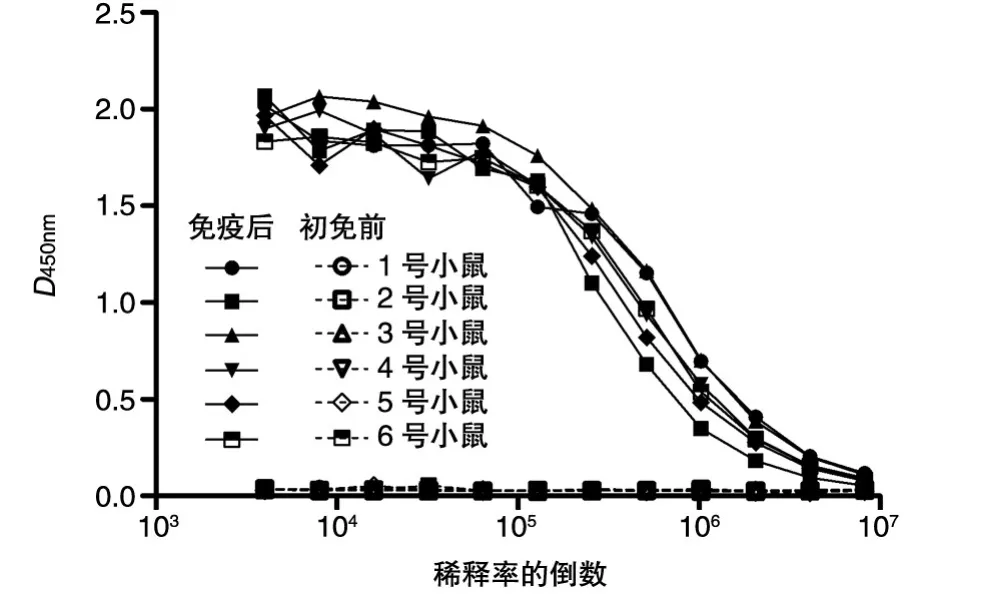
图1 ELISA检测重组Cap10-1免疫小鼠后血清抗体效价
选取血清抗体效价最高的1号小鼠制备脾细胞,将制备的脾细胞与骨髓瘤细胞融合,3 d后观察细胞融合效果;10 d后取上清液以间接ELISA进行筛选,以纯化的重组蛋白为靶抗原,挑选抗体效价高且单细胞集落的细胞株,共22株;将筛选的22株细胞株扩大培养,采用间接ELISA筛选D450nm值较高且为单细胞集落的细胞株,共15株;将此15株细胞株再次亚克隆,进行单细胞集落筛选,得到11株高特异分泌抗CAP10-1单克隆抗体的杂交瘤细胞株,分别命名为抗CAP10-mAb-1~CAP10-mAb-11。11株细胞株经扩大培养,冻存于-80℃备用。
2.3 杂交瘤细胞培养上清效价的检测
采用间接ELISA,用纯化的重组蛋白包被,一抗为对11株杂交瘤细胞株进行培养所收集的上清,二抗为HRP-山羊抗小鼠IgG,测定杂交瘤细胞上清的抗体效价,结果如图2,11株杂交瘤细胞株培养上清抗体效价最低为1280,最高大于40 960。
2.4 单克隆抗体的亚类鉴定
采用间接ELISA对筛选的11株细胞株进行亚型分析,用纯化蛋白包被,以细胞培养上清为一抗,IgG亚类鉴定的酶标为二抗。结果表明,制备的11株单抗均为IgG1亚型,轻链均为κ链。
2.5 抗CAP10单克隆抗体小鼠腹水的制备及抗体效价测定
将高表达的11株单克隆抗体细胞扩大培养后接种于BALB/c小鼠腹腔,10~12 d后收集腹水,离心取上清,按1∶2000进行倍比稀释后,用间接ELISA检测腹水中的抗体效价,结果如图3,11株单抗的效价均大于500 000。
2.6 抗体特异性鉴定
分别以纯化的重组CAP10-1、大肠杆菌裂解蛋白和商品化荚膜相关蛋白CAP59为对照抗原进行包被,采用间接ELISA对获得的11株单克隆抗体进行特异性检测,结果见图4,11株单克隆抗体均只与重组CAP10-1反应,与其他蛋白无交叉反应。表明制备的单克隆抗体是针对荚膜相关蛋白CAP10的特异性单抗。
3 讨论
CAP是新型隐球菌入侵人体、抵抗免疫系统、防御宿主清除的重要成分,是新型隐球菌重要的毒力分子,但其作用机制尚未完全揭示[3-7]。深入研究CAP的结构、功能及其与隐球菌致病力的关系,有助于了解新型隐球菌的致病机制,为隐球菌病的治疗提供新的思路,同时也为隐球菌病的诊断及转归提供评价指标。制备高效价的抗体是检测新基因表达和研究新基因功能的前提,目前国内外尚无CAP10蛋白单克隆抗体制备的报道。研制高效、特异的抗CAP10的单克隆抗体,不但有助于进一步探讨其功能,对新型隐球菌的临床诊断和血清分型也具有重要意义。
与多克隆抗体相比,单克隆抗体具有纯度高、特异性强的特点,是研究病原体致病机制、诊断和治疗的重要工具。我们采用体内诱生方法制备单克隆抗体,用纯化的CAP10免疫BALB/c小鼠,当小鼠抗体效价达到适当水平时,经ELISA检测选取血清抗体效价最高的小鼠,取其脾细胞与小鼠骨髓瘤Sp2/0细胞融合[10]。小鼠骨髓瘤细胞Sp2/0是经8-氮杂鸟嘌呤(8-azagunine,8-AG)诱导产生的,缺乏次黄嘌呤-鸟嘌呤磷酸核糖转移酶(HGPRT),利于融合细胞的筛选,且本身不分泌IgG链,有利于抗体同种型的鉴定。目前用于诱导细胞融合的方法有病毒、化学试剂及电脉冲,其中聚乙二醇(PEG)为常用的诱导细胞融合的化学因子。PEG的相对分子质量和浓度是影响融合效率的重要因素,一般在融合过程中选择相对分子质量为1000~4000的PEG,浓度为30%~50%时均可获得最佳融合效果。但PEG可使细胞膜产生不稳定性,有一定的毒性。本研究选取PEG-1500诱导融合因子,结果表明其融合率可达100%。

图2 杂交瘤细胞上清效价检测

图3 腹水抗体效价测定
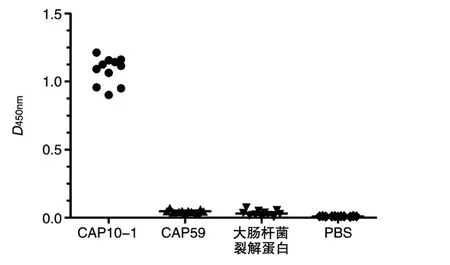
图4 11株单抗的特异性分析
融合后,杂交瘤细胞因为染色体数较正常多一倍,细胞状态不稳定,在瘤细胞分裂时染色体的分配不平衡,可能会造成杂交瘤细胞在增殖过程中抗体分泌能力的丢失。为获得稳定表达的单克隆抗体杂交瘤细胞,我们采用2次亚克隆的方法。首先,用间接ELISA检测第一次融合的细胞上清,选择D450nm值较高且培养孔中为单个细胞集落的杂交瘤细胞进行亚克隆,从阳性分泌孔收集杂交瘤细胞,采用有限稀释法使每孔只有一个细胞[11]。然后,对阳性分泌孔进行2次亚克隆,收集杂交瘤细胞,经逐步稀释,最后得到了11株稳定分泌高特异性抗CAP10单克隆抗体的杂交瘤细胞株。随后,将11株杂交瘤细胞于腹腔注射BALB/c小鼠,获得了含有单克隆抗体的腹水,间接ELISA检测结果显示每株单抗腹水的效价大于50万,亚型鉴定表明11株杂交瘤细胞株都为IgG1,轻链为κ型[12],而且11株单抗仅与重组CAP10-1特异性结合,与其他抗原无交叉反应,说明针对该片段的单克隆抗体可用于新型隐球菌的致病机制研究,并可能用于新型隐球菌的检测和分型。抗CAP10单克隆抗体的制备,为深入研究CAP10的生物学功能,建立新型隐球菌感染的诊断方法奠定了基础。
参考文献
[1] Lakshmi V,Sudha T,Teja V D,et al.Prevalence of central nervous system cryptococcosis in human immunodeficiency vi⁃rus reactive hospitalized patients[J].Indian J Med Micribiol,2007,25(2):146-149.
[2] Fernández-Concepción O,Ariosa-Acuña M C,Giroud-Benítez J L,et al.Cryptoeoeeosis of the central nervous system.A re⁃port of five cases[J].Rev Neurol,2000,30(10):935-938.
[3] Chang Y C,Kwon-Chung K J.Complementation of a capsuledeficient mutation of Cyrptoeoceus neoformans restoresitsvirule⁃nee[J].Mol Cell Biol,1994,14(7):4912-4919.
[4] Cherniak R,Sundstorm J B.Polysaccharide antigens of the capsule of Cryptococcus neoformans[J].Infect Immun,1994,62(5):1507-1512.
[5] Chang Y C,Wickes B L,Kwon-Chung K J.Further analysis of the CAP59 locus of Cryptococcus neoformans:structure de⁃fined by forced expression and description of a new ribosom⁃al protein-encoding gene[J].Gene,1995,167(1-2):179-183.
[6] Chang Y C,Penoyer L A,Kwon-Chung K J.The second cap⁃sulegeneofCryptococcusneoformans,CAP64,isessential for virulence[J].Infect Immun,1996,64(6):1977-1983.
[7] Chang Y C,Kwon-Chung K J.Isolation of the third capsuleassociated gene,CAP60,required for virulence in Cryptococ⁃cus neoformans[J].Infect Immunol,1998,66(5):2230-2236.
[8] Chang Y C,Kwon-Chung K J.Isolation,characterization,and localization of a capsule-associated gene,CAP10 of Cryptococ⁃cus neoformans[J].J Bacteriol,1999,181(18):5636-5643.
[9] 王欣,于虹,佟双,等.新型隐球菌Cap10蛋白的重组表达及多克隆抗体制备[J].中国卫生检验杂志,2012,22(6):1229-1231.
[10]于虹,管洁,赵光宇,等.人高致病性禽流感H5N1病毒M2蛋白单克隆抗体的制备及鉴定[J].中国卫生检验杂志,2007,35(2):84-86.
[11]Ibánez M D,Garde J M.Allergy in patients under fourteen years of age in Alergológica 2005[J].J Investig Allergol Clin Immunol,2009,2:61-68.
[12]潘华政,黄湘,王穗海,等.抗STARD7单克隆抗体的制备及鉴定[J].热带医学杂志,2008,8(1):1-3.

