中东呼吸综合征冠状病毒假病毒系统的建立及其在中和抗体检测中的应用
李琳,郭彦,赵光宇,于虹,孙世惠,潘婷,唐健,周育森,樊卫平
1.山西医科大学 微生物与免疫学教研室,山西 太原 030001;2.军事医学科学院 微生物流行病研究所,病原生物学国家重点实验室,北京 100071
中东呼吸综合征冠状病毒(Middle East respira⁃tory syndrome coronavirus,MERS-CoV)是一种新型冠状病毒[1],它可以使感染者出现急性、严重呼吸道疾病,伴有发热、咳嗽、气短及呼吸困难,部分病例出现肾功能衰竭和死亡[2-3],是一种高致病性病毒。活病毒中和试验一直是检测血清抗体中和活性、评价抗体抗病毒作用的重要方法。但高致病性病毒的活病毒中和试验需要高等级生物安全实验条件,对实验条件和人员素质提出了更高的要求,增加了实验实施的难度和成本。为了克服MERS-CoV活病毒感染和中和试验在安全、效率等方面存在的诸多困难和不便,我们建立了一种MERS假病毒系统,并应用于抗体中和活性检测的中和试验。为MERS-CoV疫苗与抗体评价及病毒致病机制研究提供一种安全、有效的技术手段。
1 材料与方法
1.1 材料
293T细胞、Huh-7细胞和COS-7细胞均由本室保存;大肠杆菌DH5α感受态细胞、质粒小量提取试剂盒和胶回收试剂盒均购自北京全式金公司;MERS-CoV S基因(GenBank:JX869059.2)由生工生物工程(上海)有限公司合成,合成基因的上游带有BamHⅠ酶切位点,下游顺序含有终止密码子和XhoⅠ酶切位点;缺少Env基因而表达萤光素酶的人类免疫缺陷病毒(HIV)骨架质粒pNL4-3.Luc.RE、表达水泡性口炎病毒(VSV)G蛋白的重组表达质粒pVSV-G 和载体质粒 pcDNA3.1 由本室保存[4];DNA连接酶购自TaKaRa公司;质粒去内毒素大量提取试剂盒购自天根公司;转染试剂TurboFect、限制性内切酶BamHⅠ和XhoⅠ均购自Thermo公司;细胞培养器材购自CORNING公司;DMEM细胞培养基、OMEM细胞培养基、胎牛血清、胰酶和青霉素链霉素抗生素均购自GIBCO公司;兔抗HIV-1 P24多抗和兔抗MERS-CoV S1多抗购自北京义翘神州生物技术有限公司;HRP标记的羊抗兔IgG抗体购自上海优宁维生物技术公司;萤光素酶底物购自Promega公司;对MERS-CoV具有中和活性的MERS-CoV受体结合区特异性小鼠血清、H5N1禽流感病毒HA抗原特异性小鼠血清和正常小鼠血清均经过受体破坏酶(RDE)处理和56℃、30 min补体灭活,由本室制备和保存[5-6]。
1.2 pMERS-S的质粒构建及扩增
载体质粒pcDNA3.1经BamHⅠ/XhoⅠ双酶切后与经相同酶切后回收的MERS-CoV S基因片段连接,构成重组质粒pMERS-S,转化大肠杆菌DH5α感受态细胞,经氨苄西林抗性筛选阳性克隆扩大培养,用去内毒素质粒大量提取试剂盒提取质粒备用。
1.3 假病毒的制备
将 pMERS-S 和 pNL4-3.Luc.RE 两种质粒各 20 μg逐滴加入4 mL OMEM培养基中,轻轻振荡后再逐滴加入80 μL TurboFect转染试剂,轻轻弹动管壁后室温静置15 min,将质粒与转染试剂的混合物逐滴加入293T细胞中,37℃、5%CO2培养6 h后将培养液弃去,换成新鲜DMEM培养基继续培养,72 h后收获含MERS假病毒(pMERS-S)的上清,6000 r/min离心15 min去除细胞碎片后将上清分装,-80℃保存。用同样方法,分别利用pVSV-G和pcDNA3.1质粒制备作为阳性对照和阴性对照的VSV假病毒(pVSV-G)和pcDNA3.1假病毒(pEnv-)。
1.4 Western印迹
将制备的含假病毒的培养上清用PEG6000浓缩至1/50后加入上样缓冲液,100℃处理10 min,进行SDS-PAGE(分别采用8%和12%SDS-PAGE检测假病毒中MERS-CoV S抗原和HIV-1 P24抗原的表达),电泳后按常规方法转膜(200 mA,150 min),转膜完成后,用脱脂牛奶(5 g/mL)常温封闭4 h,进行Western印迹,一抗为1 μg/mL兔抗MERS-CoV S1抗原或兔抗HIV-1 P24多抗,二抗为1∶5000稀释的HRP标记的羊抗兔IgG抗体,ECL化学发光法观察结果。
1.5 MERS假病毒的感染力测定
将4×105/mL的Huh-7细胞接种于96孔细胞培养板,100 μL/孔,37℃、5%CO2培养16 h,使细胞长成单层;加入梯度稀释的MERS假病毒,100 μL/孔,每个稀释度设置复孔;设置未加假病毒的空细胞对照,分别以VSV假病毒和pcDNA3.1假病毒作为阳性和阴性对照;37℃、5%CO2培养24 h后更换为新鲜培养基继续培养48 h,检测萤光素酶活性(相对光单位,RLU),以此反映MERS假病毒的感染力。
1.6 MERS假病毒中和试验
将4×105/mL Huh-7细胞接种于96孔细胞培养板,100 μL/孔,37℃、5%CO2培养16 h,使细胞长成单层;将血清从1∶40开始梯度稀释后与等体积的MERS假病毒(RLU=40000)混合,设置复孔,于37℃、5%CO2放置1 h;之后将血清-假病毒混合液接种于单层Huh-7细胞,同时设置未与血清混合的假病毒对照和只加培养基的空细胞对照,37℃、5%CO2培养24 h后更换为新鲜培养基继续培养48 h;检测萤光素酶活性(RLU),按照下式计算血清抗体中和百分率(%):

1.7 统计分析
利用GraphPad Prism软件,对MERS假病毒感染细胞的RLU值与假病毒量的相关性进行Pearson相关分析,P<0.05具有统计学意义。
2 结果
2.1 MERS假病毒(pMERS-S)的制备与鉴定
用BamHⅠ/XhoⅠ双酶切重组质粒pcDNA3.1-MERS-S,获得了与载体(5372 bp)和MERS-CoV S基因(4068 bp)大小相符的2条DNA条带(图1)。DNA测序进一步证实重组质粒pcDNA3.1-MERS-S中正确插入了MERS-CoV S基因。将pcDNA3.1-MERS-S与假病毒包装骨架质粒pNL4-3.Luc.RE共转染293T细胞,制备携带MERS-CoV S蛋白的假病毒(pMERS-S)。同时,分别以pVSV-G和pEnv-作为阳性和阴性对照。Western印迹检测结果表明,用HIV-1 P24抗体检测时,pMERS-S、pVSV-G 和pEnv-三种假病毒在相对分子质量25×103处均有条带,与预期大小相符(图2),表明利用HIV骨架质粒(pNL4-3.Luc.RE)成功包装出假病毒。当用MERSCoV S1特异性抗体检测时,只有pMERS-S在相对分子质量约180×103位置出现与预期大小相符的条带(图2),表明假病毒pMERS-S表达MERS-CoV S蛋白。

图1 重组质粒pcDNA3.1-MERS-S的酶切鉴定1:重组质粒pcDNA3.1-MERS-S经BamHⅠ/XhoⅠ双酶切;M:Trans 15k DNA marker
2.2 MERS假病毒(pMERS-S)的感染力测定
为了明确包装出的MERS假病毒能否感染含有MERS-CoV受体(二肽基肽酶4,DPP4)的细胞,用pMERS-S分别感染表达DPP4的Huh-7细胞和不表达DPP4的COS-7细胞。结果表明,pMERS-S对Huh-7细胞具有感染力,且假病毒的量与感染力呈量效关系(P<0.01,Pearson相关分析),随着pMERSS稀释度的增加,假病毒感染Huh-7细胞的RLU值逐渐下降。pMERS-S感染的COS-7细胞只检测出本底水平的荧光值。VSV对于Huh-7和COS-7细胞都具有感染力,而pVSV-G感染的这两种细胞均可检测出高水平荧光值。pEnv-因缺少跨膜蛋白而不感染Huh-7和COS-7细胞,只检测到本底水平的荧光值。见图3。
2.3 MERS假病毒中和试验
为了验证制备的MERS假病毒能否通过中和试验进行抗体中和活性的检测,利用已知对MERSCoV具有中和活性的小鼠血清进行假病毒中和试验,同时以正常小鼠血清和重组H5N1 HA抗原免疫小鼠血清为阴性对照。结果表明,对MERS-CoV具有中和活性的血清通过MERS假病毒中和试验同样检测出中和活性,并且随着血清稀释度的增加,其对MERS假病毒的中和作用逐渐下降,而2种阴性对照血清对MERS假病毒并无中和作用(图4)。表明制备的pMERS-S可用于假病毒中和试验来检测血清抗体的中和活性。
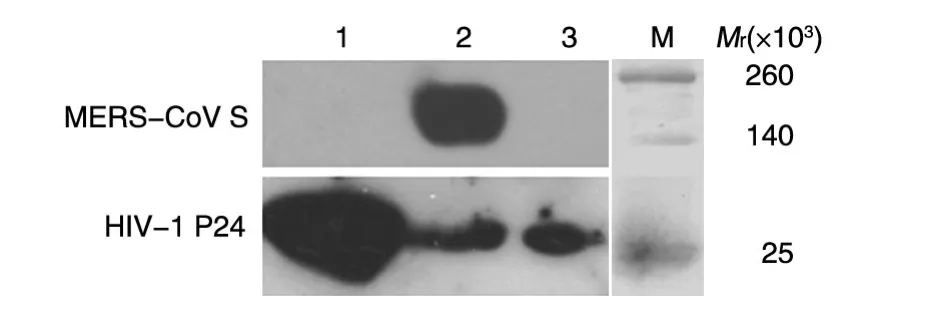
图2 假病毒的Western印迹1:pEnv-;2:pMERS-S;3:pVSV-G;M:蛋白marker

图3 假病毒对不同细胞系的感染力

图4 假病毒中和试验检测结果
3 讨论
MERS-CoV是继SARS-CoV之后出现的又一种对人类具有高致病性的冠状病毒[7]。截至2013年7月,已累计感染70人,病死率为55.7%[8]。由于该病毒对人类的致病性强、病死率高,并且已出现了有限的人际传播感染[9],因此,预防与治疗手段的研究对于防控MERS疫情具有重要意义,而用于预防与治疗效果评价的技术和手段具有重要的支撑作用。中和试验一直是评价抗体抗病毒作用的重要方法,但利用MERS-CoV的活病毒开展中和试验需要生物安全3级实验室(BSL-3),并且对实验人员的生物安全操作素质要求很高。这无疑增加了试验的风险和成本。MERS假病毒颗粒由于只具有一次感染能力而无复制能力,应用于血清中和抗体的检测并不需要BSL-3的实验条件,极大地降低了实验操作的风险,提高了效率。
假病毒体系的构建主要包括以反转录病毒载体和以慢病毒载体为基础的2种方式,目前最常用的是以慢病毒载体为基础的假病毒构建体系。我们利用 HIV-1 骨架质粒 pNL4-3.Luc.RE,通过与携带MERS-CoV S基因的质粒共转染细胞,获得只具有一次感染能力而无复制能力的MERS-CoV假病毒颗粒。由于pNL4-3.Luc.RE骨架质粒中HIV-1基因缺乏Env基因,假病毒的包膜蛋白需要由另一质粒上的MERS-CoV S基因表达来提供,因此,MERS假病毒颗粒的感染性受其S蛋白识别受体的限制。本研究制备的MERS假病毒能很好地感染含MERS-CoV受体的Huh-7细胞,但对于无DPP4表达的COS-7细胞就不具有感染性,而目前已知MERS-CoV正是利用DPP4作为它进入宿主细胞的受体[10]。在假病毒中和试验中,MERS假病毒能被中和抗体有效中和而失去对宿主细胞的感染作用。本研究使用的中和抗体不仅具有活病毒中和试验证实的中和活性,而且已知对MERS-CoV S蛋白受体结合区具有特异性。这进一步说明,MERS假病毒颗粒所携带的S包膜蛋白与MERS-CoV S蛋白一样具有介导病毒感染的作用。而这种病毒受体识别特性,使MERS假病毒不仅可用于疫苗诱导中和抗体能力和抗体抗病毒效果的评价,也可用于病毒受体相关致病机制的研究。因此,本研究建立的MERS假病毒系统是一种对MERS-CoV疫苗、药物及致病机制研究具有良好支撑作用的技术手段。
[1] Al-Ahdal M N,Al-Qahtani A A,Rubino S.Coronavirus respi⁃ratory illness in Saudi Arabia[J].J Infect Dev Ctries,2012,6(10):692-694.
[2] Zaki A M,van Boheemen S,Bestebroer T M,et al.Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia[J].N Engl J Med,2012,367(19):1814-1820.
[3] Bermingham A,Chand M A,Brown C S,et al.Severe respira⁃tory illness caused by a novel coronavirus,in a patient trans⁃ferred to the United Kingdom from the Middle East,Septem⁃ber 2012[J].Eur Surveill,2012,17(40):20290.
[4] Du L,Zhao G,Zhang X,et al.Development of a safe and convenient neutralization assay for rapid screening of influen⁃za HA-specific neutralizing monoclonal antibodies[J].Biochem Biophys Res Commun,2010,397(3):580-585.
[5] Du L,Zhao G,Kou Z,et al.Identification of a receptor-bind⁃ing domain in the s protein of the novel human coronavirus Middle East respiratory syndrome coronavirus as an essential target for vaccine development[J].J Virol,2013,87(17):9939-9942.
[6] Du L,Zhao G,Sun S,et al.A critical HA1 neutralizing do⁃main of H5N1 influenza in an optimal conformation induces strong cross-protection[J].PLoS One,2013,8(1):e53568.
[7] Pebody R,Zambon M,Watson J M.Novel coronavirus:how much of a threat?We know the questions to ask;we don't yet have many answers[J].Br Med J,2013,346:f1301.
[8] Qian Z,Dominguez S R,Holmes K V.Role of the spike gly⁃coprotein of human Middle East respiratory syndrome coronavi⁃rus(MERS-CoV)in virus entry and syncytia formation[J].PLoS One,2013,8(10):e76469.
[9] Chan J F,Lau S K,Woo P C.The emerging novel Middle East respiratory syndrome coronavirus:the"knowns"and"un⁃knowns"[J].J Formos Med Assoc,2013,112(7):372-381.
[10]Raj V S,Mou H,Smits S L,et al.Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC[J].Nature,2013,495(7440):251-254.

