微小染色体维系蛋白3基因在斑马鱼早期胚胎发育过程中的表达
刘瑞瑾,吴新荣
广州军区 广州总医院,广东 广州 510010
微小染色体维系蛋白3(minichromosome main⁃tenance 3,MCM3)作为MCM家族的重要一员,与生物体DNA复制过程密切相关。细胞周期过程中基因组的复制调控对生物体具有重大意义,在真核生物DNA起始复制点,预复制复合物(prereplication complex,pre-RC)的形成和破坏是调控染色体被“许可”进入 S 期的关键因子[1-3]。MCM(MCM2~MCM7)是组成pre-RC的蛋白之一,具有保持与维系微小染色体的功能,保证染色体进入复制状态[4]。目前,对啤酒酵母和哺乳动物中MCM3的研究较多。MCM3在哺乳动物细胞中的表达相对稳定,但在进入G0期和分化终止的组织中迅速消失,这些特点使其成为正常组织增殖细胞的标记之一[5-6]。虽然MCM3在正常的增殖细胞中表达,但在肿瘤细胞中,MCM3的表达水平相对高于正常组织。Ha等[7]确证,MCM3在几种人类肿瘤中过度表达。MCM3作为一种细胞DNA复制过程的特许因子,可作为标记物直接反映细胞的增殖状态,对于因细胞周期调节失常、失去控制后产生的不典型增生和肿瘤的诊断及预后都有非常重要的指导意义。斑马鱼具有产卵量高,胚胎体外发育、透明易于观察,有较完善的胚胎和遗传学操作技术,品系资源丰富等优点,已被作为一种重要的模式生物广泛应用于发育生物学、遗传学、药物学等方面的研究。通过序列比对和进化树分析,发现斑马鱼的MCM3与小鼠、人高度同源。整胚原位杂交技术是研究斑马鱼发育相关基因的功能和表达模式的一种重要手段。我们通过整胚原位杂交方法分析了MCM3的mRNA在斑马鱼早期胚胎发育过程的表达情况,为深入研究这一基因的功能提供基础依据。
1 材料与方法
1.1 材料
斑马鱼为Tubingen野生型;感受态大肠杆菌DH5α由本室保存;TRIzol RNA提取试剂盒购自In⁃vitrogen公司;PrimeScript RT-PCR试剂盒、Taq DNA聚合酶、DNA ladder、限制性内切酶及SP6 RNA聚合酶购自TaKaRa公司;Dig RNA Labeling Mix购自Roche公司;pGM-T克隆试剂盒、质粒提取试剂盒及DNA纯化试剂盒购自TIANGEN公司;显微操纵仪(Olympus SZX7);台式高速低温离心机(Backman);紫外/可见光分光光度计(DU530,Back⁃man);PCR 扩增仪(PE9600);凝胶成像分析系统(EDAS120,KODAK);多功能恒温恒压恒流电泳系统(Pharmacia);SPX生化培养箱。
1.2 PCR引物设计
在NCBI网站上查得MCM3的cDNA序列,用Primer Premier 5.0软件设计正义引物(5'-TACGC⁃CAAGCAATGTGAG-3')和 反 义 引 物(5'-ATAG⁃CAGTGCGGTCCATA-3'),扩增片段长508 bp,引物由华大基因公司合成。
1.3 总RNA提取
收集受精后24 h(24 hpf)时期的Tubingen野生型斑马鱼胚胎,脱膜后用TRIzol液溶解,按照TRIzol RNA提取试剂盒说明书操作,-70℃保存。
1.4 RT-PCR扩增
按照PrimeScript RT-PCR试剂盒说明书将总RNA反转录成cDNA;以此cDNA为模板进行扩增(95℃预变性5 min,95℃变性10 s,56℃退火15 s,72℃延伸60 s,72℃延伸3 min,35个循环),琼脂糖凝胶电泳鉴定,用琼脂糖凝胶DNA回收试剂盒回收扩增的目的基因。
1.5 PCR产物克隆
将回收纯化的DNA片段连接到T easy载体上,42℃热激法转化感受态大肠杆菌DH5α,经氨苄西林抗性筛选重组质粒克隆,菌落PCR鉴定有目的基因的重组质粒送华大基因公司测序。
1.6 RNA探针合成及纯化
将纯化的MCM3重组质粒用ApaⅠ酶切线性化,异丙醇纯化,经体外SP6转录体系转录,同时加入地高辛(DIG)标记的寡核苷酸,转录得到DIG-XOX-1反义mRNA探针,-70℃保存。
1.7 斑马鱼整胚原位杂交
参照文献[8]收集固定斑马鱼胚胎并进行整胚原位杂交,在解剖显微镜白场下观察并拍照。
2 结果
2.1 小鼠、人和斑马鱼MCM3的同源性分析
根据已报道的斑马鱼、小鼠、人的MCM3氨基酸序列,用CLC Sequence Viewer 6.1软件构建系统进化树,结果发现斑马鱼的MCM3氨基酸序列与小鼠、人高度同源,表明斑马鱼MCM3的功能可能与人相近(图1)。
2.2 RT-PCR扩增MCM3基因片段
RT-PCR扩增MCM3基因片段,用1%琼脂糖凝胶电泳鉴定PCR产物,在500 bp附近呈现单一条带,大小与预期相符(图2)。
2.3 斑马鱼整胚原位杂交
解剖镜下观察MCM3在斑马鱼胚胎不同时期的表达。胚胎受精后0~12 h,MCM3在增殖性区域泛表达,表明这一时期的胚胎细胞普遍快速增殖,受精后10和12 h,体节和神经系统分别出现;受精后14~22 h,在中枢神经系统、发育未成熟的眼部、体节及增殖性区域表达;受精后24 h,在血液、中枢神经、翼板中脑、视觉盖及增殖性区域表达,并呈现表达逐渐减弱,说明这时胚胎的细胞增殖速度已相对减慢;受精后48 h,在头部及肛门增殖性区域表达(图3)。

图1 小鼠、人和斑马鱼MCM3系统进化树图谱
3 讨论

图2 MCM3基因片段的PCR扩增结果M:100 bp DNA ladder;1:MCM3基因片段的PCR扩增产物
真核生物DNA复制通过适当的调节以确保染色体在一个细胞周期中复制一次。真核细胞DNA复制是由复制点开始的,起始复制涉及许多蛋白复合体。在G1期,起始复制复合体上结合有起始识别复合体(origin recognition complex,ORC),其作用就像一个停泊点,供其他调节因子停靠,从而使染色体被“许可”进入S期。CDC6和CDT1是结合在ORC上的调节因子,其功能是促进由6个亚单位构成的MCM复合体和其他一些蛋白结合到ORC,形成pre-RC。MCM具有保持与维系微小染色体的功能,而ORC、CDC6和MCM在pre-RC的聚合保证了染色体进入复制状态[9]。
斑马鱼早期发育过程中细胞快速分裂和增殖,受精后约50 min完成第一次有丝分裂,之后约每间隔15 min分裂一次。以上研究表明,MCM3的表达与胚胎细胞的增殖呈明显的相关性。作为一种在细胞DNA复制过程中的特许因子,MCM3在斑马鱼体内可被选为标记物,直接反映细胞的增殖状态。
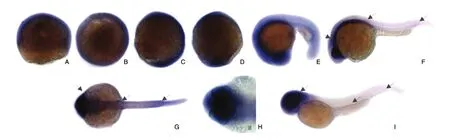
图3 斑马鱼MCM3基因的原位杂交表达图谱
[1] Blow J J.Control of chromosomal DNA replication in the ear⁃ly Xenopus embryo[J].EMBO J,2001,20(13):3293-3297.
[2] Donaldson A D,Blow J J.The regulation of replication origin activation[J].Curr Opin Genet Dev,1999,1(9):62-68.
[3] Diffley J F X,Labib K.The chromosome replication cycle[J].Cell Sci,2002,115:869-872.
[4] Tye B K.MCM proteins in DNA replication[J].Biochemistry,1999,68:649-686.
[5] Musahl C,Holthoff H P,Lesch R,et al.Stability of the repli⁃cative Mcm3 protein in proliferating and differentiating human cells[J].Exp Cell Res,1998,241(1):260-264.
[6] Madine M A,Swietlik M,Pelizon C,et al.The roles of the MCM,ORC,and Cdc6 proteins in determining the replication competence ofchromatin in quiescentcells[J].StructBiol,2000,129:198-210.
[7] Ha S A,Shin S M,Nam K H,et al.Cancer associated ex⁃pression of minichromosome maintenance3 gene in several human cancers and its involvement in tumorigenesis[J].Clin Cancer Res,2004,10(24):8386-8395.
[8] Nusslein-Volhard C,Dahm R.Zebrafish:a practical approach[M].New York:OxfordUniversity Press,2002:261-263.
[9] Sun W H,Coleman T R,De Pamphilis M L.Cell cycle de⁃pendent regulation of the association betw een origin recogni⁃tion proteins and somatic cell chromatin[J].EMBO J,2002,21(6):1437-1446.
[10]Patton E,Zon L I.Taking human cancer genes to the fish:a transgenic model of melanoma in zebrafish[J].Zebrafish,c2005,1(4):363-368.
[11]Chen E Y,Langenau D M.Zebrafish models of rhabdomyosar⁃coma[J].Methods Cell Biol,2011,105:383-402.
[12]Leacock S W,Basse A N,Chandler G L,et al.A zebrafish transgenic model of Ewing's sarcoma reveals conserved media⁃tors of EWS-FLI1 tumorigenesis[J].Dis Model Mech,2012,5(1):95-106.
[13]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285:1182-1186.
[14]Cross L M,Cook M A,Lin S,et al.Rapid analysis of angio⁃genesis drugs in a live fluorescent zebrafish assay[J].Arterio⁃scler Thromb Vasc Biol,2003,23(5):911-912.
[15]Dahm R,Geisler R.Learning from small fry:the zebrafish as a genetic model organism for aquaculture fish species[J].Mar Biotechnol,2006,8(4):329-345.
[16]Chun K H,Kosmeder J W,Sun S,et al.Effects of deguelin on the phosphatidylinositol 3-kinase/Akt pathway and apopto⁃sis in premalignant human bronchial epithelial cells[J].J Natl Cancer Inst,2003,95(4):291-302.
[17]Murillo G,Kosmeder J W 2nd,Pezzuto J M,et al.Deguelin suppresses the formation of carcinogen-induced aberrant crypt foci in the colon of CF-1 mice[J].Int J Cancer,2003,104(1):7-11.
[18]Oh S H,Woo J K,Yazici Y D,et al.Structural basis for de⁃pletion of heat shock protein 90 client proteins by deguelin[J].J Natl Cancer Inst,2007,99(12):949-961.
[19]Chun K H,Kosmeder J W 2nd,Sun S,et al.Effects of deg⁃uelin on the phosphatidylinositol 3-kinase/Akt pa thway and apoptosis in premalignant human bronchial epithelial cell[J].J Natl Cancer Inst,2003,95(4):291-302.
[20]Geeraerts B,Vanhoecke B,Vanden Berghe W,et al.Degue⁃lin inhibits expression of IkappaBalpha protein and induces apoptosis of B-CLL cells in vitro[J].Leukemia,2007,21(8):1610-1618.
[21]Lee H Y,Suh Y A,Kosmeder J W,et al.Deguelin-induced inhibition of cyclooxygenase-2 epression in human bronchial epithelial cells[J].Clin Cancer Res,2004,10(3):1074-1079.
[22]Dell'Eva R,Ambrosini C,Minghelli S,et al.The Akt inhibi⁃tor deguelin,is an angiopreventive agent also acting on the NF-kappaB pathway[J].Carcinogenesis,2007,28(2):404-413.

