重组人VEGF可溶性受体的表达纯化及结合性质初探
李伊培,高丽华,张连成,邵勇,刘羽 ,潘芸 ,高招刚,张嵘,胡显文,陈惠鹏
1.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;2.军事医学科学院 生物工程研究所,北京100071;3.安徽大学 生命科学学院,安徽 合肥 230601
1971年,Forkman提出了肿瘤生长、转移依赖新 血管生成的概念[1]。在已知的促血管生成因子中,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是最重要的肿瘤治疗靶点,VEGF家族主要包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、PIGF等,VEGF受体(VEGFR)主要包括VEGFR1(Flt-1)、VEGFR2(KDR/Flk-1)、VEGFR3(Flt-4)、Neuropilin-1(Nrp-1)、Neuropilin-2(Nrp-2)等[2]。
VEGF家族中,VEGF-A是最主要的血管生成促进因子,结合并激活VEGFR1、VEGFR2。VEGFR1与VEGF-A结合的主要部位是胞外区的第2个类免疫球蛋白结构域(the second Ig-like domain of VEGFR1,VEGFR1D2)[3]。VEGFR1与VEGF-A有极高的亲和力(Kd=1~10 pmol/L),是VEGF的诱捕性受体,但其酪氨酸激酶活性只有VEGFR2的约1/10[2]。VEGFR2主要通过胞外区的第2、第3个类免疫球蛋白结构域(the second and third Ig-like domains of VEGFR2,VEGFR2D2D3)与VEGF-A结合[3],主要的血管生成信号均为VEGFR2被激活后产生的。因此,尽管其与VEGF-A的亲和力远不如VEGFR1,但VEGF-A激活静止的内皮细胞,促进细胞增殖、迁移和增加血管通透性等作用主要通过激活VEGFR2完成[2]。
此外,VEGFR1还与VEGF-B结合,VEGFR2还与VEGF-C、VEGF-D结合。VEGF-C与VEGF-D则主要与VEGFR-3结合,介导肿瘤的淋巴管生成和淋巴转移[2]。
在本研究中,我们将VEGFR1D2和VEGFR2D3基因进行了优化,并加入Linker区基因片段,与人IgG1 Fc片段相连,构建融合蛋白真核表达载体pIRES2-EGFP-VEGF-Trap2,稳定转染CHO-K1细胞,通过加压筛选阳性克隆获得稳定高表达目的蛋白的细胞株,并从细胞上清中纯化获得目的蛋白VEGF-Trap2进行后续性质鉴定。本研究旨在获得更加优化的VEGF-Trap,使其与VEGF有较高的亲和力,有效阻断VEGF途径介导的肿瘤血管生成,抑制血管内皮细胞及相关肿瘤细胞的增值、迁移、黏附,同时使肿瘤血管内皮细胞和周细胞凋亡,为研发更有效的抗肿瘤血管生成药物奠定基础。
1 材料与方法
1.1 材料
感受态大肠杆菌Top10购自北京全式金公司;CHO-K1细胞、真核表达载体pIRES2-EGFP-Fc、阳性对照蛋白VEGF-Trap1由本室保存;优化的目的基因VEGFR1D2/R2D3由南京金斯瑞生物科技有限公司合成;PCR引物由Invitrogen公司合成;DNA聚合酶、限制性内切酶(BamHⅠ、NheⅠ)、T4DNA连接酶购自New England Biolabs公司;琼脂糖凝胶产物回收试剂盒、质粒抽提试剂盒购自北京天根生化科技有限公司;200 bp DNA ladder购自上海近岸蛋白科技有限公司;细胞转染试剂LipofectAMINE 2000购自Invitrogen公司;无血清培养基DMEM/F-12(1∶1)购自Hyclone公司;小牛血清购自杭州四季青生物技术公司;OPTI-MEM培养基、G418购自Gibco公司;Mab Select Protein A亲和填料购自GE公司;蛋白PageRuler购自Fermentas公司;可溶性hVEGF165重组表达蛋白购自上海近岸蛋白科技有限公司;辣根过氧化物酶(HRP)标记的山羊抗人IgG抗体购自北京中杉金桥生物技术有限公司;TMB显色液购自北京万泰生物药业股份有限公司;所有测序工作由Invitrogen公司完成。
1.2 真核表达载体pIRES2-EGFP-VEGF-Trap2的构建
优化的VEGFR1D2/R2D3基因两端分别带有BamHⅠ和NheⅠ酶切位点,连接于pUC57质粒。用BamHⅠ/NheⅠ同时对该质粒和含有人IgG1 Fc片段的空载体pIRES2-EGFP-Fc进行双酶切,12 g/L琼脂糖凝胶电泳鉴定后回收酶切产物,用T4DNA连接酶连接上述酶切产物,命名为pIRES2-EGFPVEGF-Trap2;连接产物转化感受态大肠杆菌TOP10,经菌落PCR、双酶切验证、基因测序结果比对正确后,用试剂盒抽提重组质粒。
1.3 细胞培养及脂质体介导的pIRES2-EGFPVEGF-Trap2转染CHO-K1细胞
CHO-K1细胞用含5%小牛血清的DMEM/F-12(1∶1)完全培养基培养,置37℃、5%CO2细胞培养箱中。转染前将CHO-K1细胞接种于24孔板,待生长至90%汇合时,按脂质体转染试剂LipofectAMINE 2000操作说明,将重组质粒pIRES2-EGFP-VEGFTrap2转染至CHO-K1细胞。
1.4 筛选高表达阳性克隆
转染48 h后将细胞消化至细胞培养瓶,用750 mg/L G418加压筛选,约15 d后,无G418抗性的细胞几乎全部死亡,用有限稀释法将细胞稀释至96孔细胞培养板进行克隆培养,2周后更换无血清培养基,24 h后用直接ELISA法[4]检测上清中目的蛋白的表达量,以筛选高表达目的蛋白的阳性克隆。
1.5 VEGF-Trap2的表达纯化和鉴定
筛选出的高表达阳性克隆扩大培养至2000 mL转瓶,收集无血清培养上清,用0.45 μm微孔滤膜除去细胞碎片等杂质,调节pH值至7.4,用A蛋白亲和层析柱纯化,上样流速5 mL/min(纯化条件:平衡缓冲液0.5 mol/L Tris-HCl+0.5 mol/L NaCl,pH7.4;洗脱液0.1 mol/L Gly-HCl,pH3.0)。280 nm波长处检测紫外吸收峰,收集管中含有pH9.0的饱和精氨酸溶液以中和目的蛋白pH值至中性。按说明书操作用BCA法精确定量蛋白浓度,还原型SDS-PAGE鉴定目的蛋白。
1.6 非竞争ELISA测定VEGF-Trap2与hVEGF165的特异性结合
参照Beatty等[5-7]的方法,将hVEGF165用包被液梯度稀释至2、1、0.5、0.25 ng/μL,每孔100 μL包被96孔微孔板(设内对照孔),37℃孵育2 h;PBST(0.05%Tween-20)洗板3次,每次 5 min,5%BSA(PBS配制)封闭,37℃孵育2 h;封闭结束洗板后,分别将10、1、1×10-1、1×10-2、1×10-3、1×10-4、1×10-5ng/μL的VEGF-Trap2加至hVEGF165包被的孔中,每孔100 μL,每个浓度3个复孔,37℃孵育2 h;孵育结束洗板后,每孔加入100 μL用1%BSA(PBS配制)以1∶5000稀释的HRP标记的山羊抗人IgG抗体,37℃孵育1 h后洗板,加入TMB显色液避光10 min显色,读取D405nm值;以VEGF-Trap2的浓度为横坐标、相应的D405nm值为纵坐标,绘制不同浓度hVEGF165包板条件下VEGF-Trap2与其结合的反应曲线。阳性对照组中,VEGF-Trap1是未优化的VEGFR1D2/VEGFR2D3与人IgG Fc的融合蛋白,其构建表达及纯化条件与VEGF-Trap2完全相同。
1.7 生物膜干涉(biolayer interferometray,BLI)测定VEGF-Trap2与hVEGF165的亲和力
通过Octet分子相互作用技术平台测定VEGFTrap2与hVEGF165的亲和力及动力学参数,阳性对照为VEGF-Trap1,空白对照为PBS缓冲液。在Forte Bio QK分析仪上装载抗人IgG Fc生物传感器,设定程序,运行。
2 结果
2.1 真核表达载体pIRES2-EGFP-VEGF-Trap2的构建及鉴定
目的基因VEGFR1D2/R2D3与pIRES2-EGFPFc载体经BamHⅠ/NheⅠ双酶切后连接,重组产物转化感受态大肠杆菌TOP10,挑取阳性克隆进行菌落PCR验证,重组质粒pIRES2-EGFP-VEGF-Trap2经BamHⅠ/NheⅠ双酶切后用12 g/L琼脂糖电泳分析,条带与预期结果相符(图1)。将酶切验证正确的质粒测序,结果正确,表明构建了真核表达载体pIRES2-EGFP-VEGF-Trap2(图 2),扩增并提取重组质粒。
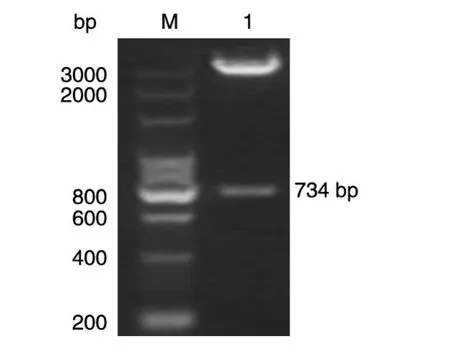
图1 重组质粒pIRES2-EGFP-VEGF-Trap2的酶切鉴定M:200 bp DNA ladder;1:BamHⅠ/NheⅠ双酶切重组质粒
2.2 pIRES2-EGFP-VEGF-Trap2 转染 CHO-K1 细胞及阳性克隆的获得
重组质粒pIRES2-EGFP-VEGF-Trap2转染CHO-K1细胞6 h后,更换含5%小牛血清的DMEM/F-12完全培养基培养,24 h后在显微镜下观察,实验组在绿色激发光下大部分细胞可见绿色荧光信号(图3),表明已将目的基因转染至CHO-K1细胞并且有目的蛋白表达。对照组细胞未见绿色荧光。
在加压筛选过程中,用750 mg/L G418筛选转染重组质粒的阳性细胞克隆,有限稀释法将多个克隆消化至96孔细胞培养板进行单克隆化。2周后,在荧光显微镜下清晰可见单克隆细胞完全呈绿色(图4),即重组质粒稳定转染细胞,获得稳定表达融合蛋白的单克隆。
2.3 VEGF-Trap2的亲和纯化及SDS-PAGE鉴定
无血清培养上清经过滤处理后,用A蛋白亲和层析柱纯化,洗脱时,280 nm波长处紫外检测峰为单一峰(图5)。亲和纯化获得的VEGF-Trap2经还原型SDS-PAGE鉴定,考马斯亮蓝G250染色,在相对分子质量72×103处有清晰的蛋白条带(图6),与预期结果相符,无其他蛋白条带可见。
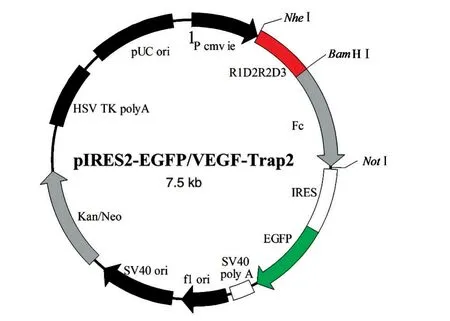
图2 重组质粒pIRES2-EGFP-VEGF-Trap2示意图
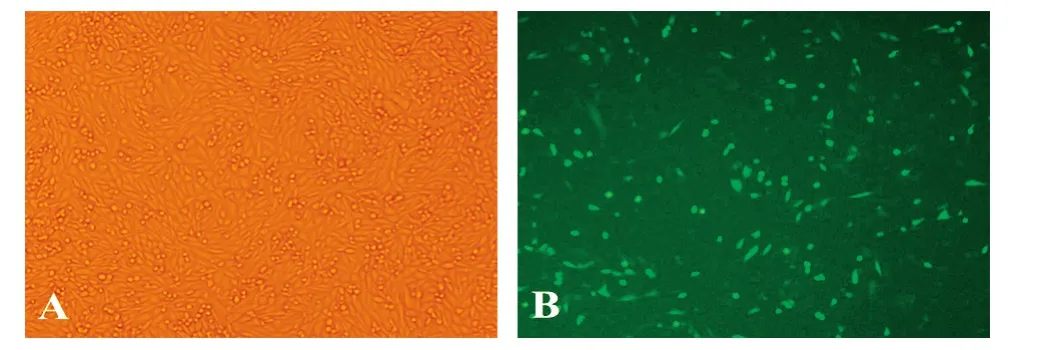
图3 荧光显微镜观察VEGF-Trap2在CHO-K1细胞中的表达(100×)A:明视场照明;B:暗视场照明

图4 荧光显微镜观察稳定转染重组质粒pIRES2-EGFP-VEGF-Trap2的CHO-K1细胞形成的单克隆(40×)A:明视场照明;B:暗视场照明
2.4 VEGF-Trap2与hVEGF165的结合反应曲线及功能性亲和常数
将曲线(图7)右侧的平台期作为最大D405nm值,用作图法得每条曲线半数D405nm值处所对应的蛋白质量浓度,换算成摩尔浓度,代入Beatty法公式(下式)求亲和常数:

式中,n=Ag/Ag',Ab和Ab'分别代表抗原浓度为Ag与Ag'时产生半数D405nm值的抗体摩尔浓度。
本实验中,将hVEGF165作为抗原、VEGF-Trap作为抗体进行计算。n=2时得3个K值,n=4时得2个K值,n=8时得1个K值,取6个K值的均值作为最终结果。经过对2种蛋白与hVEGF165结合曲线的测定,求得VEGF-Trap2的功能性亲和常数为1.86×107L/mol;阳性对照组中,VEGF-Trap1的功能性亲和常数为2.57×107L/mol。该结果表明获得的基因重组蛋白VEGF-Trap2与hVEGF165有很强的亲和力。

图5 VEGF-Trap2纯化过程的紫外吸收图
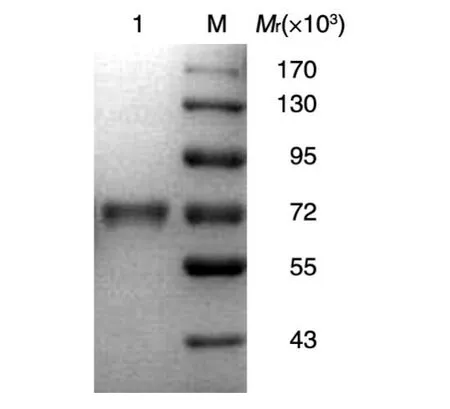
图6 纯化后VEGF-Trap2的还原型SDS-PAGEM:标准蛋白;1:纯化的VEGF-Trap2蛋白
2.5 VEGF-Trap2与hVEGF165的动力学结合参数
VEGF-Trap2、VEGF-Trap1与 hVEGF165的结合及解离过程见图8。阳性对照VEGF-Trap1与hVEGF165的动力学结合参数 Ka、Kd和 KD分别为 2.93×105L/(mol·s)、57.6×10-4s-1和19.7×10-9mol/L;VEGF-Trap2与 hVEGF165的动力学结合参数Ka、Kd和KD分别为2.31×105L/(mol·s)、7.23×10-4s-1和3.13×10-9mol/L。VEGF-trap2、VEGF-Trap1与hVEGF165均有很高的亲和力。
3 讨论

图7 VEGF-Trap2及VEGF-Trap1与hVEGF165结合的反应曲线图中4条曲线的hVEGF165包板浓度分别为2、1、0.5和0.25 ng/μL

图8 VEGF-Trap2及VEGF-Trap1与hVEGF165的结合-解离曲线A:VEGF-Trap2;B:VEGF-Trap1
VEGF mRNA在人类许多肿瘤组织,如肾癌、乳腺癌、结直肠癌中表达[8]。VEGF的过表达是肿瘤转移的重要特征。近年来,以VEGF及VEGFR为靶点的抗肿瘤血管生成药物在治疗恶性肿瘤方面取得了令人瞩目的成绩。2012年,由VEGFR1D2/R2D3与人IgG1 Fc片段融合而成的Zaltrap(即VEGF-Trap)获准上市[9]。
VEGF-Trap与VEGF-A有极高的亲和力,可诱捕游离的VEGF-A,有效阻断肿瘤细胞VEGF旁分泌和自分泌信号传导途径。同时,VEGF-Trap与PIGF-2、VEGF-B也有较强的结合能力[10],避免了因阻断单一血管生成因子而带来的其他血管生成因子高表达的肿瘤血管援救反应。VEGF的自分泌也存在于正常生理状态下,长期阻断内皮细胞间的VEGF信号或直接封闭VEGFR2,会对正常组织的血管产生危害[11-12]。一些小分子抗肿瘤血管生成药物如VEGFR2抑制剂能自由进出细胞,完全抑制VEGFR2的激活[12],产生高血压、血栓栓塞、蛋白尿等副作用。而VEGF-Trap作为大分子药物,对VEGFR2的磷酸化作用影响较小,临床实验数据表明,VEGF-Trap的副作用更小,安全性更高[13]。
在本研究中,我们将VEGF-Trap基因序列进行修饰,用基因工程手段将基因VEGFR1D2与VEG⁃FR2D3连接到人IgG1 Fc片段上,构建真核表达载体pIRES2-EGFP-VEGF-Trap2,为保证目的蛋白的生物学活性,我们将VEGF-Trap2基因转染哺乳动物细胞CHO-K1,挑选出高表达阳性单克隆扩大培养,成功获得重组蛋白VEGF-Trap2。
值得注意的是,虽然hVEGF165与VEGF-Trap2和VEGF-Trap1的结合常数(Ka)没有明显差异,但hVEGF165与VEGF-Trap2的平衡解离常数(KD)比其与VEGF-Trap1的KD值更低,只有后者的1/6左右,这表明VEGF-Trap2与hVEGF165的结合更为牢固。Beatty等建立的采用非竞争性ELISA法测定抗原-抗体功能性亲和常数的方法尽管在理论上不十分完整,但因为其不受抗原分子大小的限制,操作简便,而被广泛应用。VEGF-Trap2与VEGF的高亲和力是其阻断VEGF信号通路的关键,所以本研究中我们模拟抗原-抗体的亲和力测试方法,用Beatty等建立的方法验证VEGF-Trap2与hVEGF165之间的亲和力高低。通过非竞争性ELISA法及Forte Bio仪器检测,均证明VEGF-Trap2与hVEGF165有较高的亲和力,表明我们获得的重组蛋白有生物学活性,能诱捕VEGF-A,阻断VEGF信号传导途径,为下一步的体外细胞实验及体内实验奠定了基础。
[1] Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285:1182-1186.
[2] Shibuya M.Vascular endothelial growth factor(VEGF)and its receptor(VEGFR)signaling in angiogenesis:a crucialtarget for anti-and pro-angiogenic therapies[J].Genes Cancer,2011,2(12):1097-1105.
[3] Roskoski R.VEGF receptor protein-tyrosine kinases:structure and regulation[J].Biochem Biophys Res Commun,2008,375:287-291.
[4] Crowther J R.The ELISA guidebook[M].New Jersey:Humana Press,2002:12-14,45-53.
[5] Beatty J D,Beatty G B.Measurement of monoclonal antibody affinity by noncompetitive enzyme immunoassay[J].J Immunol Methods,1987,100(1-2):173-179.
[6] 郑大勇,罗荣城,韩焕兴,等.非竞争性ELISA法测定人源抗HBsAg Fab功能性亲和常数[J].解放军医学杂志,2004,29(2):110-119.
[7] 白慧玲,赵粤萍,刘广超,等.非竞争ELISA法测定抗DR5单克隆抗体功能性亲和常数[J].河南大学学报(医学版),2005,24(4):11-13.
[8] Ferrara N,Hillan K J,Gerber H P,et al.Discovery and de⁃velopment of bevacizumab,an anti-VEGF antibody for treat⁃ing cancer[J].Nat Rev Drug Discov,2004,3(5):391-400.
[9] Muhammad W S.Anti-VEGF agents in metastatic colorectal cancer(mCRC):are theyallalike[J]? CancerManagRes,2013,5:103-115.
[10]Papadopoulos N,Martin J,Ruan Q,et al.Binding and neu⁃tralization of vascular endothelial growth factor(VEGF)and re⁃lated ligands by VEGF Trap,ranibizumab and bevacizumab[J].Angiogenesis,2012,15:171-185.
[11]Lichtenberger B M,Tan P K,Niederleithner H,et al.Auto⁃crine VEGF signaling synergizes with EGFR in tumor cells to promote epithelial cancer development[J].Cell,2010,140:268-279.
[12]Lee S Y,Chen T T,Barber C L,et al.Autocrine VEGF sig⁃naling is required for vascular homeostasis[J].Cell,2007,130:691-703.
[13]Andrew G,Vivien T.A preclinical and clinical review of af l ibercept for the management of cancer[J].Cancer Treat Rev,2012,38:484-493.

