Ames试验假阳性的判断方法
陈颖,姜娟,杨阳,李莹,周莉,孙祖越
上海市计划生育科学研究所 药理毒理学研究室,中国生育调节药物毒理学检测中心,上海 200032
Ames等经十余年努力[1-2],于1975年建立并不断发展完善的沙门菌回复突变试验(亦称Ames试验),是一种快速检测化合物致突变性和潜在致癌性的方法[3-5],目前已成为世界范围内基因突变检测中应用最为广泛的一种方法[6],也是我国药物遗传毒性标准试验组合中必选的一项。鼠伤寒沙门菌的组氨酸营养缺陷型(异养型his-)菌株不能生长在缺乏组氨酸的培养基中,受诱变剂作用后,大量细菌发生回复突变成野生型(原养型his+),自行合成组氨酸,使其在缺乏组氨酸的培养基上也能生长发育成肉眼可见的菌落[7-9]。
在Ames平皿掺入试验中,一般会在上层琼脂中添加少量组氨酸,在含微量组氨酸的培养基中,除极少数自发回复突变的细菌外,一般只能分裂几次,形成在显微镜下才能见到的微菌落(即背景菌落)[10]。通常判断受试物毒性的方法是通过观察背景菌落的生长状态及琼脂培养基的清亮程度,一般来说背景菌苔生长良好时琼脂呈乳白色,若琼脂清亮透明,则说明背景菌苔生长不良,受试物具有细菌毒性。但是,由于各厂家生产的琼脂质量不一,很难通过观察琼脂培养基来判断受试物是否具有细菌毒性,在低倍镜下观察背景菌落的生长状态也会受到琼脂的干扰而影响观察,因此这些方法并不可靠。在此,我们提供了判断Ames试验假阳性结果的可靠办法。
1 材料与方法
1.1 材料
5株标准测试菌株TA97、TA98、TA100、TA102和TA1535购自Moltox公司,在液氮或-80℃冰箱中贮存。阳性对照诱变剂为敌克松(Dexon)、叠氮钠(SA)(上海楷洋生物有限公司),2-氨基芴(2-AF)、2-氨基蒽(2-AN)(Alfa Aesar公司)。
菌株TA97、TA98、TA100和TA102除具有组氨酸合成缺失突变外,还具有细胞壁脂多糖缺失突变(可增加受试物渗透进入细胞的能力),含有pKM101质粒(可增强细胞DNA损伤的误修复,促使有可能被修复的前突变转变为真正的突变,以提高菌株的敏感性,表现为具有氨苄西林抗性)[11]。TA1535不含pKM101质粒。TA97、TA98、TA100和TA1535菌株具有切除修复系统缺失突变(紫外线敏感);而TA102则含有pAQ1质粒,表现为具有四环素抗性。
1.2 抑菌试验
根据国家食品药品监督管理局2007颁布的《药物遗传毒性研究技术指导原则》[12],对于可溶性的无毒化合物,推荐的最高测试浓度一般为5 mg/皿;对于可溶性的有细菌毒性的受试物,应根据杀菌或抑菌情况确定最高浓度。因此,在抑菌试验中采用5.0、2.5、1.25、0.625 和 0.3125 mg/皿,对受试物的毒性进行检测。
1.3 正式试验
根据抑菌试验中受试物的毒性情况确定最高浓度后,设计5个剂量组,在加或不加S9代谢活化系统的条件下采用平皿掺入法进行正式试验,同时设溶媒对照和阳性诱变剂对照。直接诱变剂敌克松为实验菌株TA97、TA98、TA100和TA102的诊断性阳性诱变剂;直接诱变剂叠氮钠为实验菌株TA1535的诊断性阳性诱变剂;间接诱变剂2-氨基芴为实验菌株TA97、TA98、TA100和TA102的诊断性阳性诱变剂;间接诱变剂2-氨基蒽为实验菌株TA1535的诊断性阳性诱变剂。
1.4 验证试验
在正式试验中发现部分菌株的菌落数有所增加,在不能确定受试物是否具有致突变效应的情况下,将 1.0 mg/皿剂量作用的 TA1535 和 0.25 mg/皿剂量作用的TA97中疑似突变的菌落,以及相应的阳性对照物作用的菌落进行增菌培养,划线接种于无组氨酸的底层琼脂培养基上,以验证增加的菌落是否为突变菌落。
2 结果
2.1 抑菌试验结果
在5.0 mg/皿剂量下5株菌均无菌落形成,在2.5 mg/皿剂量下仅出现极少量菌落,在 1.25 mg/皿剂量下各菌株菌落数明显少于自发回变菌落数,表明该化合物在上述剂量下具有细菌毒性。故正式试验中采用1.0 mg/皿为最高剂量浓度。
2.2 正式试验结果
采用平皿掺入法检测受试物在 1.0、0.5、0.25、0.125 和 0.0625 mg/皿 剂 量 下 对 测 试 菌 株 TA97、TA98、TA100、TA102和TA1535的致突变性时,发现TA97在0.5和0.25 mg/皿剂量下,无论有无S9活化系统,对测试菌株TA97产生的回变菌落数与溶媒对照组相比呈增加趋势;TA1535在1.0 mg/皿剂量下,无论有无S9活化系统,对TA1535产生的回变菌落数与溶媒对照组相比虽无统计学差异,但能观察到菌落数增加(表1,图1)。
2.3 验证试验结果
给予受试物的菌株不能生长在无组氨酸的培养基上,而给予阳性对照物的菌株却可以生长在无组氨酸的培养基上,说明受试物造成的TA97和TA1535菌落数增加并非致突变作用所致(图2),而是毒性作用导致的假阳性结果。

表1 受试物平皿掺入试验结果
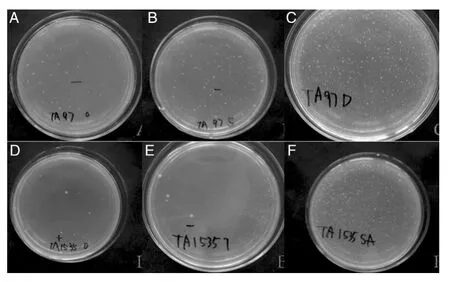
图1 平皿掺入试验结果
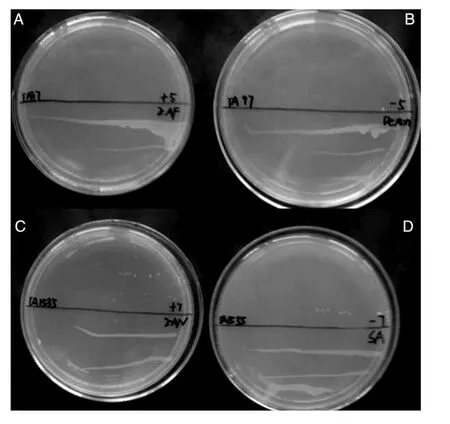
图2 验证试验结果
3 讨论
在验证试验中,经受试物处理的TA1535增菌后划线接种于无组氨酸的培养基,经培养产生了星星点点的菌落(图2C、D),可能在挑取菌落进行增菌培养时挑取了部分发生自发回变的菌落,因此其可以生长在无组氨酸的培养基中。
受试物的毒性作用可以导致Ames试验出现假阳性结果,由于受试物杀死了大部分细菌,使残存的细菌得以利用培养基中微量的组氨酸和生物素生长成肉眼可见的菌落,但这并非回变菌落,而是由供试品毒性导致的假阳性结果。本试验能可靠地判断经受试物处理的菌株是否为突变菌株,从而确定受试物是否具有致突变作用。
[1] 薛开先.遗传毒理学讲座[J].癌变畸变突变,1995,7(2):124-128.
[2] Alper M D,Ames B N.Positive selection of mutants with de⁃letions of the gal-chl region of the Salmonella chromosome as a screening procedure for mutagens that cause deletions[J].J Bacteriol,1975,121(1):259-266.
[3] 王明臣,张善锋,毛红丽,等.Ames实验对叶黄素的致突变性与抗突变性研究[J].癌变畸变突变,2005,18(1):65-67.
[4] 周永贵,Chung K T.Ames试验研究鞣酸和相关化合物的毒性和抗突变性[J].环境与职业医学,2002,19(4):231-258.
[5] 陆华,马康目,孙皎,等.Ames试验与MLA试验检测两味含马兜铃酸中药的致突变性[J].癌变畸变突变,2007,19(6):484-486.
[6] 邹琳,潘秀颉,吴维佳,等.微量波动Ames试验在卷烟烟气毒理学评价中的应用研究[J],.湖南农业科学,2010,(11):82-89.
[7] 胡燕平,马锐,宋捷,等.蔡司多功能护理液的遗传毒性研究[J].癌变畸变突变,2012,24(5):379-382.
[8] 马茂才,黄萍,晏辉,等.纳米二氧化钛和纳米氧化锌的Ames试验[J].癌变畸变突变,2010,22(4):302-304.
[9] 汪希兰,杨光红,潘雪莉,等.烯啶虫胺的致突变性试验[J].癌变畸变突变,2010,22(5):397-400.
[10]刘波,金建玲,张辉,等.Ames测试不确定性分析[J].应用与环境生物学报,2007,13(5):726-730.
[11]杨春梅,艾红军,张跃.聚β-羟基丁酸酯材料的鼠伤寒沙门氏菌回复突变试验[J].中国组织工程研究与临床康复,2009,13(21):4137-4140.
[12]Mccann J,Spingarn N E,Kobori J,et al.Detection of carcin⁃ogens as mutagens:bacterial tester strains with R factor plas⁃mids[J].Proc Natl Acad Sci USA,1975,72(3):979-983.

