用环介导等温扩增技术快速检测粪便样本中的沙门菌
刘威,李环,邹大阳,杨展,赵向娜,李雪莲,崔茜,王思淼,黄思妺,闫夏贝,魏晓,王雪松,尹志涛,黄留玉,袁静
军事医学科学院 疾病预防控制所,北京 100071
据统计,在世界各国多种类细菌性食物中毒中,沙门菌引起的食物中毒常列榜首[1-3]。过去的一个世纪,中国作为一个主要的食品生产商和消费者,人均消费的食物大幅增加。根据食源性疾病暴发的报告,1992~2005年,在细菌性食源性疾病暴发中沙门菌病是第二大原因,每年约10%~20%的暴发是由沙门菌引起的[4]。食源性沙门菌常导致腹泻,更好地控制沙门菌感染需要敏感和快速的检测方法。虽然传统的分离培养沙门菌的方法仍被广泛使用,但所需检测时间超过3 d[5-6]。以PCR为基础的快速检测沙门菌的分子技术已经建立[7]。但PCR鉴定有几个固有的缺点,如对试验条件要求较高,需要昂贵的仪器设备和专业人员,且操作相对复杂,更为重要的是检测成本高,只有专业检测实验室才能进行,基层单位难以开展。因此,开发一种操作简便、特异性高、灵敏度好、检测快速、成本低廉、适于基层推广的检测方法,对沙门菌的监控将起到积极作用。最近发展的环介导等温核酸扩增技术(loop-mediated isother⁃mal amplification,LAMP)是一种新的分子生物学方法,它在等温条件下实现核酸扩增[8-9]。LAMP技术的反应原理是,根据序列保守区域设计的一对外引物、一对内引物和一对环引物特异性识别靶序列上的6个独立区域,在Bst大片段聚合酶的作用下引起自循环链置换反应,在60~65℃范围60 min内大量合成目标DNA,同时伴随副产物——白色的焦磷酸镁沉淀产生。由于LAMP扩增过程依赖识别靶序列6个独立区域,所以反应特异性很强,且核酸扩增过程在等温条件下进行,普通水浴锅或有稳定热源的设备即可满足反应要求,检测成本大大降低。目前,LAMP技术在临床诊断[10]、细菌或病毒的定性和定量检测[1,11-15]、性别鉴定[16]和其他方面得到广泛应用。已有研究结果表明,invA基因是沙门菌独有的基因,也是PCR检测沙门菌的一个目标基因[17]。因此,我们选择invA基因作为LAMP法检测沙门菌的目标基因,拟以LAMP法为基础对粪便样本中的沙门菌进行检测。
1 材料与方法
1.1 材料
实验用菌种见表1,各菌株在脑心浸液肉汤(BHI)中于37℃培养;Bst大片段DNA聚合酶(New England Biolabs公司);总DNA提取纯化试剂盒(Promega公司);dNTP(Pharmacia公司);Chelex-100、甜菜碱(Sigma公司);硫酸镁、氯化钾、氢氧化钠、EDTA、硫酸铵(国药集团化学试剂有限公司);Tris-HCl(上海生科生物科技有限公司);Triton X-100(北京美莱博医学科技有限公司);NP-40(FLU⁃KA公司);羟基萘酚蓝(HNB)(Regal Biotechnology公司);2×Tap MIX(天根生化科技(北京)有限公司);琼脂糖(AMRESCO公司);引物由北京奥科鼎盛生物有限公司合成。
PCR扩增仪,凝胶成像系统(Bio-Rad公司);分光光度计(NanoDrop ND-1000);实时浊度仪LA-320c(日本荣研化学株式会社);等温金属浴(杭州博日科技有限公司)。
1.2 细菌菌株和准备的模板
将细菌分别接种于5 mL对应的培养基中,按照细菌最适宜生长温度培养过夜。用Chelex法提取细菌总DNA:取500 μL细菌悬液,10 000 r/min离心2 min,弃上清,加入500 μL双蒸水,再加入等体积的 Chelex法 DNA提取液(25 mmol/L NaOH,10 mmol/L Tris-HCl,1%Triton X-100,1%NP-40,0.1 mmol/L EDTA,2%Chelex-100),于沸水中沸煮10 min,转入4℃放置5 min,14 000 r/min离心2 min,上清液在LAMP和PCR反应中[18]用作模板。
1.3 引物设计
从NCBI数据库中获得已知的invA基因序列(NC_003197.1),用Primer Explorer v4软件(http://primerexplorer.jp/LAMP)进一步分析序列,设计外环正向引物(F3)、外环反向引物(B3)、内环正向引物(FIP)、内环反向引物(BIP),额外的2个环引物(LF和LB)是为了加速放大反应(表2)。FIP和BIP设计时添加了4个胸腺嘧啶(TTTT)。与PCR比较其敏感性和特异性,PCR引物为SM127B3和SM127F3。

表1 特异性LAMP实验所用菌种
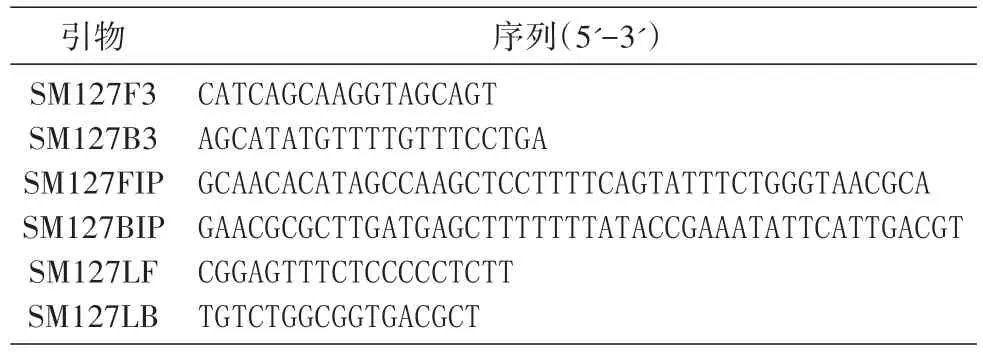
表2 扩增invA基因的LAMP引物及序列
1.4 LAMP反应
配制25 μL LAMP反应体系,包含20 mmol/L Tris-HCl(pH8.8)、10mmol/L KCl、10mmol/L(NH4)2SO4、0.1%Tween-20、0.8 mol/L 甜 菜 碱 、8 mmol/L MgSO4、1.4 mmol/L dNTP 和 8 U Bst DNA聚合酶。需要40 pmol引物FIP和BIP、20 pmol引物LF和LB、5 pmol引物F3和B3。最后,添加适当数量的DNA模板到反应管中。反应须在63℃恒温浴中进行50 min,80℃灭活5 min。
1.5 LAMP结果检测
LAMP过程发生如下化学反应:
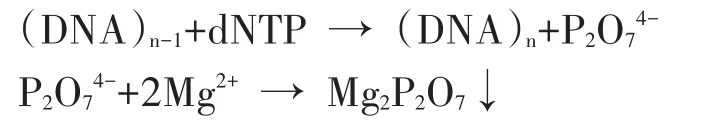
其中,Mg2P2O7即焦磷酸镁为白色沉淀。依据此原理,日本荣研化学株式会社开发出实时浊度仪LA-320c,每隔6 s测定反应管的浊度并绘制曲线,判断反应的阴阳性。
HNB是一种金属离子指示剂,依赖反应液中镁离子的变化而呈现不同的颜色,阴性时为紫色,阳性时为天蓝色。使用时将HNB配制成2.4 mmol/L的反应液[17],-20℃保存备用。
1.6 PCR检测
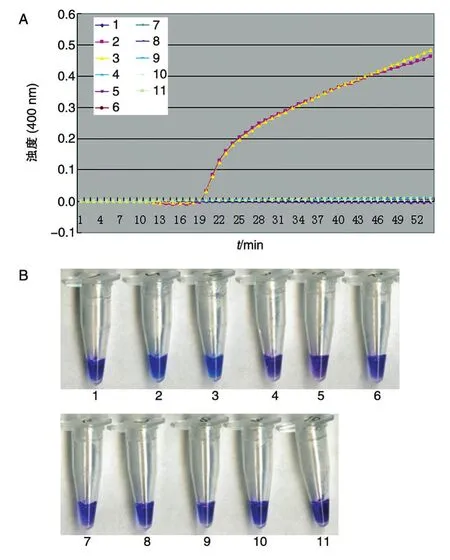
图1 LAMP反应检测8株已知非沙门菌的特异性
25 μL PCR反应体系包含12.5 μL PCR主混合试剂(天根公司)、1 μmol/L SM127F3和SM127B3引物和相同数量的DNA模板。反应参数为95℃预变性5 min,然后以95℃变性30 s、55.5℃退火30 s、72℃延伸30 s进行35个循环,72℃延伸10 min。取PCR产物5 μL,在1%含EB的琼脂糖凝胶中电泳(120 V,35 min),用凝胶成像系统检测。
2 结果
2.1 特异性的LAMP试验
选出8株已知非沙门菌和16株沙门菌分别进行LAMP扩增。当反应体系中存在沙门菌的特定基因时发生LAMP扩增反应,产生大量焦磷酸镁白色沉淀,反应液的浊度上升,在图中表现为曲线上升,可以看出只有沙门菌曲线上升,所有非沙门菌菌株LAMP反应显示阴性。表明这套引物具有良好的特异性。反应前加入1.25 μL 2.4 mmol/L的HNB,只有沙门菌反应管的颜色变成了天蓝色,示为阳性,其他菌株均为紫色,示为阴性,也说明设计的引物具有良好的特异性。见图1、2。
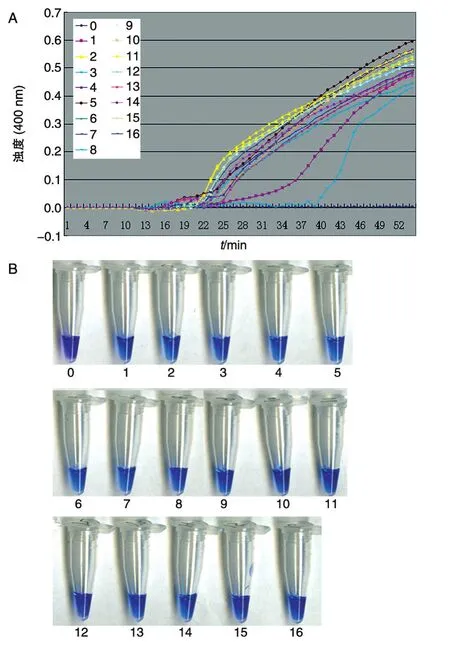
图2 16株沙门菌的特异性检测
2.2 灵敏度的LAMP试验
为了确定设计的引物用于检测沙门菌的敏感性,用基因组DNA提取试剂盒提取肠炎沙门菌的基因组DNA,1/10梯度稀释后用于LAMP、PCR,结果见图3。浊度仪检测和HNB检测均得到相同结果,LAMP检测的最低限度约6.97 pg/μL,PCR检测限度约69.7 pg/μL。
2.3 粪便样品的LAMP检测方法评估
进一步用LAMP法分析评估检测粪便样本的敏感性。将肠炎沙门菌DNA梯度稀释后与粪便样品混匀,进行LAMP,结果见图4。浊度仪检测和HNB检测均得到相同结果,都与纯样品有相同的灵敏度。因此,我们可以得出结论,2种检测方法有相同的灵敏度。用相同的模板,采用PCR鉴定没有达到我们的目标,目标片段并不清楚(图4C),这是因为粪便中的杂质影响所致。
3 讨论
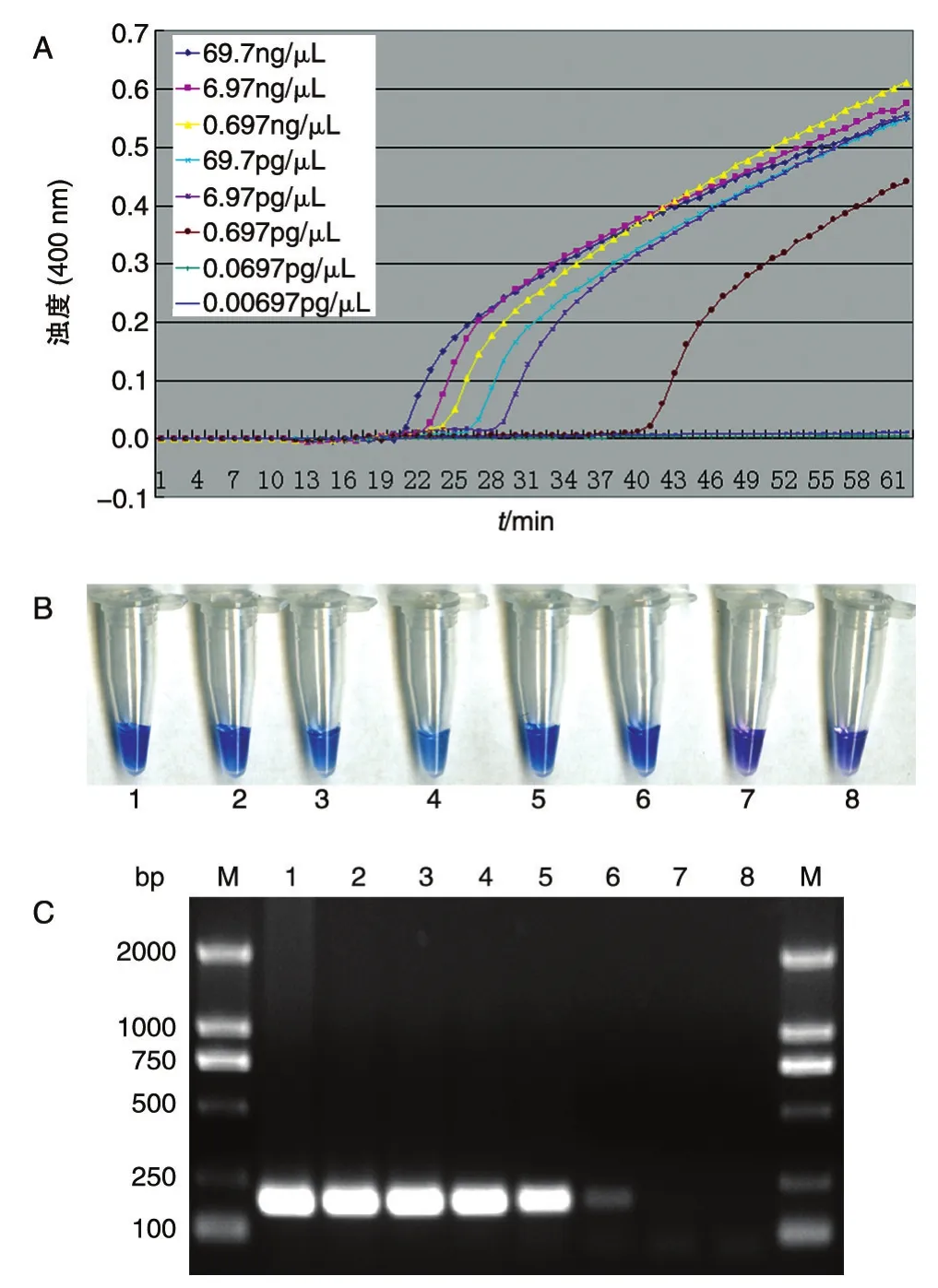
图3 LAMP法和PCR法的灵敏度比较
用LAMP法可以在恒温条件下于1 h内通过扩增细菌的一个目标基因来检测细菌,大大节约了时间和劳动力成本,已有许多采用LAMP检测病原菌的文献报道,包括大肠杆菌O157∶H7、单核细胞增多性李斯特菌、金黄色葡萄球菌、副溶血弧菌[19-21]。在本研究中,我们设计了针对沙门菌特异基因invA的LAMP引物,并用该引物灵敏、快速地检测到沙门菌。用Chelex法提取基因组DNA,整个处理时间不超过20 min,反应过程快捷,只须将反应混合液在60℃~65℃恒温条件下保持60 min即可完成。现在国内大多数研究者在检测LAMP反应结果时往往选择对反应结果进行电泳或在反应完成后添加SYBR GreenⅠ荧光染料,这2种方法都使反应产物暴露于空气中,污染了环境,极其容易造成假阳性,而且电泳法检测并不能实时反映LAMP反应过程。我们采用实时浊度仪和HNB检测,反应完成后不开盖,很好地杜绝了污染,有效防止了假阳性。
综上,我们应用LAMP法对沙门菌进行了快速检测,特异性强,灵敏度高。LAMP法虽然扩增原理复杂,但操作简便、用时少、灵敏度高、特异性强,再加上其等温反应条件,因此适用于检验检疫部门和卫生医疗单位对沙门菌的检测,并有望成为简易的常规检测手段应用于基层单位。
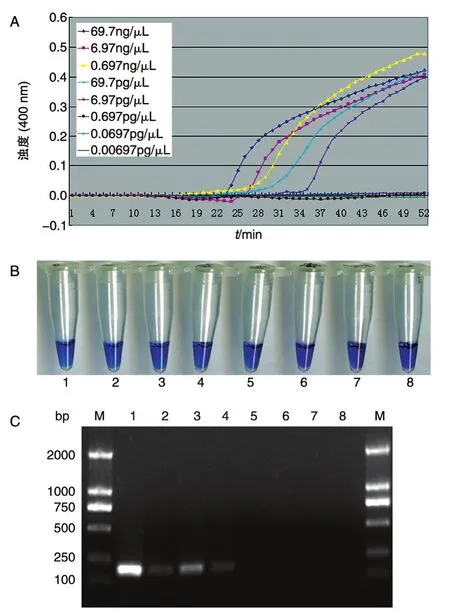
图4 LAMP法和PCR法检测粪便样本中肠炎沙门菌的灵敏度比较A:LAMP法浊度仪检测结果;B:LAMP法HNB显色结果;C:PCR法检测结果;M:D2000 DNA marker;1~8:肠炎沙门菌基因组DNA浓度 依 次 为 69.7、6.97、0.697 ng/μL 和 69.7、6.97、0.697、0.0697、0.00697 pg/μL
[1] Ohtsuka K,Yanagawa K,Takatori K,et al.Detection of Sal⁃monella enterica in naturally contaminated liquid eggs by loop-mediated isothermal amplification,and characterization of Salmonella isolates[J].ApplEnviron Microbiol,2005,71(11):6730-6735.
[2] Tirado C,Schmidt K.WHO surveillance programme for con⁃trol of foodborne infections and intoxications:preliminary re⁃sults and trends across greater Europe[J].J Infect,2001,43(1):80-84.
[3] Wallace D J,van Gilder T,Shallow S,et al.Incidence of foodborne illnesses reported by the foodborne diseases active surveillance network(FoodNet)-1997.FoodNet Working Group[J].J Food Prot,2000,63(6):807-809.
[4] Yan H,Li L,Alam M J,et al.Prevalence and antimicrobial resistance of Salmonella in retail foods in northern China[J].Int J Food Microbiol,2010,143:230-234.
[5] Andrews W H,June G A,Sherrod P A,et al.Salmonella[M]//FDA.Bacteriological analytical manual.8th ed.Gaithersburg:AOAC International,1998.
[6] Bennett G,Tennant B.Rapid and definitive detection of Sal⁃monella in foods by PCR[J].Lett Appl Microbiol,1998,26:437-441.
[7] Chiu T,Chen T,Hwang W,et al.Sequencing of an internal transcribed spacer region of 16S-23S rRNA gene and design⁃ing of PCR primers for the detection of Salmonella spp.in food[J].Int J Food Microbiol,2005,97:259-265.
[8] Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):63.
[9] Endo S,Komori T,Ricci G,et al.Detection of gp43 of Para⁃coccidioides brasiliensisby the loop-mediated isothermal ampli⁃fication(LAMP) method[J].FEMS Microbiol Lett,2004,234(1):93-97.
[10]Okafuji T,Yoshida N,Fujino M,et al.Rapid diagnostic meth⁃od for detection of mumps virus genome by loop-mediated iso⁃thermalamplification[J].J Clin Microbiol,2005,43(4):1625-1631.
[11]Imai M,Ninomiya A,Minekawa H,et al.Development of H5-RT-LAMP(loop-mediated isothermal amplification) system for rapid diagnosis of H5 avian influenza virus infection[J].Vac⁃cine,2006,24(44):6679-6682.
[12]Yeh H Y,Shoemaker C A,Klesius P H,et al.Evaluation of a loop-mediated isothermal amplification method for rapid de⁃tection of channel fish Ictalurus punctatus important bacterial pathogen Edwar dsiella ictaluri[J].J Microbiol Methods,2005,63:36-44.
[13]Hara-Kudo Y,Yoshino M,Kojima T,et al.Loop-mediated isothermal amplification for the rapid detection of Salmonella[J].FEMS Microbiol Lett,2005,253:155-161.
[14]Song T,Toma C,Nakasone N,et al.Sensitive and rapid de⁃tection of Shigella and enteroinvasive Escherichia coli by a loop-mediated isothermal amplification method[J].FEMS Micro⁃biol Lett,2005,243:259-263.
[15]Hirayama H,Kageyama S,Takahashi Y,et al.Rapid sexing of water buffalo(Bubalus bubalis) embryos using loop-mediat⁃ed isothermalamplification[J].Theriogenology,2006,66:1249-1256.
[16]Nagamine K,Watanabe K,Ohtsuka K,et al.Loop-mediated isothermal amplification reaction using a nondenatured template[J].Clin Chem,2001,47:1742-1743.
[17]Yeh K,Chen T,Liao C,et al.PCR amplification of the Sal⁃monella typhimurium fimY gene sequence to detect the Salmo⁃nella species[J].Int J Food Microbiol,2002,78:227-234.
[18]Goto M,Honda E,Ogura A,et al.Colorimetric detection of loop-mediated isothermal amplification reaction by using hy⁃droxy naphthol blue[J].Biotechniques,2009,46(3):167-172.
[19]Siyi C,Beilei G.Development of a toxR-based loop-mediated isothermal amplification assay for detecting Vibrio parahaemo⁃lyticus[J].BMC Microbiology,2010,10:41.
[20]Wang L,Li L,Alam M J,et al.Loop-mediated isothermal amplification method for rapid detection of the toxic dinoflagel⁃late Alexandrium,which causes algal blooms and poisoning of shellfish[J].FEMS Microbiol Lett,2008,282:15-21.
[21]李永刚,王德国,武建刚,等.环介导恒温扩增法(LAMP)检测金黄色葡萄球菌[J].食品工业科技,2010,1:388-391.

