高山被孢霉发酵生产花生四烯酸的宏观形态
代 军,赵根海,王 鹏,刘 会,宋均营,胡以华,郑之明
(1.中国科学院 合肥物质科学研究院 离子束生物工程学重点实验室,合肥 230031;2.解放军电子工程学院,合肥 230037)
微生物油脂又称单细胞油脂(SCO),是指某些微生物在一定条件下将碳水化合物、碳氢化合物和普通油脂等C源转化为菌体内大量储存的油脂,并且油脂量一般占菌体干质量的20%以上。产油脂微生物主要有酵母、真菌、微藻和细菌,其中以对酵母菌和丝状真菌的研究居多,少数产油微生物能在胞内积累超过细胞干质量70%的油脂[1-2]。早期微生物油脂的研究主要集中在功能性油脂的开发上,随着国际能源危机和国内生物柴油产业面临的原料困境,以微生物油脂进行生物柴油生产的研究日益受到关注。微生物发酵法与依赖油料植物获得油脂的传统方法相比,有周期短、不受季节和气候影响、原料来源广泛、潜力大等优点,具有广阔的工业化应用前景[3]。高山被孢霉(Mortierella alpina)由于胞内合成的油脂富含一种功能性多不饱和脂肪酸花生四烯酸(ARA)而备受关注[4]。
在丝状菌的深层发酵过程中,菌丝的形态结构会显著影响发酵液的流变性质。当菌丝呈球状生长时,培养液黏度较低,通常发酵液表现为牛顿型流体特性,在深层培养中的动量、热量和质量传递较为容易,当球逐渐增大时,菌丝球由外到内形成营养梯度,营养成分向球中心扩散受到限制,内部菌丝体的代谢产物的生产下降[5-7];而当菌丝呈丝状生长时,发酵液黏度较高,发酵液表现为非牛顿流体特性,液体流动性差,导致动量、热量和质量传递困难,容易因混合不充分造成气液相间传热和传质不良,最终也会影响代谢产物的生产[8]。菌丝体微观形态的微小差异都有可能导致宏观发酵行为的显著差异,实现发酵过程中理想的形态控制是发酵调控的重要途径[9]。对影响形态的因素,国内外研究人员已经进行了大量研究,结果表明溶氧、N源种类、消耗的C/N比、无机盐离子和氨基酸的添加等因素都会影响到菌丝的形态[10-13]。虽然,形态的重要性无可置疑,但培养基成分、形态发生及微生物产ARA水平三者间的关系还不太明晰,将其关联起来进行的研究更是鲜有报道。
笔者所在实验室通过氮离子注入获得Mortierella alpina I49-N18,对其发酵过程中的不同形态与产ARA能力进行研究,并采用图像处理方法对形态参数进行量化分析,旨在为下一步对菌丝球形态控制研究提供基础。
1 材料与方法
1.1 试剂与仪器
石油醚(沸点30~60℃)市售分析纯,SBA-50B型生物传感分析仪(山东省生物技术研究中心),250 mL直滴式索式提取器(郑州中天实验仪器有限公司),体视镜(日本Olympus公司),GC-14C气相色谱仪(Shimaozdu公司)。
1.2 菌种与培养方法
高山被孢霉(Mortierella alpina)I49-N18,中国科学院离子束生物工程学重点实验室保存。平板保存培养基:马铃薯(PDA)培养基。摇瓶发酵培养基(g/L):葡萄糖 80、不同 N 源((NH4)2SO4、NH4Cl、NaNO3、KNO3、酵母粉、蛋白胨、玉米浆和蛋白胨 +酵母粉)20,pH 8.5。培养基115℃、灭菌30 min。菌种在平板PDA培养基上28℃培养7 d,用少许无菌水洗脱,玻璃珠振荡至形成分散的孢子悬液,按10%接种量接入含有50 mL培养液的250 mL三角瓶中,180 r/min、28 ℃培养 7 d。
1.3 分析方法
生物量测定:用纱布将发酵液过滤,并用水冲洗几次,在80℃烘箱烘干至恒质量,称干质量。
菌体总脂测定:利用直滴式索式提取法测定。具体方法为干菌体用研钵磨碎成粉末后,取1.0~1.5 g,在索氏提取器中,石油醚60℃不断回流提取(6 h),收集全部回流液,再旋转蒸发回收石油醚;80℃烘干,称干质量,计算油脂比例。
花生四烯酸比例测定:参照文献[14],利用气相色谱法测定。
发酵液残糖浓度测定:采用SBA-50B生物传感分析仪进行离线葡萄糖测定,检测范围在0~1 g/L。
1.4 形态参数的获取
各种形态的发酵液中,随机取20个菌体用体视镜进行图像采集,利用菌丝体显微图像分割及特征提取软件(2011R11S044664),先进行灰度运算,使图像对比度增强,再经过全局二值化运算去除背景和噪声,得到黑白图像,根据图像中不同的灰度值,通过阈值调整得到成核区域,分别计算其成核区域面积(Apc)与整个菌体投影面积(Am),并计算其比值,用来衡量菌体形态的蓬松程度。菌体直径Dm利用Image J2x软件计算。
2 结果与讨论
2.1 单一N源对形态的影响
考察不同N源发酵对被孢霉的形态的影响,结果见图1。由图1可知:加入不同N源进行发酵,被孢霉的形态差异明显。当无机氮作N源时,菌体不生长,有机氮作N源时,菌体形态呈现出很大区别,主要分为两类:一类是酵母粉或玉米浆作N源时,菌体形成分散菌丝(图1(a));另一类是蛋白胨作N源时,菌体形成球形(图1(b))。

图1 单一N源下高山被孢霉的宏观形态(×8)Fig.1 Macro-morphology of M.alpina under sole nitrogen source(dispersed mycelia and hollow pellets)(×8)
2.2 复合N源对形态的影响
2.2.1 不同宏观形态分析
分别按照表1中的比例添加蛋白胨和酵母粉作为复合N源,进行发酵,观察菌体形态,形态特征数据见表1,菌体宏观形态见图2。
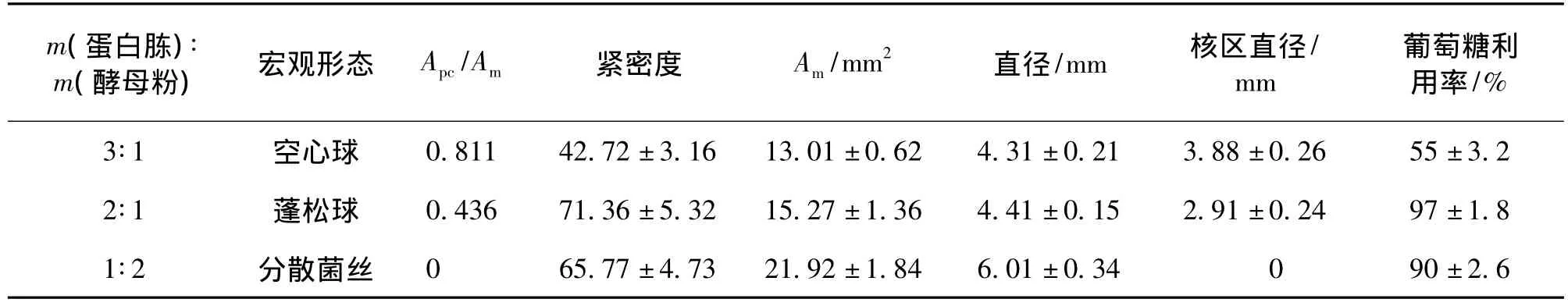
表1 复合N源下菌体宏观形态的形态特征Table 1 Macro-morphologicalcharacteristic parameters under complex nitrogen source
由表1可知:复合N源中蛋白胨与酵母粉比例降低,菌体形态明显不同,总的变化为Apc/Am降低,菌球的成核区域比例越来越小,菌球的蓬松度增加,单个菌体的直径变大。蛋白胨与酵母粉比例为3∶1时,菌体形态为球形,成核区域占81.1%;比例为2∶1时,菌体形态也为球形,但成核面积只占43.6%;比例为1∶2时,菌体形态完全为分散菌丝,不存在成核区域;菌体形态为球形时直径大致相同,4.3 mm左右;形态为分散菌丝时,直径增至6 mm。虽然蛋白胨与酵母粉比例为3∶1和2∶1时菌体形态都为球形,但成核区域直径和单个菌球的紧密度差异明显,分别为3.88 mm、42.27和2.91 mm、71.36。空心球形形态由于成核区域直径较大,菌球中心部位菌丝因为营养缺乏而自溶,形成空心球,同时其葡萄糖利用率只有55%;蓬松球形态的菌丝不存在营养缺乏等问题,形成蓬松球,其葡萄糖利用率高达97%。上述结果表明,蛋白胨有利于菌丝聚集成球,酵母粉有利于菌丝顶端生长,形成辐射状菌丝,其原因可能是,酵母粉作为速效N源,含有丰富的生长因子、维生素、核苷酸等适合菌丝快速萌发生长的微量物质,蛋白胨作为缓效N源,不利于菌丝快速生长,菌丝生长过程中容易聚集在一起。因此,在高山被孢霉发酵过程中,确定复合N源中蛋白胨和酵母粉的比例对形成合适的菌体形态至关重要。

图2 复合N源下高山被孢霉的3种典型宏观形态(×8)Fig.2 Three typical macro-morphologies of M.alpina under complex nitrogen source(×8)
2.2.2 宏观形态对菌体产ARA能力的影响
高山被孢霉在蛋白胨与酵母粉比例不同的复合N源中以不同的形态生长,发酵结束时对生物量、油脂比例及ARA比例进行测定,具体结果见表2。
由表2知:菌体形态以空心球形态生长时,生物量最低,菌体油脂比例最高,ARA比例较高;以蓬松球形态生长时,生物量最高,菌体油脂比例较高,ARA比例最高;以分散菌丝生长时,生物量较高,菌体油脂比例及ARA比例最低。ARA量由生物量、油脂比例及油脂中ARA比例共同决定,因此球形形态菌体ARA产量比分散菌丝菌体ARA产量高,特别是以蓬松球形态生长时,其ARA产量达2.98 g/L,分别是空心球和分散菌丝的2.01和2.70倍。

表2 菌体的不同宏观形态对ARA合成的影响Table 2 Effects of different macro-morphologies on mycelial lipid production
ARA作为一种多不饱和脂肪酸,虽然不是含氮化合物,但其比例与N源种类密切相关,其在菌体内的合成需要多种延长酶和脱饱和酶参与,此过程对O2的依赖程度非常高[15]。由表2知,随着复合N源中酵母粉比例的增加,生物量和ARA比例增加,形态由球形变为分散菌丝。当菌体以分散菌丝形式生长到中后期,发酵液黏度非常大,不利于发酵液中营养和O2等的传递,菌体生长受到抑制,同时也不利于ARA合成,因此生物量和氨基酸比例都有所降低。
Park 等[11]和 Koike等[12]研究了消耗的 C/N 及不同N源对高山被孢霉形态和ARA产量的影响,但未对菌体形成不同形态的原因展开分析,本研究通过调节复合N源中蛋白胨与酵母粉比例,得到了相对连续的菌丝体形态变化过程,即菌丝体的成核区域比例由81.1%(空心球)降为43.6%(蓬松球),最后为0(分散菌丝),显示了不同形态间的内在联系,结合不同形态下菌丝的生长情况发现速效N源有利于形成分散菌丝,迟效N源倾向于使菌丝聚集。因此,调节两类N源的比例,有助于筛选最适于目标产物生成的发酵形态。本研究发现,当复合N源中蛋白胨与酵母粉比例为2∶1时,高山被孢霉菌体形态为类似菊花瓣状蓬松球,其为最适合油脂积累及ARA转化合成的发酵形态。
3 结论
蛋白胨、酵母粉这2种N源是影响高山被孢霉宏观形态的重要因素,当复合N源中蛋白胨与酵母粉比例很高时,菌体形态为空心球,比例适当时为“类似菊花瓣”的蓬松球,比例很低时为分散菌丝。高山被孢霉不同的发酵形态,其菌体产ARA能力存在较大差异。ARA作为一种胞内产物,产量由菌体生物量、菌体油脂比例及油脂中ARA比例共同决定。当高山被孢霉以分散菌丝形态生长时,菌体产ARA能力不如球形形态;而空心球的菌体生物量低,蓬松球可以兼顾菌体高生物量、高油脂比例及高ARA比例,因此具有很高的产ARA能力,其产ARA能力分别是空心球和分散菌丝的2.01和2.70倍。综上所述,菌体形态特征为直径大约4 mm、Apc/Am为0.436、投影面积为15.27 mm2、成核区域直径2.9 mm、紧密度大约为71.36的蓬松球,是高山被孢霉发酵过程中适合油脂积累及ARA转化的典型形态,既排除了空心球中心部分的传质及空气传递等问题,又不会因为过多的分散菌丝导致发酵液黏度变大,从而有利于工业生产过程中发酵液搅拌及下游湿菌体的分离。
[1] Certik M,Shimizu S.Biosynthesis and regulation of microbial polyunsaturated fatty acid production[J].J Biosci Bioeng,1999,87(1):1-14.
[2] Papanikolaou S,Chevalot I,Komaitis M,et al.Kinetic profile of the cellular lipid composition in an oleaginous Yarrowia lipolytica capable of producing a cocoa-butter substitute from industrial fats[J].Anton Leeuw Int J G,2001,80(3/4):215-224.
[3] Ratledge C.Fatty acid biosynthesis in microorganisms being used for single cell oil production[J].Biochimie,2004,86(11):807-815.
[4] Nisha A,Venkateswaran G.Effect of culture variables on mycelial arachidonic acid production by Mortierella alpina[J].Food Bioprocess Tech,2011,4(2):232-240.
[5] Phillips D H.Oxygen transfer into mycelial pellets[J].Biotechnol Bioeng,1966,8(3):456-460.
[6] Elmayerg H,Scharer J M,Mooyoung M.Effects of polymer additives on fermentation parameters in a culture of Aspergillus niger[J].Biotechnol Bioeng,1973,15(5):845-859.
[7] Vansuijdam J C,Kossen N W F,Paul P G.An inoculum technique for the production of fungal pellets[J].Eur J Appl Microbiol,1980,10(3):211-221.
[8] Chain E B,Gualandi G,Morisi G.Aeration studies:IV.aeration conditions in 3000-liter submerged fermentations with various microorganisms[J].Biotechnol Bioeng,1966,8(4):595-619.
[9] Muller C,McIntyre M,Hansen K,et al.Metabolic engineering of the morphology of Aspergillus oryzae by altering chitin synthesis[J].Appl Environ Microb,2002,68(4):1827-1836.
[10] Fazenda M L.Effects of dissolved oxygen on fungal morphology and process rheology during fed-batch processing of Ganoderma lucidum[J].J Microbiol Biotech,2010,20(4):844-851.
[11] Park E Y,Koike Y,Higashiyama K.et al.Effect of nitrogen source on mycelial morphology and arachidonic acid production in cultures of Mortierella alpina[J].J Biosci Bioeng,1999,88(1):61-67.
[12] Koike Y,Cai H J,Higashiyama K,et al.Effect of consumed carbon to nitrogen ratio on mycelial morphology and arachidonic acid production in cultures of Mortierella alpina[J].J Biosci Bioeng,2001,91(4):382-389.
[13] Totani N,Hyodo K,Ueda T.Minerals essential for growth of the filamentous fungus,Mortierella alpina[J].J Jpn Oil Chem Soc,2000,49(6):487-493.
[14] 姚建铭,王纪,王相勤,等.离子注入花生四烯酸产生菌诱变选育[J].生物工程学报,2000,16(4):478-481.
[15] Lu J,Peng C,Ji X J,et al.Fermentation characteristics of Mortierella alpina in response to different nitrogen sources[J].Appl Biochem Biotechnol,2011,164(7):979-990.

