色-质联用技术与有机反应历程教学实践
王秧年,奚忠华
(南京大学 国家级化学实验教学示范中心,江苏 南京 210093)
以1-丁醇、NaBr和浓硫酸为原料制备1-溴丁烷实验所涉及产物的生成反应(机理)为例,将有机化学[1-2]理论课中的知识点进行梳理并形成知识网络,对于理解和灵活运用这些知识是非常必要的。在实验过程中穿插相关物质形成历程的分析、或者在理论教学中穿插手性色谱及其与质谱联用等新型分析技术在有机合成产物全分析与鉴定中的最新进展[3-8],有助于学生更深刻的理解、学习有机化学。
手性化合物的合成、分离和分析鉴定越来越受到重视,手性柱高效液相色谱(HPLC)技术被广泛使用,但在复杂组分或未知组分的定性和定量分析等方面存在明显不足,手性柱气相色谱-质谱联用(GC-MS)技术是解决这些问题的有效手段之一。手性柱GC-MS技术有助于加深对相关理论知识的理解和深化。
“正溴丁烷的制备”是有机化学实验教学的经典实验之一[9]。采用普通毛细管柱 GC-MS[10-12],在合成产物中除主产物1-溴丁烷外,还检出了一定量的2-溴丁烷和二溴代产物(2,3-二溴丁烷和1,2-二溴丁烷)等副产物[12]。从立体化学可知,这些含溴副产物均含有手性碳原子。本文试图用手性柱GC-MS技术对1-丁醇制备的溴代产物进行全分析,建立相关知识网络,激发学生学习有机化学的兴趣。
1 实验
1.1 溴代丁烷的合成
溴代丁烷的合成参见参考文献[9]。
1.2 实验仪器及条件
仪器:GCMS-QP2010/PLUS (SHIMADZU,四极杆质谱检测器);色谱柱:HP-CHIRAL-20B,30m×0.25mm×0.25μm。
条件:载气为 He(99.999﹪);柱流量为1.00 mL/min;进样口温度为200.0℃;接口温度为200.0℃;质谱温度为200.0℃;全扫描,扫描范围(质/荷)为50.0~200.0amu;进样量为0.20μL。
1.3 实验步骤
配制溴代丁烷合成产物的甲醇溶液:用1.00μL注射器移取0.50μL溴代丁烷合成产物,加入到盛有1.00mL的HPLC级甲醇的2.5mL小样品管中,混合均匀备用;待GC-MS联用仪稳定后,用1.00μL进样器吸取0.20μL合成产物的甲醇溶液进样。GC程序升温分析条件:以0.50℃/min升温速率从38.0℃升温到42.0℃,以60.0℃/min的速率升温到102.0℃,以0.50℃/min的速率升温到107.0℃,以60.0℃/min的速率升温到200.0℃并保温2min。为便于比较,采用原始色谱图丰度信号除以最强峰(1-溴丁烷)丰度信号对色谱图进行归一化。
2 结果与讨论
2.1 1-溴丁烷合成产物的手性柱GC-MS全分析结果
在上述色谱条件下,对合成产物的甲醇溶液进样分析,得到的色谱图见图1。在图1中可以清楚地看到,这些产物实现了有效分离。借助质谱对这些色谱峰进行定性归属:保留时间为6.053、6.154、8.159、13.048、13.628、13.700、13.978min的色谱峰依次归属为R-2-溴丁烷、S-2-溴丁烷、1-溴丁烷、2,3-二溴丁烷内消旋体(meso-2,3-二溴丁烷)、(2S,3S)-2,3-二溴丁烷、(2R,3R)-2,3-二溴丁烷和1,2-二溴丁烷。以峰面积归一化法求得各组分的含量依次为1.40、1.38、96.25、0.39、0.18、0.17、0.24%。其中有两对峰面积几乎相等的色谱峰分别对应2-溴丁烷的一对外消旋体(R-2-溴丁烷和S-2-溴丁烷)和2,3-二溴丁烷的一对外消旋体((2S,3S)-2,3-二溴丁烷与(2R,3R)-2,3-二溴丁烷)。
2.2 1-丁醇溴代产物的形成历程
2.2.1 一溴代丁烷的可能形成历程
1-丁醇质子化产生n-C4H9—OH28,—OH28是很好的离去基团,体系中大量存在的Br-从—OH28背面进攻,按SN2历程生成构型翻转的1-溴丁烷主产物[1-2](见图2)。n-C4H9—OH28可以发生脱水反应生成少量非常不稳定的n-C3H7CH28伯碳正离子,通过碳正离子重排反应生成稳定性较高的C2H5CH8CH3仲碳正离子[1-2];Br-从sp2杂化的C2H5CH8CH3分子平面上方和下方进攻,按SN1机理生成少量R-和S-2-溴丁烷外消旋体(主要副产物),二者含量是相等的[1-2,13-16](见图2),与图1的实验结果一致。
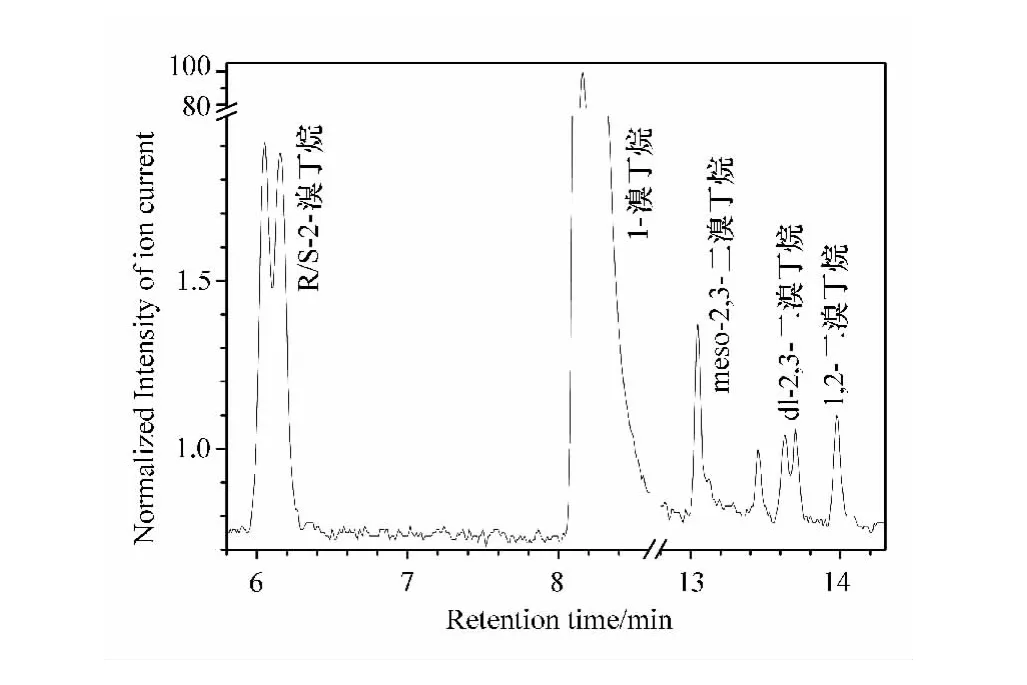
图1 1-溴丁烷合成产物在手性柱上的GC图及相应色谱峰的MS指认
2.2.2 二溴丁烷的可能形成历程
n-C4H9—OH28可直接发生消除反应生成少量1-丁烯;C2H5CH8CH3仲碳正离子也可脱去质子,生成少量1-丁烯、顺(cis或Z)-和反(trans或E)-2-丁烯[1-2]。这3种烯烃可进一步与由浓硫酸和溴化氢反应生成的少量Br2反应[15]。1-丁烯与Br2反应生成两种溴鎓离子中间体,然后Br-从溴鎓离子背面进攻1位或2位的碳原子,生成R-和S-1,2-二溴丁烷外消旋体,二者含量应相等。顺-2-丁烯与Br2反应生成一种溴鎓离子中间体,然后Br-从溴鎓离子背面进攻2位或3位的碳原子,生成(2S,3S)-和(2R,3R)-2,3-二溴丁烷外消旋体(dl-),二者含量应相等。反-2-丁烯与Br2反应生成两种溴鎓离子中间体,然后Br-从溴鎓离子背面进攻2位或3位的碳原子,生成(2R,3S)-2,3-二溴丁烷内消旋体(meso-)[1-2]。
含溴副产物包括:R-和S-2-溴丁烷外消旋体、R-和S-1,2-二溴丁烷外消旋体、(2S,3S)-和(2R,3R)-2,3-二溴丁烷外消旋体(即dl-2,3-二溴丁烷)、(2R,3S)-2,3-二溴丁烷内消旋体(即meso-2,3-二溴丁烷)。
根据图2所示的从1-丁醇制备1-溴丁烷和含溴副产物形成历程可知,共有1-溴丁烷主产物和7种含溴副产物。在非手性柱GC-MS上应有1个主色谱峰(1-溴丁烷)和4个小色谱峰(2-溴丁烷、meso-2,3-二溴丁烷、dl-2,3-二溴丁烷、1,2-二溴丁烷),这为我们先前报道的实验结果所证实[12];在手性柱GC-MS上应有1个主色谱峰(1-溴丁烷)和7个小色谱峰(R-2-溴丁烷、S-2-溴丁烷、(2R,3S)-2,3-二溴丁烷、(2S,3S)-2,3-二溴丁烷、(2R,3R)-2,3-二溴丁烷、R-1,2-二溴丁烷、S-1,2-二溴丁烷),其中3对外消旋体的每一对外消旋体的色谱峰面积应相等,这与在图1所示的手性柱GC-MS色谱图相吻合。

图2 以1-丁醇、NaBr和浓硫酸为原料制备1-溴丁烷及含溴副产物生成过程示意图
3 结束语
采用手性柱色-质联用实验技术对经典有机化学实验“正溴丁烷的制备”的合成产物进行了全分析,通过整合分散在有机化学各相关章节的理论知识,理解和阐释了这些产物的形成历程。藉此,建立了相关知识网络,大大拓展了该经典有机化学实验的深度和广度,极大地激发了学生学习有机化学的兴趣。
(
)
[1]胡宏纹.有机化学[M].3版.北京:高等教育出版社,2005.
[2]邢其毅,裴伟伟,徐瑞秋,等.基础有机化学[M].3版.北京:高等教育出版社,2005.
[3]杨正华,张桂琴,丁孟贤.一种新型气相色谱手性固定相的制备及其对结晶外消旋体的拆分[J].分析化学,1996,24(8):869-872.
[4]孙言才,屈建.色谱新技术在体内药物分析中的应用[J].中国新药杂志,2004,13(11):973-977.
[5]Dennis R.手性异构体的色谱分离[J].李临,译.国外医学:药学分册,1987(5):303-305.
[6]王将克,钟月明,罗红红,等.化石中氨基酸对映体的气相色谱分析[J].实验技术与管理,1987,4(5):19-21.
[7]冯晓,宋国新,胡耀铭.GC-MS法测定亚麻籽中脂肪酸含量[J].实验技术与管理,2011,28(11):278-279.
[8]周永莉,王琳玲.土壤中氯苯类有机污染物的分析实验[J].实验技术与管理,2010,27(11):65-66.
[9]南京大学化学化工学院有机化学实验室.有机化学实验讲义[M].南京:南京大学,2008:38-39.
[10]本杰明J贾津诺威兹,迈克尔J贾津诺威兹,霍勒斯F马丁.气相色谱仪-质谱计联用分析系统[M].罗时豫,周宝虹,傅文彦,译.北京:机械工业出版社,1982.
[11]杨成对,吴筑平,刘密新,等.绿色标志产品电冰箱中CFCS及其替代物的GC/MS分析研究[J].实验技术与管理,1999,16(1):11-15.
[12]王秧年,陆大东,叶涛,等.色谱-质谱联用仪在1-溴丁烷教学实验中的应用[J].实验技术与管理,2011,28(12):63-65.
[13]刘戎,王佐成.1-溴丁烷的制备过程中2-溴丁烷生成机理的探讨[J].吉林师范大学学报:自然科学版,2010(3):51-54.
[14]李锦辉.1-溴丁烷制备过程机理探讨及现象的分析[J].龙岩学院学报,2008,26(3):68-69.
[15]莫建军.1-溴丁烷制备实验中副产物的产生机理及分析[J].丽水师范专科学校学报,2001,23(5):30-31.
[16]侯琳娜.提高1-溴丁烷制备实验效果的方法与措施[J].广东化工,2008,35(3):27-28.

