新型介孔二氧化硅纳米微球/羟基磷灰石/生物玻璃复合生物涂层的体外理化特性*
邓元 郭翔*
论著·实验研究
新型介孔二氧化硅纳米微球/羟基磷灰石/生物玻璃复合生物涂层的体外理化特性*
邓元 郭翔*
目的本实验设计制备了介孔硅纳米微球(mesoporous silic ananoparticulate,MSN)/羟基磷灰石(hydroxyapatite, HA)/生物玻璃 (bioactive glass,BG)复合生物涂层。并对其加载唑来膦酸 (Zoledronic acid,ZOL)后的体外药物释放特性进行了研究。方法通过扫描电镜、透射电镜及能谱仪等方法观察H/M涂层表征。通过高效液相色谱法进行HA/MSN/BG、HA/MSN及HA生物涂层体外ZOL加载及释放的比较。结果通过扫描电镜观察HA/MSN涂层,发现其具有二氧化硅微球组成的多孔结构。体外药物实验中H/M比HA载药量大更且与初始药物浓度相关,并具有药物缓释的特性,涂布BG后缓释效应更加明显。结论 H/M/B因其具有载药量大及药物缓释特性,为生物涂层内固定物在骨折愈合上的应用提供了新技术。
二氧化硅纳米微球;生物玻璃;唑来膦酸;理化特性;药物释放
生物涂层覆盖技术给内固定后骨折不愈合带来了新的机遇。近十年来,在人工髋关节假体涂层成功应用的基础上,各种具有良好生物相容性并能够携带生长因子(IGF,TGF)、骨形态发生蛋白(BMP)等具有刺激骨愈合的活性物质的内固定涂层逐渐被应用于长骨内固定物表面。
已有研究表明唑来膦酸 (Zoledronic acid,ZOL)作为一种分子量小、价格经济且易于获得的药物局部作用于骨折部位时可在产生很少副作用的情况下发挥其抑制破骨细胞的功能,从而促进骨折的愈合。同时我们发现一种新的生物活性的介孔材料-介孔硅纳米微球 (mesoporous silica nanoparticulate,MSN)与传统无机及有机高分子药物载体材料相比具有药物装载量大、缓释释放附着牢固且无毒无害等优点,为了增强器缓释释放的特性,从而对破骨细胞达到有效抑制,我们设计了一种能加载ZOL的HA/MSN/BG新型复合生物涂层。本实验对新型介孔二氧化硅微球/羟基磷灰石/生物玻璃复合生物涂层 (HA/MSN/BG)的表征及体外药物释放特性进行了研究,以期为该生物涂层的临床应用提供理论依据。
1 方法及材料
1.1 材料
用直径2.0mm、长230mm的不锈钢Kirschner(上海浦东金环医药公司)作为涂层载体。以APS系统(瑞士Sulzer Metco公司)利用表1中最优化的喷雾参数对载体用颗粒大小15~50 m HA粉末 (瑞士Sulzer Metco公司)进行涂布,得到HA涂布的不锈钢Kirschner样品(HA-w)。利用扫描电镜、能谱仪及小角XRD衍射和透射电子显微镜(TEM),对已制备的H/M复合涂层样品进行表征分析。

表1 等离子喷涂参数
1.2 制备MSNs/HA复合涂层
将涂有HA的不锈钢kirschner剪成0.5cm长的小段浸泡在5ml(1mol/L)HCl中1分钟并用去离子水洗涤后备用。用10段处理过的样品放入16ml乙醇溶液中,并加入0.2ml (质量分数10%)的十六烷基三甲基溴化铵 (CTAB)溶液。随后加入4ml去离子水水及0.5ml氢氧化钠溶液 (0.1mol/L)并轻轻搅拌,再向混合溶液中逐滴加入2ml乙醇稀释的正硅酸乙酯(TEOS)硅前体。整个反应在37℃下维持24小时后将样品取出,用去离子水洗涤并干燥。最后以用马弗炉以2℃/min的升温速度对样品进行煅烧4小时,除去涂层中的表面活性剂,制备成HA/MSNs复合涂层样品 (H/M-w)。
1.3 MSNs/HA复合涂层表征研究
通过用扫描电子显微镜 (SEM,FEIQuanta450)观察样品的表面形态学特征来确定整个涂布反应不同阶段的样品表征。不同涂层的复合物样本用能谱仪 (EDS)进行检验。用透射电镜 (TEM,JEOL2010)观察和分析从H/M-w上轻刮下来的HA/MSN复合涂层粉末。通过对HA/MSN与HA两种涂层样本进行N2吸附/解离实验,用付利叶红外变换光谱(FI-IR)分析记录 N2浓度并绘制等温曲线,进一步对 HA/ MSN涂层粉末的表征进行测量分析。
1.4 唑来膦酸装载及体外药物释放实验
将唑来膦酸原药 (江苏正大天晴药业有限公司)溶解于超纯水中形成 5、10、20 M/ml三种浓度的混合溶液。将HA-w及 H/M-w分别浸泡在10ml各浓度的混合液中3天(共取3组含不同浓度梯度的溶液,一组=三种浓度溶液中各放4段0.5cm的HA-w样品,另一组溶液中各放4段0.5cm的H/M-w样品,最后一组溶液仍各放4段0.5cm的H/M-w样品),以获得唑来膦酸药物装载。剩余溶液保留并进行进一步检查。采用溶胶-凝胶工艺制备生物玻璃溶胶[1]。把一定比例的正硅酸四乙酯 (TEOS)置入烧杯,加入无水乙醇稀释,待搅拌均匀后,依次加入磷酸三乙酯(TPE)、四水硝酸钙 [Ca(NO3)2·4H2O]、去离子水和硝酸,继续搅拌1小时后,把配好的均匀溶液置放于室温环境下陈化2天,通过水解缩聚反应配制成适于涂层的组成范围为(mol%):CaO 16~21,P2O54,SiO275~80的溶胶溶液。将在最后一组溶液中加载了ZOL的H/M涂层样本浸入溶液中10秒钟,然后迅速拿出、甩干残留溶液,并在37℃下,利用循环真空脱气法使该复合物进一步稳定。最终获得ZOL加载的的HA/ MSN/BG的复合涂层样本。
取0.5cmHA-w、H/M-w及H/M/B-w样品放入3ml37℃且浓度0.01mol/L的磷酸盐缓冲液 (PBS)中,在事先设定好的时间节点吸取少量缓冲液,并用预热过的新鲜的缓冲液进行补充,经样品前处理后通过高效液相色谱仪 (HPLC, Agilent1260)进行检测(共用不同涂层的各4段0.5cm样品实验4次,数据求平均值)。技术参数为C18装样柱(200mm ×4.6mm,5 m),流率1ml/min,215nm紫外线检测。流动相为用磷酸滴定的 PH为6.8的25%氰化甲烷及75%缓冲液(8mmol/LNa4P2O3,20mmol/L四丁基铵氢氧化物,TBHA)的混合液。
1.5 统计方法
2 结果
2.1 形态学及显微结构特征

图1 H/M-w涂布过程中不同阶段样品的表征的ESM图像。(a)裸钢丝表面;(b)HA等离子喷涂后的钢丝表面由于覆盖了致密的微粒而变得粗糙;(c)稀HCL预处理后的HA-w表面出现了易于MSN附着的缺损及孔洞;(d)H/M-w表面大量MSN已逾期的效果彼此交联并稳固的结合于事先建立好的缺损及孔洞中


图2 (a)刮下来的H/M-w涂层粉末的TEM图像;(b)放大的纳米微球TEM图像显示了其具有的无序及不均匀的微孔结构,相对应面积的EDS光谱分析;(c)黄色框内,EDS检测的结果显示涂层粉末具有典型的Ca,P,Si和O峰提示谷曾物粉末成分为HA/MSN;(d)红色框内,EDS光谱显示了纳米微球为纯Si-O组成
SEM记录了HA/MSN涂布过程中不同阶段样品的表征(图1)。为了获得更多的微观结构信息,我们将最终的生物涂层刮下来并利用透射电镜 (TEM)观察。(图2)检测结果显示涂层物粉末是一种不规则的晶体化HA微粒及硅纳米微球的混合物。对两种涂层样品进行N2吸附/解离实验,利用FI-IR检测N2的浓度而绘制的等温曲线也显示了一致的结果(图3,彩图见插页)。我们通过N2吸附/解离等温线对H/M-w涂层粉末的物理性质及微球的结构进行了记录和分析并与HA-w涂层粉末进行了比较。(图 3)通过曲线解离支计算HA/MSN涂层样本中纳米微球颗粒的孔径大概在2.5nm左右,测得的BET比表面积为97m2/g。

图3 H/M-w涂层粉末(红)和HA-w涂层粉末(黑)的N2吸附/解离等温线及H/M-w涂层粉末微孔孔径分布(嵌入图)
2.2 药物装载及释放
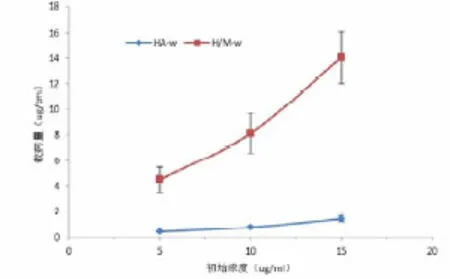

图4 (a)不同起始ZOL浓度下的药物装载量;(b)37℃PBS中不同时间、不同药物装载量的HA-w、H/M-w及H/M/B-w的药物释放曲线
在我们的研究中MSN承担了装载ZOL药物分子的作用。我们记录了在H/M-w及HA-w中不同起始ZOL溶液浓度与装载药物量之间的关系(图4a,彩图见插页),用HPLC测量并记录的HA-w、H/M-w及H/M/B-w特定的不同时间点释放入PBS中的ZOL浓度,形成药物释放曲线。(图4b,彩图见插页)
3 讨论
近十年来,随着生物涂层技术人工髋关节上的成功应用[2,3],装载各种生物活性成分的生物涂层内固定材料也纷纷兴起,如装载生长因子(IGF,TGF)[4,5]、骨形态发生蛋白(BMP)[6]等。但这它们均存在分子量较大,在有限的涂层载体中,载药量较少,药物剂量可调区间有限,功效较差;且费用昂贵,获得困难,不适合大范围的临床使用等缺点。第三代双磷酸盐唑来膦酸,是一种有力的破骨细胞骨吸收抑制剂[7-9]。研究表明唑来膦酸通过同时刺激成骨细胞分泌骨保护素和抑制NF-B配体的受体激活剂的形成来平衡骨质吸收[10]。有研究表明在内固定物周围局部释放唑来膦酸可以起到稳定内固定物并增加机械稳定性的作用[11-13]。最近,有作者提出ZOL的这种作用与其延迟了原始骨痂的塑性有关:即在骨折修复早期,高浓度ZOL仅抑制破骨性骨重吸收作用,并不抑制破骨细胞的增殖,导致原始骨痂转变为成熟骨痂的过程推迟,从而避免在骨性连接形成前原始骨痂被过早的清除,不断累积的原始骨痂为骨折端的修复重建创造了良好的力学稳定性;在骨折修复中、后期,随着ZOL的浓度逐渐减低,被抑制的破骨性骨重吸收作用逐渐恢复,原始骨痂塑性恢复正常,成熟骨痂不断形成,从而进一步加强骨折端的力学稳定性[14]。
近年来最为常用的内固定物涂层材料就是羟基磷灰石(HA)[15-18],之前的研究表明作为药物载体HA与ZOL之间是通过化学键进行结合[19],但这种结合在溶液中势必导致药物的释放无法控制。同时,生物可降解聚合材料也被研究应用于作为内固定物的表面改造材料,如聚甲基甲丙烯酸盐(PMMA)[20],聚乳酸 (PLA)[21,22],多聚羟基乙酸 (PGA)[23]及他们的共聚物。如ZOL之类的药物均需要通过溶解于有机溶剂来附着于多聚物的表面,从而形成药物加载的内置物。但由于有机溶剂的使用势必会带来毒性作用或者对药物活性产生抑制。而且近期的研究表明,生物可降解聚合材料的酸性降解产物会打破其周围内环境的酸碱平衡,从而导致对骨折愈合不利的继发炎症的产生[24,25]。多孔材料作为药物释放载体已经有10余年的研究历史[26-28],以多孔氧化钛[29]、氧化多孔硅[30,31]及多孔生物玻璃[32]研究的最多。其具有多项适合作为体内药物释放载体的优点,同时多孔介质的涂布是在蒸发过程中实现的自装配过程[33]。在单纯多孔材料涂层上,由于涂层很薄且药物与之结合很弱,导致其药物装载量受限[34]。由于没有另外的涂层包裹,所以弱结合的药物易于快速的解离释放,难以控制药物的释放。所以如何加大载药量及控制药物释放仍然是生物涂层面技术临的挑战。
在我们的研究中,如图3显示的HA及HA/MSN粉末的氮吸附/解离等温线。HA/MSN等温线在P/P0为0.2左右时显示了一个小的满孔跳跃,相比之下纯HA包被物未显示出明显的"满孔跳跃"。由于微孔结构的存在使HA/MSN涂层的BET比表面积明显增大,约为HA包被物粉末的10倍。这种特性为药物的吸附提供了更多的空间,从图中就可明显看出单位质HA/MSN的N2吸附量明显超过HA。如我们所期望的,图4显示了H/M-w的ZOL药物装载量明显高于HA-w。正如之前的文献中提到的HA与ZOL以化学键的形式结合,所以HA-w的表面积限制了ZOL与之大量结合。但是微孔结构极大地扩大了与ZOL相结合的面积。而且ZOL与HA-w及H/M-w的结合为初始浓度相关,即提高ZOL的浓度可以增大装载量。例如,H/M-w浸入在20 g/ml的ZOL溶液中可以装载14.06g/cm的药物量,但在5g/ml的溶液中就只能装载4.48 g/cm。我们推测这是由于溶液浓度更大时对ZOL分子进入微孔有更大的驱动力导致的。如之前的文献中所提到的,HA-w中的ZOL几乎在3天内全部释放完[11]。相比之下H/M-w显示出了更加持久的药物释放特性。以H/M-w-10为例,在第1天其几乎喷发性的释放了约50%的药物装载量。这种喷发性的释放可能是由于附着在HA表面以及在微球表面的药物解离。然而即便如此,H/M-w喷发性释放的百分率仍然明显小于HA-w,这归功于微球对于药物分子的保持作用。H/M-w样品在剩余的30%的药物释放过程中则显示出明显的持续性缓慢释放的特征,并一直持续了10天以上。
我们在之前的研究中[35]已发现在 -磷酸三钙 (-TCP)的微孔表面涂布介孔二氧化硅微球 (MSN),并在药物加载后在MSN/-TCP复合体上覆盖一层生物玻璃可以进一步增加该复合体的药物缓释时间。在此次的药物释放实验中,我们也发现当在加载了ZOL的H/M-w样品上涂布生物玻璃后其药物释放的缓释特性明显增强,药物释放时间明显延长。我们认为生物玻璃覆盖涂层的方法使介孔开口部分封闭,延缓药物由孔道内向外释放的速度,进一步提高了复合涂层的药物缓释作用。同时我们发现在整体药物释放百分率比较接近的情况下,最初装载的药物越多在最初阶段的药物释放率就要更快。这可能意味着起始药物浓度越高进入微孔中的药物量越少。微球形成的微孔加上生物玻璃能够同时提高药物装载量并能够保存药物分子使之缓慢释放,而这正与我们想要利用ZOL局部浓度"早高晚低"从而抑制破骨作用并且促进成骨作用的目的相一致。
综上所述,HA/MSN/BG复合涂层具有载药量大、附着牢固及价格经济等优点,加载ZOL后不仅能够进行局部药物缓慢释放,并且其释放特性也复合ZOL药物的作用特点,且ZOL相比生长银及骨形态发生蛋白等价格便宜,易于取得和大规模临床应用。这将为生物涂层复合内固定物在骨折愈合方面的临床应用开辟新的领域,为临床上更多具有内固定后骨不连高风险的患者提供更加适合的治疗选择。但本实验作为初步的探索仅仅针对HA/MSN/BG的表征及体外理化特性进行了研究,并未对其在体外如何影响成骨细胞、抑制骨吸收及细胞毒性等方面进研究,我们将在今后的后续实验当中对这些方面的问题进行深入细致的探究,并通过在体动物实验验证该复合生物涂层的促进骨折愈合的作用。
[1] 王传辉,秦景燕.溶胶凝胶生物活性玻璃涂层的制备及生物活性的研究[J].陕西科技大学学报,2004,10,5:144-147.
[2] Paglia DN,Wey A,Breitbart EA,et al.Effects of local insulin delivery on subperiosteal angiogenesis andmineralized tissue formation during fracture healing.J Orthop Res,2013,31(5):783-791.
[3]WuKM,SongW,ZhaoLZ,et al.Micro RNA Functionalized Microporous Titanium Oxide Surface by Lyophilization with Enhanced Osteogenic Activity.AcsAppl MaterInter,2013,5(7):2733-2744.
[4] Wildemann B,Kadow-Romacker A,Lubberstedt M,et al.Differences in the fusion and resorption activity of humanosteoclasts after stimulation with different growth factors released from a polylactidecarrier.Calcified Tissue Int,2005,76(1):50-55.
[5] Wildemann B,Lubberstedt M,Haas NP,et al.IGF-I and TGF-beta 1 incorporated in apoly(D,L-lactide)implant coating maintaintheir activity over long-term storage-cellculture studies on primary human osteoblast-like cells.Biomaterials,2004,25(17):3639-3644.
[6] Baltzer AWA,Lattermann C,Whalen JD,et al.Genetic enhance-ment of fracturerepair:healing of an experimental segmental defect by adenoviral transfer of theBMP-2 gene.Gene Ther,2000,7 (9):734-739.
[7] Reinholz GG,Getz B,Pederson L,et al.Bisphosphonates directly regulate cell proliferation,differentiation,and gene expression in human osteoblasts.Cancer Res,2000,60(21):6001-6007.
[8] Teitelbaum SL.Bone resorption byosteoclasts.Science,2000,289 (5484):1504-1508.
[9] Rogers MJ,Crockett JC,Coxon FP,et al.Biochemical and molecular mechanisms of action of bisphosphonates.Bone,2011,49 (1):34-41.
[10]Hofbauer LC,Gori F,Riggs BL,et al.Stimulation of osteoprotegerin ligand and inhibition ofosteoprotegerin production by glucocorticoids in human osteoblastic lineage cells:Potential paracrine mechanisms of glucocorticoid-induced osteoporosis.Endocrinology,1999,140(10):4382-4389.
[11]Gao Y,Zou SJ,Liu XG,et al.The effect of surfaceimmobilized bisphosphonates on the fixation of hydroxyapatite-coated titaniumimplants in ovariectomized rats.Biomaterials,2009,30(9):1790 -1796.
[12]Wermelin K,Suska F,Tengvall P,et al.Stainless steel screws coatedwith bisphosphonates gave stronger fixation and more surrounding bonehistomorphometry in rats.Bone,2008,42:41.
[13]Greiner S,Kadow-Romacker A,Wildernann B,et al.Bisphosphonates incorporated in a poly(D,L-lactide)implant coating inhibitosteoclast like cells in vitro.J Biomed Mater Res A,2007,83(4): 1184-1191.
[14]GreinerSH,et al.Localapplication of zoledronic acidincorporated in a poly(D,L-lactide)-coated implant accelerates fracture healing in rats.ActaOrthop,2008,79(5):717-25.
[15]Kadow-Romacker A,Greiner S,Schmidmaier G,et al.Effectof beta-tricalcium phosphate coated with zoledronic acid on human osteoblasts andhuman osteoclasts in vitro.J BiomaterAppl,2013, 27(5):577-585.
[16]Niu S,Cao XR,Zhang Y,et al.Peri-implant and systemic effectsof high-/low-affinity bisphosphonate-hydroxyapatite composite coatings in a rabbitmodel with peri-implant high bone turnover. BmcMusculoskel Dis,2012,13.
[17]唐旭,雷云坤,孟增东.壳聚糖/纳米羟基磷灰石(CS/nHA)复合材料修复骨缺损研究进展.生物骨科材料与临床研究,2012,9,5:20-22,25.
[18]任婷婷,姚金波,李瑞欣.纳米羟基磷灰石/丝素蛋白复合支架的制备工艺.生物骨科材料与临床研究,2012,9,5:23-25.
[19]Boanini E,Torricelli P,GazzanoM,et al.The effect of zoledronatehydroxyapatite nanocomposites on osteoclasts and osteoblast-like cells invitro.Biomaterials,2012,33(2):722-730.
[20]Bostman O,Pihlajamaki H.Clinical biocompatibility of biodegradableorthopaedic implants for internal fixation:a review.Biomaterials,2000,21(24):2615-2621.
[21]Greiner S,Kadow-RomackerA,Schmidmaier G,et al.Cocultures of osteoblasts and osteoclasts are influenced by local application ofzoledronic acid incorporated in a poly(D,L-lactide)implant coating.J Biomed MaterRes,A 2009,91(1):288-295.
[22]Greiner S,Kadow-Romacker A,Lubberstedt M,et al.The effect of zoledronic acid incorporated in apoly(D,L-lactide)implant coating onosteoblastsin vitro.JBiomedMater ResA 2007,80(4):769-775.
[23]Garvin K,Feschuk C.Polylactide-polyglycolide antibiotic implants.ClinOrthopRelat R,2005,(437):105-110.
[24]Miyai T,Ito A,Tamazawa G,et al.Antibiotic-loaded poly-epsiloncaprolactone and porousbeta-tricalcium phosphate composite for treating osteomyelitis.Biomaterials,2008,29(3):350-358.
[25]Rezwan K,Chen QZ,Blaker JJ,et al.Biodegradable and bioactive porous polymer/inorganic composite scaffolds for bonetissue engineering.Biomaterials,2006,27(18):3413-3431.
[26]Zhu M,Zhang L X,He QJ,et al.Mesoporous bioactive glass-coated poly(L-lactic acid)scaffolds:a sustained antibioticdrug release system for bone repairing.JMater Chem 2011,21(4):1064-1072.
[27]Zhu YF,Ikoma T,Hanagata N,et al.Rattle-Type Fe3O4@SiO2HollowMesoporous Spheres as Carriers for Drug Delivery.Small, 2010,6(3):471-478.
[28]Zhu YF,Meng WJ,Li XL,et al.Design of Mesoporous Silica/Cytosine-Phosphodiester-Guanine Oligodeoxynuc-leotide Complexes ToEnhance Delivery Efficiency.J PhysChem C,2011,115(2): 447-452.
[29]Harmankaya N,Karlsson J,Palmquist A,et al.Raloxifene and alendronate containing thin mesoporoustitanium oxide films iprove implant fixation to bone.ActaBiomater,2013,9(6):7064-7073.
[30]Ehlert N,Badar M,Christel A,et al.Mesoporous silica coatings forcontrolled release of the antibiotic ciprofloxacin from implants. J Mater Chem,2011,21(3):752-760.
[31]Ehlert N,Mueller PP,Stieve M,et al.Mesoporous silica films as a novel biomaterial:applications in the middle ear.ChemSoc Rev, 2013,42(9):3847-3861.
[32]Wang XP,Li X,Onuma K,et al.Mesoporous bioactive glass coatings on stainless steel for enhanced cell activity,cytoskeletal organization and AsMg immobilization.J Mater Chem,2010,20 (31):6437-6445.
[33]Brinker CJ,Lu YF,Sellinger A,et al.Evaporation-inducedself-assembly:Nanostructures made easy.Adv Mater,1999,11(7):579.
[34]Karlsson J,Jimbo R,Fathali HM,et al.In vivo biomechanical stability ofosseointegratingmesoporous TiO2implants.ActaBiomater,2012,8(12):4438-4446.
[35]Zhu M,et al.A mesoporous silica nanoparticulate/beta-TCP/BG composite drug delivery system for osteoarticular tuberculosis therapy.Biomaterials,2011,32(7):1986-1995.
In vitro characterizations of novel mesoporous silica nanoparticles/hydroxyapatite/bioactive glass composite coat
Deng Yuan,Guo Xiang*.Chang Zheng Hospital,Secondary Military Medical University,Shanghai 200003,China
Objective The use biological coat in inner fixation is a new star of healing fracture and bone nonunion.In an attempt to improve implant-bone integration and accelerate bone fracture healing,we prepared a novel mesoporous silica nanoparticulate/hydroxyapatite/bioactive glass composite coat.Characterizations and drug release characters which was loaded with Zoledronic acid was investigated in our experiment.Methods Characterizations of H/M coating was investigated by SEM,TEM and EDS.The H/M/B composite coat was contrasted with HA coat in the drug load and release experiment by HPLC.Results Pictures of SEM and TEM show that innumerable micropores was formed by silica nanoparticulates on the H/Mcoat.Bigger drug load and sustained release of drug was observed compared to HA coat.Sustained releasing was more obvious when H/M was coated by bioactive glass.Conclusion The novel composite coat had a series merits compared to actual biological coat like big load of drug,sustained drug release,economic and non-toxic.It gave us a new choice of inner fixation to deal with fracture in the future.
Mesoporous silica nanoparticulate;Bioactive glass;Zoledronic acid;Characterizations;Drug release
R318.08
A
10.3969/j.issn.1672-5972.2014.05.003
swgk2014-02-0020
邓元(1987-)男,博士,医师。研究方向:骨科生物材料。
*[通讯作者]郭翔(1978-)男,博士,主治医师。研究方向:骨科生物材料。
2014-02-17)
国家自然科学基金(81101343),上海市卫生局科研基金(基金号2011254)
第二军医大学附属长征医院,上海 200003

