抗菌型纳米纤维膜的释药及生物相容性研究*
石锐薛佳佳曹晶晶郭建勋王宏刚陈大福田伟*
论著·实验研究
抗菌型纳米纤维膜的释药及生物相容性研究*
石锐1,3薛佳佳2曹晶晶1郭建勋1王宏刚1陈大福1田伟1,3*
目的 探讨药物含量对抗菌型纳米纤维膜释药行为、抑菌性能及生物相容性及降解性能的影响。方法 电纺制备聚己内酯 (PCL)/甲硝唑 (MNA)纳米纤维膜 (MNA占PCL的质量比为0、1%、5%、10%、20%、30%及40 wt%),对应编号 P0、P1、P5、P10、P20、P30及 P40。通过高效液相色谱 (HPLC)检测不同载药量样品不同时间段的药物释放量。通过测量载药膜周围抑菌圈的直径来表征膜的抗菌性能。四唑盐比色法 (MTT)测试测试细胞毒性。细胞计数Kit-8法 (CCK-8)评价小鼠成纤维细胞L929在不同膜表面粘附及增殖情况。通过兔皮下埋植,伊红苏木素(H&E)染色切片及扫描电镜 (SEM)观察不同膜的组织相容性及降解性能。结果 药物释放具有1周内突释,后逐渐缓释的特点。药物含量5%以上样品1天后开始呈现抑菌圈,且持续抑菌时间达30天。随药物含量增加,抑菌圈直径增加。载药膜具有良好的细胞相容性,其中 P30的细胞相容性最好。加载药物能够提高组织相容性及降解速率。结论 PCL/MNA纳米纤维膜具有良好的抑菌性能及生物相容性。P30的综合性能最佳。
电纺;聚己内酯;甲硝唑;抗菌
感染被认为是引发植入体内生物材料失效的主要原因。据报道约有22%的翻修手术是为了治疗由术后感染引发的骨科植入术失败[1]。因此,抗感染型生物材料受关注度日益升高[2,3]。引起感染的原因主要是由于创伤部位存在的病原体和植入生物材料引发的异物反应。因此,抗菌性生物材料在对抗植入物引发感染方面引起了极大地关注[4]。传统的全身给药法需要持续口服高浓度的抗生素从而引发系统毒性以及肝肾负担等副作用。为了使药物到达深处感染组织,并维持有效浓度并规避系统性副作用,急需局部可控药物释放能系统参与[5,6]。因此,研发具有局部可控释放抗菌药物的载药型生物材料具有十分重要的意义。
由于电纺支架固有的高表面体积能促进细胞粘附,提高载药率,并实现局部药物控释[7],因此静电纺丝技术在组织工程及药物释放领域都获得了广泛的关注[8,9]。已有研究将多种生物分子加载到以聚合物为基体的电纺膜中[10-12]。此外,电纺载药膜的药物释放行为及降解速率可以通过静电纺丝工艺参数来调节[13,14]。因此,本研究采用静电纺丝技术来制备加载抗菌剂的纳米纤维膜。
相对于其它常见可降解高分子材料,如胶原、聚乳酸及聚乙醇酸等,PCL具有无免疫源性、降解过程中不产生酸堆积、生物相容性好、柔韧性强、力学强度高、共混相容性好等诸多优点,这些优点使得PCL在生物医用领域有着广泛的应用[15-17]。PCL与多种药物都具有相容性,有利于药物在PCL基体中均匀分散。此外,PCL缓慢的降解速率及高力学强度有利于药物缓释过程中力学性能的维持。因此,PCL非常适合用于药物缓释基体材料[18,19]。PCL是迄今为止报道最多的用于静电纺丝及作为多种药物载体的合成高分子材料[15,20],已经有若干以 PCL为基体的药物释放体系获得FDA及CE认证[15]。因此,本研究拟选用PCL作为加载抗菌药物的纳米纤维膜的基体材料。
较深组织部位的感染往往是由于厌氧菌引起的,甲硝唑(MNA)治疗由厌氧菌引起的感染已有45年历史,已经有研究将PLA/MNA[21]和PLGA/MNA[22]纳米纤维膜用以牙周疾病的治疗并在狗的动物模型试验中取得了良好的效果。虽然有[23]将甲硝唑衍生物甲硝哒唑苯甲酸加载到PCL纳米纤维膜中用于药物缓释体系的报道,但对于药物释放行为、高浓度药物加载对于细胞毒性、粘附与增殖的影响以及体内长期的组织相容性及降解性能还没有深入和系统的报道。
本研究拟开发一种加载抗菌剂的PCL纳米纤维膜材料,具有潜在应用于抗感染型人工骨膜、术后防粘连膜及引导组织/骨再生膜的临床价值。临床实验前,对较宽范围的药物含量 (0~40%w/w)对于膜的药物释放行为、抑菌性能、体外细胞相容性、体内生物相容性及降解性做了相关系统研究。
1 材料和方法
1.1 样品制备
将PCL溶解于二氯甲烷 (DCM)与氮,氮二甲基甲酰胺 (DMF)混合溶液中DCM∶DMF(60∶40v/v),配制成浓度为10wt%的溶液,室温下搅拌24小时。再将占PCL质量1%、5%、10%、20%、30%及40%的MNA加入PCL溶液中,继续搅拌12小时,从而获得均匀的纺丝液。药物含量为0、1%、5%、10%、20%、30%及40%MNA。
1.2 药物释放行为测试
将测试样品裁成直径2 cm的圆片,精确称量后,至于装有5mlPBS的缓冲溶液中,密封,37℃100 rpm条件下震荡,预定时间点取出1 ml溶液,HPLC测试药物释放量。
1.3 抑菌性能
将边长为1.0 cm×1.0 cm的纳米纤维膜样品放入含具核梭杆菌的琼脂培养皿中 (每个培养皿中三个样品)。培养皿置于37℃厌氧环境中,分别于1、4、7、14、21及30取出观察并测量抑菌圈直径。
1.4 体外细胞相容性测试
材料浸提液的制备:将大小20 mm×30 mm的样品,用75%(v/v)酒精清洗后按照3cm2/ml浸泡在37℃的DMEM中24小时,再通过过滤器 (孔径大小0.22 m)过滤获得测试样品的浸提液。
MTT法测细胞毒性:用96板培养L929小鼠成纤维细胞,接种细胞浓度为5×104/ml,24小时后吸去培养液,加入等量材料浸提液,阴性对照用含有10%胎牛血清 (FBS)的 DMEM培养液,分别于24、48及72小时,经5mg/ml MTT和酸化异丙醇处理后,用酶联仪在630nm波长测其吸光度值,取平均值。计算细胞相对增殖率 (relative growth rate,RGR)和细胞毒性分级详见表1。其中 RGR=(试样OD值-空白OD值)/(阴性OH值-空白OD值)。

表1 RGR和细胞毒性分级
CCK-8法测膜表面细胞的粘附及增殖:将直径为2.5cm的样品,消毒后置于24孔培养板底部。L929细胞在含有10%FBS及抗生素(100 g/mL青霉素和100mg/mL链霉素)的DMEM培养基中培养,细胞浓度为4.0×104个/mL。将细胞培养基 (800 L)以及细胞悬液 (100 L)缓慢加入底部铺有材料的孔板中。细胞悬液加入无材料的孔中作为对照组。置于37℃,5%CO2培养箱中4小时后取出,弃去各孔培养基、PBS培养基清洗材料表面未粘附细胞。100 LCCK-8试剂和培养基的混合液 (按1∶10比例)加到清洗过的样品中。培养箱内孵育4小时后,取材料上清液,转移至96孔板中,酶标仪测定各孔在450nm波长的吸光度值。培养1、3、5、7天后,再次通过CCK-8法测试细胞的增殖及活力。此外,加载细胞膜用PBS缓冲液清洗,用3%的戊二醛4℃固定2小时,然后通过蔗糖溶液浸泡以及一系列乙醇脱水步骤并且冷冻干燥12小时,SEM观察膜表面细胞形态。
1.5 体内组织相容性及降解性能测试
将不同样品裁成边长10mm的正方形,CO60消毒。取新西兰大耳白兔25只,体重约2.5kg左右,雌雄不限,随机分为5组,每组5只。采用兔脊柱旁皮下埋植实验,将样品分别植入兔脊柱两侧皮下,在距脊柱中线约25mm处切8mm长的切口,用钝器解剖法在皮肤切口部位制备一个皮下囊,囊底部距缺口距离为10mm,将样片植入囊中后完全展开,缝合伤口。脊柱同侧每个样品之间的距离约15mm。在植入后1、3、8、12、24周后将膜与周边组织一并取出,立刻在4%的福尔马林溶液中固定1周。分别行HE染色组织切片观察和电镜观察。固定样品脱水后石蜡包埋,制成5 m切片,然后通过HE染色制片后,在显微镜下观察。将剩余固定后的样品经过一系列乙醇脱水处理后,充分干燥,表面喷金后用于扫描电镜 (SEM)观察。
1.6 统计学处理
学生t检验用于验证数据间的差异性,置信区间为95%,每个数据点表示为平均值±标准差(±s)。
2 结果
2.1 药物释放行为研究
不同药物含量的纳米纤维膜的药物释放行为如图1所示(彩图见插页)。可见所有纳米纤维膜1周内都达到了近90%或以上的药物释放率,具有前期药物突释特点。药物含量越高,前期释放越快。此后7天内,呈现出逐步缓慢释放的特点。

图1 不同药物含量的PCL-MNA纳米纤维膜不同时间点的累积药物释放量
2.2 抑菌性能
通过具核梭杆菌的生长状况可以直观观察不同MNA含量的纳米纤维膜的抑菌效果,图2(彩图见插页)为培养30天后不同膜周围的抑菌圈照片。不同样品在不同时间段抑菌圈的直径大小见图3(彩图见插页)。可见30天后P0和P1的琼脂板完全被细菌所覆盖,但当药物含量≥5%以上时,1天后开始呈现抑菌圈,且持续抑菌时间可达30天。随着药物含量的增加,同时间段抑菌圈直径呈现增长趋势,说明抑菌效果增强。此外,1天后抑菌圈的直径要远大于膜的尺寸,证明了药物的快速扩散性。随着药物的逐渐扩散,药效也逐渐降低,细菌会继续增殖,抑菌圈直径相应减小。但在一个月的培养期内,5%以上药物含量的纤维膜都具有抑制厌氧菌生长的效果。尤其对于P30以及P40来说,1个月之内抑菌圈大小几乎无变化,具有良好的抑菌效果。

图2 37℃无氧条件下孵化30天后不同药物含量膜周围的抑菌圈形貌

图3 不同药物含量纳米纤维膜不同时间段抑菌圈直径
2.3 体外细胞相容性
如图4所示(彩图见插页),在浸提液中培养24小时后,所有载药型 L929细胞的相对增值率均接近甚至高于100%,空白和实验组之间没有明显的统计学差异,证明了纳米纤维膜对L929细胞的生长无负面影响。在浸提液中生长24小时后的 L929细胞基本呈现出梭形、三角形及长方形,证明具有良好的生长状态。所有膜材料的评级均为 0级。之后细胞增殖率略有降低,符合细胞生长周期特点。72小时后,尽管 P40的细胞增殖率降低到80%,但细胞状态良好,且仍然高于未载药及加载1%甲硝唑药物的样品。

图4 L929细胞在不同PCL-MNA纳米纤维膜浸提液中的相对增值率
图5表明粘附在对照组 (TCP)及不同药物含量膜表面4小时后的L929细胞的光密度值 (optical density,OD)。可见L929细胞可在所有的载药膜表面粘附。不同药物含量对粘附细胞的数量几乎无影响,各样本间无统计学差异。材料组表面细胞数略小于由氧化气体等离子处理过的表面亲水性很强的磷酸三钙样品,但依然具有非常良好的细胞粘附特性。

图5 L929细胞粘附于不同PCL-MNA纳米纤维膜表面4小时后的OD值
图6(彩图见插页)表明 L929细胞7天内在膜表面的增殖情况。尽管在载药膜表面的细胞数量小于对照组 TCP表面的细胞数量,但由图6可见L929细胞的数量7天内在膜表面不断增加,再次证明加载MNA的纳米纤维膜对细胞无毒副作用,且对促进细胞增殖具有显著效果。增殖1天后,不同膜上的细胞数量无显著差异。增殖5~7天后,可见P10,P20及P30样品表面的细胞数量明显高于其它样品。
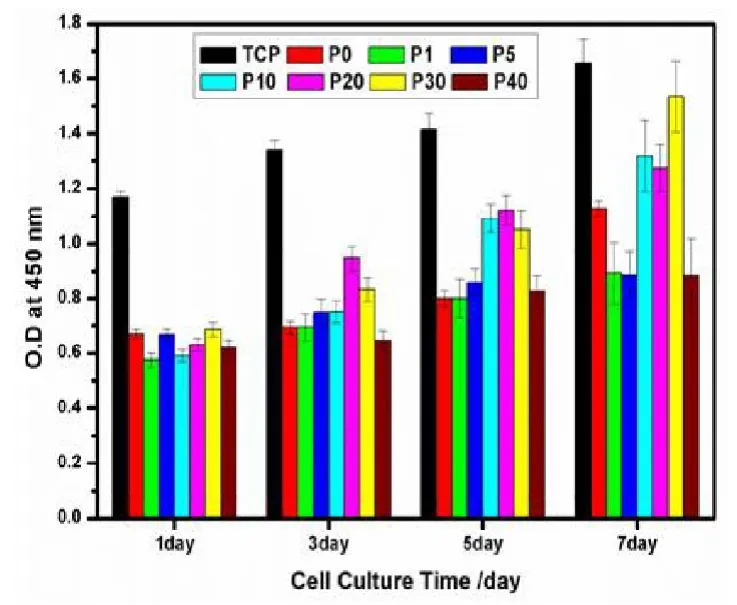
图6 L929细胞在不同PCL-MNA纳米纤维膜表面增殖1、3、5、7天后的OD值
图7展示了不同纳米纤维膜表面增殖7天后细胞的形态照片。如图所示,细胞在不同膜的表面都几乎形成了细胞融合层。其中P30的细胞融合率最高,从图中估计大于80%,这与CCK-8得到的P30表面细胞增殖率最高的结论一致。证明当药物含量升高至30%时,药物含量的增加对细胞形态、细胞活力及增值都无影响,但继续增至40%时,细胞活力及增殖能力呈下降趋势。
2.4 体内组织相容性及降解性能
长期皮下埋植实验用来考察药物以及降解产物对组织相容性的影响。在实验过程中,所有兔子生理状况良好,没有发生任何与手术伤口相关的并发症。对所有膜来说,在任意观察时间点无明显的急性及慢性炎症反应,组织坏死,及其它不良组织反应发生。

图7 L929细胞增殖7天后不同纳米纤维膜表面的SEM照片

图8 皮下埋植不同时间段P0和P30的HE染色照片

图9 皮下埋植不同时间段P0和P30的横断面电镜照片
HE染色结果如图8所示(彩图见插页)。术后一周,P0及P30周围均未发现中性粒细胞,表明未载药及载药纳米纤维膜均无明显急性炎症反应发生,膜周围可见少量的单核细胞、血管及肉芽组织。P30周围的细胞浸润数目要小于P0,证明P30的异物反应没有P0明显。组织切片照片显示P0和P30都具有非常好的完整性,但相对于 P0来说,P30的表面已经开始降解,已经有少量组织细胞迁移到P30表面及以下部位,且P30周围的血管及肉芽组织也多于P0。SEM图片可见P0的纤维直径与分布未发生变化,大量血红细胞分布在P30的纳米纤维中,间接证明血管组织的长入。术后3周,膜周围的单核细胞数目增多,肉芽组织,新生微小薄壁血管以及纤维囊也进一步增长,纤维组织进一步向材料内部移行,并伴随出现少量巨噬细胞开始吞噬材料。P0周围的纤维囊厚度略大于P30,而纤维囊厚度越小,证明组织相容性越好。相对于术后1周,膜的降解程度进一步加大。术后8周后,P0被大量的纤维母细胞、单核细胞、多核巨噬细胞、新生血管组织以及肉芽组织所包裹,膜内部已经出现少量空洞,但还没有细胞侵入 P0内部。P30的膜厚度以及纵切面形貌与P0类似,P0和P30在8周内都保持着良好的细胞屏蔽性能。相对于 P0来说,P30周围聚集了更多巨噬细胞,证明MNA的引入具有抑制巨噬细胞聚集的作用。从12周的组织切片可以看出,P0和 P30周围的纤维囊厚度较术后8周都有所增加,而膜自身厚度变薄,证明膜的降解方式以表面降解为主。膜周围的血管组织变得更加丰富。大量的巨噬细胞聚集在膜的周围并吞噬膜的表面。长达24周皮下植入后,P0和P30都保持着良好的完整性,12周之前都未有细胞透过纤维膜。SEM图片显示24周时P0的纤维结构保持非常完好,而P30中的组织细胞较P0多。
3 讨论
可降解膜材料在骨科有着广泛的临床应用前景,如人工骨膜[24,25],术后防粘连[26],引导骨再生(Guided Bone Regeneration, GBR)[27]等。而较深部位的植入物感染是目前手术失效的一个主要原因。因此,我们在生物相容性、力学性能及与药物相容性等综合性能优良的可降解高分子材料—PCL基体中引入抗厌氧菌常用药物MNA,重点研究了不同药物含量对药物释放行为、抑菌性能、体外细胞相容性、体内组织相容性及降解性能的影响。本研究结果将对其临床适用性评价起到十分重要的作用。
药物释放行为是载药膜的一个最重要性能。由于 PCL的水解速率非常缓慢,最初两周在PBS缓冲液中几乎不降解,因此药物释放机理主要以扩散为主。高药物加载量膜比低药物含量的膜显现出更为明显的前期突释现象。这是由于聚集在表面及接近表面的药物先释放,之后才是纤维内部药物扩散到纤维表面附近缓慢释放。随着药物含量的增加,纳米纤维表面MNA的增加,因此药物前期释放速率及释放量也随之增加。此外,随药物含量增加,PCL的结晶度降低,因此,在纳米纤维内部的药物也更容易释放。此外,MNA含量越高,电纺液的导电率越高,因此纺出的纳米纤维的直径就越小,药物扩散路径越短,药物释放速率越快。在这些因素的共同影响下,PCL-MNA载药纳米纤维体系可在一定范围内实现可控释药。
当材料植入组织后,术后1周是感染和炎症的高发期。所以对于释放抗菌剂的材料来说,植入体内后较高的初始释放速率对于对抗术后感染具有良好的效果。考虑到少量细菌还可能在初始释放后继续存活,因此之后持续的药物释放将有利于抑制细菌增殖及预防进一步感染[28]。该 PCL-MNA药物释放体系的释药规律符合感染发生周期特点.
尽管PCL的生物相容性很好,已经通过美国FDA的认证,但药物的局部释放,尤其是局部高浓度的释放,是否会产生细胞毒性并对周围组织产生影响,已经在本研究得到验证。药物占PCL比例从1%至30%时细胞增值率逐渐增加,但继续增至40%时,增值率又有所降低,说明药物含量过高确实会对细胞产生一定副作用。细胞与材料接触、粘附发生在细胞和材料的初始接触阶段,会影响细胞在材料表面的增殖及形态。一般来说,亲水性表面更有利于细胞粘附。由于MNA分子结构中包含羟基及硝基亲水性基团,是一种亲水性药物。因此随着甲硝唑含量的增加,纳米纤维膜的亲水性也增加。因此药物含量在一定范围内的增加有利于细胞的粘附及增殖。此外,在药物含量较高的P20,P30以及P40中,存在团聚的药物晶体颗粒,药物释放过程中会导致这些晶体的暴露,从而引起表面粗糙度的增加,这也是高MNA含量纳米纤维膜较低药物含量纳米纤维膜细胞粘附性好的一个原因[29]。但对于P40来说,MNA在培养基中释放的过快且浓度过高,因此会对细胞的粘附产生一定影响。从亲水性、表面粗糙度以及药物含量对细胞的影响综合考虑,P30最有利于细胞粘附。此外,7天后P30表面的细胞数目较其他载药膜来说最多,细胞融合率最高,甚至与TCP表面的细胞数目相当,再次证明P30更有利于成纤维细胞在其表面的增殖,这对于伤口愈合具有良好的促进作用。
尽管MNA含量的增加直接导致抑菌性能的提高。但由于体外细胞实验证明药物含量高于30%时,对细胞活力会有一定的影响,因此我们选用P30用于动物体内皮下植入实验,从而评价MNA的释放对于异物反应程度以及体内降解性能的影响。由实验结果可见,MNA能够阻止组织细胞、单核细胞及巨噬细胞的聚集,因此,MNA的加入能够降低异物反应的程度。此外,PCL作为可降解植入材料的最大缺陷就是降解时间太长,通常需要2~3年完全降解,而引入MNA后能够极大地提高膜的亲水性,因此能够加速降解速率。但即使加载30wt%的MNA,24周内也能够维持膜的细胞屏蔽性能,使得该载药膜较适合应用于对细胞隔离性能要求比较高的防粘连膜及引导组织/骨再生膜。
总之,抗菌性PCL/MNA纳米纤维膜能够有效释放MNA并抑制厌氧菌的生长,且释放感染发生周期特征。抑菌效果随着药物含量增加而显著。适量MNA的加入能够提高膜的细胞相容性,降低排异反应程度以及提高降解速率。P30的综合性能较优,适合用于人工骨膜基体材料、防粘连膜及引导组织/骨再生膜。
[1] Coello R,Charlett A,Wilson J,et al.Adverse impact of surgical site infections in English hospitals[J].Hosp Infect,2005,62(3): 93-103.
[2] Zilberman M,Elsner JJ.Antibiotic-eluting medical devices for various applications[J].Control Rel,2008,130(3):202-215.
[3] Campoccia D,Montanaro L,Arciola CR.A review of the biomaterials technologies for infection-resistant surfaces[J].Biomaterials,2013,34(34):8533-8554.
[4] Campoccia D,Montanaro L,Arciola CR.A review of the biomaterials technologies for infection-resistant surfaces[J].Biomaterials,2013,34(33):8018-8029.
[5] Feng K,Sun H,Bradley MA,et al.Novel antibacterial nanofibrous PLLA scaffolds[J].Controlled Release,2010,146(3):363-369.
[6] Vacanti NM,Cheng H,Hill PS,et al.Localized delivery of dexamethasone from electrospun fibers reduces the foreign body response[J].Biomacromolecules,2012,13(10):3031-3038.
[7] Liang D,Hsiao BS,Chu B.Functional electrospun nanofibrous scaffolds for biomedical applications[J].Adv Drug Del Rev,2007,59 (14):1392-1412.
[8] Sill TJ,von Recum HA.Electrospinning:applications in drug delivery and tissue engineering[J].Biomaterials,2008,29(13):1989-2006.
[9] Yoo HS,Kim TG,Park TG.Surface-functionalized electrospun nanofibers for tissue engineering and drug delivery[J].Adv Drug Del Rev,2009,61(12):1033-1042.
[10]Zeng J,Yang L,Liang Q,et al.Influence of the drug compatibility with polymer solution on the release kinetics of electrospun fiber formulation[J].Controlled Release,2005,105(1-2):43-51.
[11]Xie J,Wang CH,Electrospun micro-and nanofibers for sustained delivery of paclitaxel to treat C6 glioma in vitro[J].Pharm Res, 2006,23(8):1817-1826.
[12]Ranganath SH,Wang CH.Biodegradable microfiber implants delivering paclitaxel for post-surgical chemotherapy against malignant glioma[J].Biomaterials,2008,29(20):2996-3003.
[13]Meinel AJ,Germershaus O,Luhmann T,et al.Electrospun matrices for localized drug delivery:current technologies and selected biomedical applications[J].Eur J Pharm Biopharm,2012,81 (1):1-13.
[14]Vasita R,Katti DS.Nanofibers and their applications in tissue engineering,Int.Nanomedicine,2006,1(1):15.
[15]Woodruff MA,Hutmacher DW.The return of a forgotten polymer—polycaprolactone in the 21st century[J].Prog Polym Sci,2010, 35(10):1217-1256.
[16]Okada M.Chemical syntheses of biodegradable polymers[J].Prog Polym Sci,2002,27(1):87-133.
[17]L.S.Nair,C.T.Laurencin.Biodegradable polymers asbiomaterials [J].Prog Polym Sci,2007,32(8-9):762-798.
[18]Dash T.K.,Konkimalla V.B.,Poly--caprolactone based formulations for drug delivery and tissue engineering:A review[J].Controlled Release,2012,158(1):15-33.
[19]Sinha V,Bansal K,Kaushik R,et al.Poly--caprolactone microspheres and nanospheres:an overview[J].Int J Pharm,2004,278 (1):1-23.
[20]Teo EY,Ong SY,Khoon Chong MS,et al.Polycaprolactone-based fused deposition modeled mesh for delivery of antibacterial agents to infected wounds[J].Biomaterials,2011,32(1):279-287.
[21]Reise M,Wyrwa R,Müller U,et al.Release of metronidazole from electrospun poly(L-lactide-co-D/L-lactide)fibers for local periodontitis treatment[J].Dent Mater,2012,28(2):179-188.
[22]Kurtis B,ünsal B,?etiner D,et al.Effect of polylactide/glycolide (PLGA)membranes loaded with metronidazole on periodontal regeneration following guided tissue regeneration in dogs[J].Periodontol,2002,73(7):694-700.
[23]Zamani M,Morshed M,Varshosaz J,et al.Controlled release of metronidazole benzoate from poly -caprolactone electrospun nanofibers for periodontal diseases[J].Eur J Pharm Biopharm, 2010,75(2):179-185.
[24]FanW,Crawford R,XiaoY.Enhancingin Vivo Vascularized Bone Formation by Cobalt Chloride-Treated Bone Marrow Stromal Cells in a Tissue Engineered Periosteum Model[J].Biomaterials, 2010,31(13):3580-3589.
[25]Hoffman MD,Xie C,Zhang XP,et al.The Effect of Mesenchymal Stem Cells Delivered Via Hydrogel-Based Tissue Engineered Periosteum on Bone Allograft Healing[J].Biomaterials,2013,34 (35):8887-8898.
[26]Park SN,Jang HJ,Choi YS,et al.Preparation and characterization of biodegradable anti-adhesive membrane for peritoneal wound healing[J].Mater Sci Mater Med,2007,18(3):475-482.
[27]Bottino MC,Thomas V,Schmidt G,et al.Recent advances in the development of GTR/GBR membranes for periodontal regeneration-a materials perspective[J].Dent Mater,2012,28(7):703-721.
[28]KimK,Luu YK,Chang C,et al.alIncorporation and controlled release of ahydrophilicantibiotic usingpoly(lactide-co-glycolide)-based electrospun nanofibrous scaffolds[J].Controlled Release, 2004,98(1):47-56.
[29]Anselme K.Osteoblast adhesion on biomaterials[J].Biomaterials, 2000,21(7):667-681.
Drug release behavior and biocompatibility study of antimicrobial polycaprolactone
Shi Rui1,3,Xue Jiajia2,Cao Jingjing1,et al.1Beijing Research Institute of Traumatology and Orthopaedics,Beijing, 100035;2 Key Laboratory of Beijing City for Preparation and Processing of Novel Polymer Materials,Beijing University of Chemical Technology,Beijing,100029;3 Department of Spine Surgery of Beijing JiShuiTan Hospital,the Fourth Clinical Medical College of Peking University,Beijing,100035,China
Objective To investigate the effects of drug contents ondrug release,antibacterial property,biocompatibility and biodegradation.Methods The different drug loadings of the polycaprolact one(PCL)/metronidazole(MNA)nanofiber membranes(0,1%,5%,10%,20%,30%,and 40wt%)were fabricated by electrospinning methods.High performance liquid chromatography(HPLC)was used to test the drug release concentrations of at the setting time points.Antibacterial property of the membranes was tested by measuring the diameters of bacteriostatic ring surrounding the samples.MTT method using L929 cell was applied to determine the cell toxicity.Cell count Kit-8(CCK 8)method was used to evaluate the adhesion and proliferation of L929 cells on surface of different membranes.Rabbit subcutaneous was utilized to verify the influences of drug-loading on his to compatibility and in vivo biodegradability.Results Drug release characteristics with sudden release in 1 week,after that showed a sustained slow release.The bacteriostatic circle was immerged after 1 day began to present when the drug-loading was more than 5%.Bacteriostatic circle diameter increased as the drug content increased,and antibacterial duration could sustain for 30 days.The MNA loading nanofiber membranes preserved good cell biocompatibility.The cell compatibility of P30 was best.In addition,loading drugs was helpful for improving the histocompatibilty and degradation rate.Conclusion PCL/MNA nanofiber membranes have good antibacterial property and biocompatibility,and the P30 preserved the best comprehensive properties.
Electrospinning;Polycaprolactone;Metronidazole;Antibacterial
R318.08
A
10.3969/j.issn.1672-5972.2014.05.002
swgk2014-04-0063
石锐(1981-)女,博士,助理研究员。研究方向:骨科生物材料。
*[通讯作者]田伟(1959-)男,教授,博士生导师,主任医师。研究方向:骨科临床及基础。
2014-04-14)
国家自然基金资助项目(项目编号:51303014);北京市科技新星计划项目(项目编号:Z131102000413015);北京市优秀人才培养资助计划(项目编号:2013D00303400041)
1北京市创伤骨科研究所,北京100035;2北京化工大学北京市新型高分子材料制备与加工重点实验室,北京100029;3北京积水潭医院北京大学第四临床医院,北京100035

