氟比洛芬聚丙烯酸树脂RL/RS固体分散体的制备
刘善峰,徐爱霞,李叶桓,王海龙
(1.沂南县中医院,山东 沂南 276300;2.沂南县妇幼保健院,山东 沂南 276300;3.济南大学医学与生命科学学院,山东 济南 250022)
氟比洛芬(Flurbiprofen,FP)作为一种前列腺素酶抑制剂,为新一代的非甾体抗炎药物,广泛用于风湿性、类风湿性关节炎,骨关节炎,强直性脊椎炎,肌肉的扭伤和拉紧等骨骼和关节疾病。氟比洛芬在芳基烷酸类解热镇痛药中作用最强,每次剂量120mg可与阿司匹林2g具有同等的功效。但其也具有体内生物半衰期短,生物利用度低,易引起消化道溃疡和出血等缺点,利用缓释技术可有效提高药物的稳定性,降低不良反应的发生率,是该药物剂型发展的新方向[1,2]。研究表明,丙烯酸树脂(Eudragit RL,Endragit RS等)广泛用于制作不同渗透性能的缓释材料[3],利用这一特性将氟比洛芬制成固体分散体,达到缓释功能,并可提高其释放度,是制备其他固体剂型的基础。本实验采用溶剂法制备了氟比洛芬固体分散体并对其体外释药特性进行了考察。
1 仪器与试药
1.1 仪器 FA1104B电子分析天平(上海越平科学仪器有限公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);UV759紫外可见分光光度计(上海佑科仪器仪表有限公司);ZRS-4智能溶出试验仪(天津大学无线电厂);CDR-1差热分析仪(日本岛津公司);真空干燥箱(上海一恒科学仪器厂)。
1.2 试剂 氟比洛芬(德国Knoll制药公司,药用级);聚丙烯酸树脂RL/RS(德国罗姆公司,药用级,批号:990914);卵磷脂(上海太伟磷脂公司,药用级);甲醇、乙醇、磷酸二氢钾(天津市广成化学试剂厂,分析纯);其他试剂均为分析纯。
2 方法与结果
2.1 氟比洛芬固体分散体的制备 固体分散体的制备采用溶剂法,精密称取氟比洛芬约0.2g和聚丙稀树脂RS/RL,加入乙醇作溶剂,使药物和载体在30~40℃溶解。溶解后的液体用旋转蒸发仪40℃左右蒸除溶剂,得白色固体。该固体置真空干燥箱24 h,温度30℃。干燥后将固体研磨过60目筛,制得氟比洛芬固体分散体。
2.2 含量测定方法学考察
2.2.1 检测波长的选择 称取氟比洛芬适量,置50mL量瓶中,先加少量甲醇使溶解,然后加磷酸盐缓冲液(pH 7.2,亦为体外溶出介质,下同)至刻度,制成浓度约 6 μg·mL-1的溶液,在 200 ~400 nm 波长范围内进行紫外扫描,另取聚丙烯酸树脂Eudragit RL100、Eudragit RS100及卵磷脂制成浓度约为30 μg·mL-1的溶液,进行紫外扫描,氟比洛芬在247 nm处波长处有最大吸收,聚丙稀树脂RL/RS及卵磷脂在此波长处几乎无吸收,不干扰氟比洛芬的测定,故确定检测波长为247 nm。
2.2.2 标准曲线的制备 精密称取干燥至恒重的氟比洛芬约20mg置200mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为标准贮备液。分别精密量取上述标准贮备液 1、2、3、4、5、6mL 置 6 支 50mL 量瓶中,加磷酸盐缓冲液(pH 7.2)至刻度,摇匀,于247 nm处测定吸光度,以氟比洛芬浓度C对吸光度A进行线性回归,得回归方程:A=0.0786 C +0.0015,R2=0.9992,表明在2 ~12 μg·mL-1浓度范围内,氟比洛芬浓度与其吸光度呈现良好线性关系。
2.2.3 稳定性试验 精密量取氟比洛芬标准贮备液5mL,置于100mL容量瓶中,加入磷酸盐缓冲液(pH 7.2)定容,配制 5 μg·mL-1的氟比洛芬溶液,室温条件下,分别在 0、4、12、24、48、72 h 时测定其吸光度数值,结果表明,氟比洛芬溶液在72 h内其吸光度数值基本不变,RSD值为1.26%(n=6),表明其溶液在72 h内保持稳定。
2.2.4 加样回收率试验 精密称取制备好的氟比洛芬分散体约80mg,加入500mL磷酸盐缓(pH 7.2)冲液,放置过夜,使氟比洛芬充分溶出,经微孔滤膜过滤后备用。精密量取上述备用溶液9份,每份20mL置25mL量瓶中,3份为一个剂量组,分别精密加入不同量的氟比洛芬标准贮备液,加磷酸盐缓冲液(pH 7.2)定容,制成高、中、低三种不同浓度的溶液,在247 nm波长处测定加样前后吸光度数值,按回归方程计算浓度,结果见明,在加样量为1.950、7.600、15.220 μg·mL-1的情况下,氟比洛芬的平均回收率为99.7%,RSD为2.38%(n=9)。
2.2.5 精密度试验 精密量取氟比洛芬标准贮备液2、4、6mL,置于50mL 容量瓶中,按”2.2.2”标准曲线制备项下,自“加磷酸盐缓冲液(pH 7.2)至刻度”起,同法操作。每种溶液每日重复测定3次,连续测定3 d,计算日内及日间精密度。结果表明,3种溶液的平均日内精密度RSD值为1.03%(n=9),日间精密度RSD值为1.49%(n=9),表明所设计的方法日内、日间精密度良好。
2.3 体外释药测定方法 采用《中国药典》2010年版(二部)释放度测定的第三法(小杯法)进行实验。转速为100 rpm,温度为37.5℃,溶出介质采用200mL新配制的磷酸盐缓冲液(pH 7.2)。测定方法:精密称取约相当于4mg氟比洛芬的固体分散体,放入装有溶出介质的250mL溶出杯中,在0.5、1、2、4、6、8、10 h 等 7 个规定时间点取样,每次 5mL,同时向溶出杯中补加5mL溶出介质。样品经0.8μm微孔滤膜过滤后,以磷酸盐缓冲液pH 7.2为空白,在247 nm波长处测定吸光度数值,按“2.2.2”标准曲线制备项下计算药物浓度及释放百分率,并拟合Higuchi方程,计算药物释放半衰期t1/2。
2.4 单独聚丙烯树脂RL或RS作为载体对体外释放结果的影响 在固体分散体的制备中,曾考察使用单独的Eudragit RL或RS作为载体,结果发现,虽然单独的药物-RL和药物-RS固体分散体的释放性能高于药物原粉,但药物-RS固体分散体释放过慢,药物-RL固体分散体则释放过快。因此,单一载体使用不容易达到理想的释放效果。两种载体联合使用,通过改变其配比相互调节,能有效地实现固体分散体释放缓慢、平稳、完全,达到提高生物利用度的效果。
2.5 正交试验设计与结果
2.5.1 正交设计优化处方和工艺 氟比洛芬固体分散体和物理混合物的制备用溶剂法,同前所述。选择影响药物溶出速度的三个因素:药物-载体的比例、RL/RS的比例、卵磷脂-载体的比例,采用三因素三水平正交设计,见表1。

表1 正交试验因素和水平表
2.5.2 正交试验结果 正交试验筛选结果及极差分析结果见表2。由表2可知,各因素对固体分散体溶出影响的顺序为A>B>C,即药物载体比例为影响其释放特性的显著因素,其次为两种载体的配比及卵磷脂的浓度。根据试验结果,其优化后的处方为A3B2C3,即药物 - 载体比为1∶9,丙烯酸树脂RL/RS为2∶1,卵磷脂浓度为0.2%。
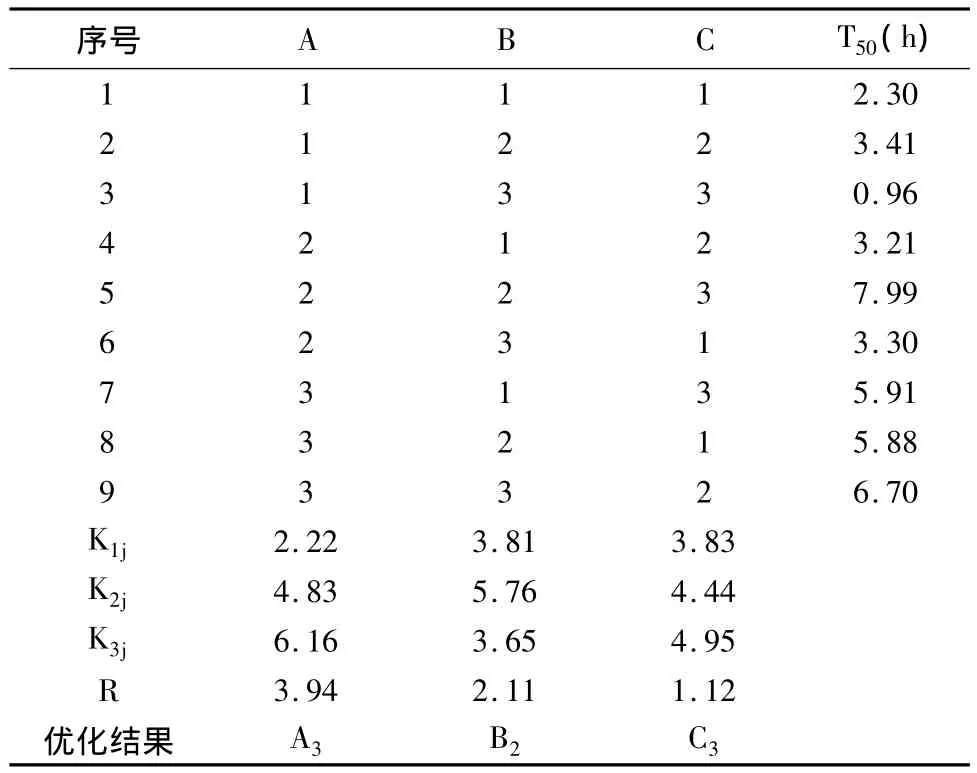
表2 正交试验结果
2.6 正交优化处方体外释放结果 根据正交试验结果选择优化后的处方制备固体分散体,与原料药、药物-载体物理混合体的体外释放效果进行比较,结果见图1。由图可知,利用优化后的处方得到的固体分散体其释药均匀、缓慢,释放度明显高于原料药及未经处理的药物和载体物理混合物。
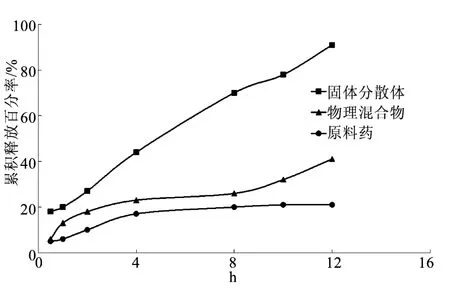
图1 处方优化后的固体分散体与原料药、物理混合物体外释药性能比较
2.7 固体分散体的鉴别 采用差示扫描热量法(DSC)进行测定。工作条件为:参比物为 α-Al2O3,氮气,升温温度为10 ℃·min-1,扫描温度为25~250℃,分别测定氟比洛芬原料药,聚丙烯酸树脂RS、RL,氟比洛芬载体物理混合物,氟比洛芬固体分散体的DSC曲线,结果见图2。由图可见,物理混合物与氟比洛芬原料在121℃时有一较宽的吸收峰,认定为药物结晶的熔解吸收峰。固体分散体中药物熔解峰的消失说明在分散相中不存在结晶相的氟比洛芬。因此可以认为,通过固体分散技术,药物在载体中的物理性质发生了变化,高分子材料和药物存在相互作用,抑制了药品结晶的形成,有利于其均匀释放。

图2 氟比洛芬及RL/RS载体、固体分散体差热分析
3 讨论
利用固体分散技术可将药物高度分散于载体中,药物在载体中以微米级的粒径存在,可以有效增加难溶性药物的溶出,提高其生物利用度[4~6]。对于缓、控释型固体分散体,其常用的载体除Eudragit外[3],还有乙基纤维素、蜡脂等[7]。
聚丙烯酸树脂类载体(如 Eudragit E、Eudragit RL和Eudragit RS等),具有胃液中溶胀,肠液中不溶,不能被人体吸收,无毒无害等优点,广泛被用作制备缓释固体分散体的载体。药物在其中具有不同的穿透性能主要基于其含有季铵基团的多少,Eudragit RL和Eudragit RS中,前者含10%氯化三甲胺基甲基丙烯酸酯,后者仅含5%。季铵基含量高者,形成的固体分散体通透性及溶胀性大,故Eudragit RL为高渗型丙烯酸树脂,Eudragit RS则为低渗型丙烯酸树脂,两种材料配合使用可获得理想的释药速率。
[1]陈莹,王硕,刘雅静,等.氟比洛芬干混悬剂的制备及其质量控制[J].中国药房,2011,22(21):1976 -1978.
[2]王希东,谭雪燕,刘善奎.氟比洛芬聚丙烯酸树脂RL/RS缓释微球的制备[J].新乡医学院学报,2013,30(1):31-34.
[3]Qiao M,Luo Y,Zhang L,et al.Sustained release coating of tablets with Eudragit®RS/RL using a novel electrostatic dry powder coating process[J].Int J Pharm,2010,399(1-2):37-43.
[4]Kumar P,Mohan C,Kanamsrinivasan Uma Shankar M,et al.Physiochemical Characterization and Release Rate Studies of Solid Dispersions of Ketoconazole with Pluronic F127 and PVP K-30[J].Iran J Pharm Res,2011,10(4):685-694.
[5]Iqbal B,Ali A,Ali J,et al.Recent advances and patents in solid dispersion technology[J].Recent Pat Drug Deliv Formul,2011,5(3):244 -264.
[6]Alam MA,Ali R,Al- Jenoobi FI,et al.Solid dispersions:a strategy for poorly aqueous soluble drugs and technology updates[J].Expert Opin Drug Deliv,2012,9(11):1419-1440.
[7]Pignatello R,Ferro M,Puglisi G.Preparation of solid dispersions of nonsteroidal anti-inflammatory drugs with acrylic polymers and studies on mechanisms of drug-polymer interactions[J].AAPS Pharm Sci Tech,2002,3(2):E10.

