多壁碳纳米管与聚(2-乙酰基-5-溴噻吩)复合纳米材料修饰玻碳电极同时检测对苯二酚、邻苯二酚和对甲苯酚
李雯瑾,魏沙平
(西南大学化学化工学院,重庆 400715)
多壁碳纳米管与聚(2-乙酰基-5-溴噻吩)复合纳米材料修饰玻碳电极同时检测对苯二酚、邻苯二酚和对甲苯酚
李雯瑾,魏沙平*
(西南大学化学化工学院,重庆 400715)
该文利用多壁碳纳米管(MWCNTs)和聚(2-乙酰基-5-溴噻吩)复合纳米材料修饰电极,用于同时检测对苯二酚(HQ)、邻苯二酚(CC)和对甲苯酚(PC)。通过循环伏安法(CV),示差脉冲伏安法(DPV)和透射电镜(TEM)表征了该复合纳米材料的电化学性能和表面形貌。结果表明该电极对HQ、CC和PC具有较高的灵敏度和选择性。DPV峰电流与HQ、CC和PC的浓度在1.0×10-5~8.0×10-4mol/L,5.0×10-6~5.5×10-4mol/L和5.0×10-6~7.5×10-4mol/L范围内分别呈良好的线性关系,且检测限分别为3.0×10-6mol/L,1.7×10-6mol/L和2.0×10-6mol/L。
多壁碳纳米管;电化学传感器;邻苯二酚;对苯二酚;对甲苯酚
0 引言
酚类化合物被广泛应用于工业生产,尤其是在制药业、染料、煤矿开采中[1~2]。酚类化合物是一种环境污染物,当他们在环境中的含量超过一定限度时,会导致严重的环境问题并且对人类健康,动植物和水生生物的生存有害[3~4]。邻苯二酚(CC)、对苯二酚(HQ)以及对甲苯酚(PC)是三种常见的酚类化合物,高效、方便的同时检测它们有很重要的现实意义。在常用的检测方法[5~7]中,电化学方法具有快速,简单,廉价,有效等优点并且不需要复杂样品前处理,所以是较优的选择。然而,CC、HQ以及PC相似的结构使得它们的氧化还原电位太靠近,因而不能实现在裸电极上的同时检测。为了克服这个困难,许多材料被用于修饰电极,如氧化石墨烯[8],咪唑盐离子液体聚合物[9]和纳米颗粒[10]等。
多壁碳纳米管(MWCNTs)是一种新型的碳材料,由于其卓越的导电性,大的比表面积,好的生物相容性和良好的机械强度,它常被应用于修饰电化学传感器[11]。MWCNTs修饰的电极已经广泛用于检测CC、HQ和PC。例如,张克营等[12]用聚茜素黄R和多壁碳纳米管复合物修饰电极同时测定邻苯二酚和对苯二酚;于芬等[13]用聚L-半胱氨酸/多壁碳纳米管复合修饰电极同时测定CC和HQ;陈时洪等[14]报道了用氧化石墨烯和多壁碳纳米管同时测定CC、HQ和PC。另一方面,许多导电聚合物由于其良好的导电性,低廉的价格和好的生物相容性也被广泛运用于传感器的构建。如聚三甲基噻吩-碳纳米管和全氟磺酸复合物修饰电极用于检测多巴胺[15],锇-聚合物修饰石墨电极用于检测果糖[16]。
利用MWCNTs和导电聚合物合成出的复合纳米材料,可以引进新的和令人满意的性质,如增大比表面积,提高灵敏度和增加稳定性[17]。因此,基于MWCNTs和导电聚合物的优良性质,合成了多壁碳纳米管-聚(2-乙酰基-5-溴噻吩)复合纳米材料,用其修饰玻碳电极对邻苯二酚、对苯二酚和对甲苯酚进行同时检测,并用循环伏安法和示差脉冲伏安法对该传感器的性能进行了研究。
1 实验部分
1.1 药品和试剂
多壁碳纳米管(纯度>95%,直径20~50 nm,长约2μm,MWCNTs)购于中国科学研究院。邻苯二酚、对苯二酚、对甲苯酚、2-乙酰基-5-溴噻吩和1-乙基-3-甲基咪唑四氟硼酸盐,购于阿拉丁试剂公司(上海,中国)。磷酸盐缓冲溶液(PBS)(0.10 mol/L)由0.10 mol/L K2HPO4和0.10 mol/L KH2PO4配制。支持电解质为0.10mol/LKCl。实验用水均为二次蒸馏水。
1.2 仪器
CHI660C电化学分析测试系统(上海辰华仪器公司);该系统采用三电极体系:修饰电极做为工作电极,饱和甘汞电极做为参比电极,铂丝电极做为辅助电极。透射电子显微镜(TEM,TECNAI10,飞利浦公司)。所有的测试都是在室温下进行的。
1.3 电极制备
取5mg MWCNTs分散于二次蒸馏水中制成10mL的黑色悬浮液。1-乙基-3-甲基咪唑四氟硼酸盐离子液体(ILs)稀释至0.030mol/L,并将0.10 mol/L的FeCl3溶液(作为氧化剂)、0.10 mol/L的2-乙酰基-5-溴噻吩溶液(2A5P)以及10mLMWCNTs悬浮液加入制成的离子液体溶液中,此混合溶液于常温下放置24 h以得到多壁碳纳米管(MWCNTs)和聚(2-乙酰基-5-溴噻吩)复合纳米材料P(2A5P)/MWCNTs,离心、洗涤并烘干备用。
使用0.3和0.05μm的氧化铝粉打磨玻碳电极,并分别在二次蒸馏水和无水乙醇中超声处理三次。P(2A5P)/MWCNTs复合纳米材料在二次蒸馏水中超声分散得到1mg/mL分散液。取此分散液15μL滴涂于预处理好的玻碳电极表面,室温下晾干得到目标电极P(2A5P)/MWCNTs/GCE。用相似的方法以MWCNTs分散液滴涂玻碳电极制成对比电极MWCNTs/GCE。修饰电极的制作过程如图1所示。
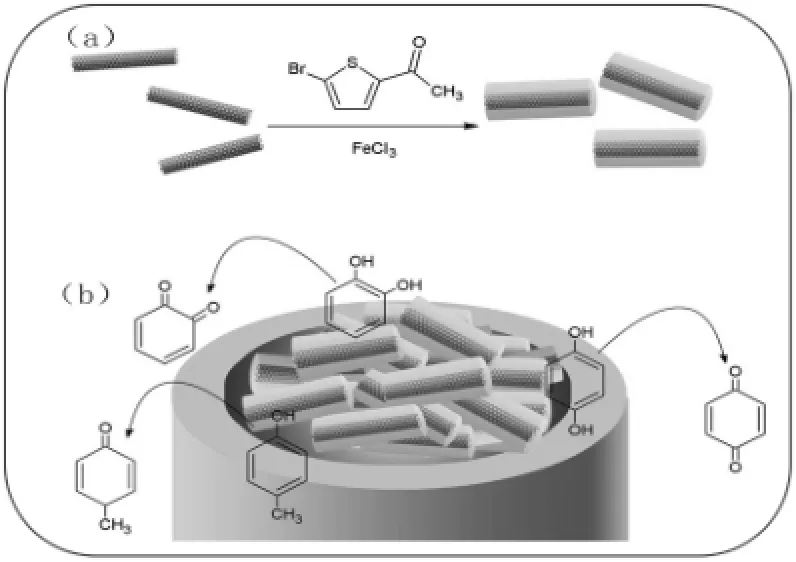
图1 P(2A5P)/MWCNTs复合纳米材料的(a)合成及(b)其修饰电极催化氧化HQ、CC、PC的示意图Fig.1 Schematic representation of(a)the preparation of P(2A5P)/MWCNTSand(b)theelectrocatalytic oxidation of HQ,CC and PC at P(2A5P)/MWCNTS/GCE
2 结果与讨论
2.1 复合材料的TEM表征
采用透射电镜(TEM)对复合纳米材料P(2A5P)/MWCNTs的形貌进行了表征,结果如图2所示。与MWCNTs的修饰膜相比(图2a),P(2A5P)/ MWCNTs复合物纳米材料的TEM图像(图2b)发生了明显变化,可见MWCNTs表面被复合物包裹,MWCNTs直径增加,说明P(2A5P)/MWCNTs复合物纳米材料是成功制备的。
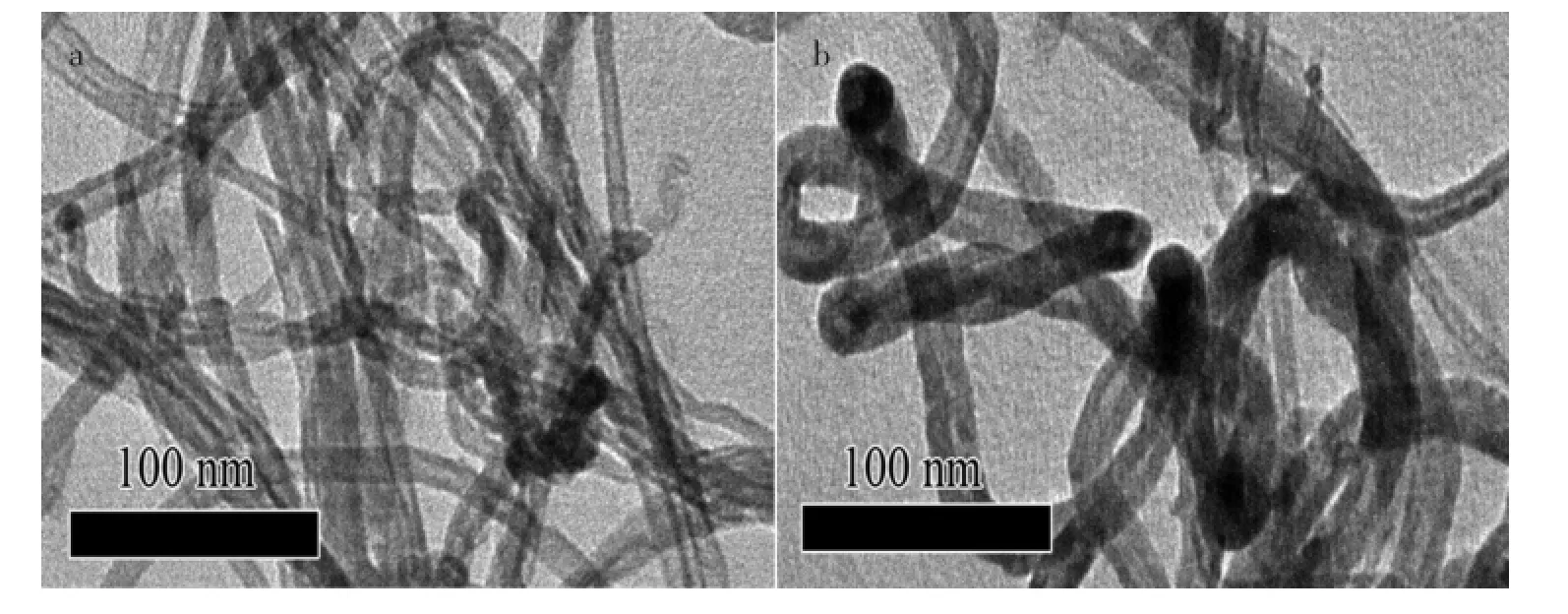
图2 (a)MWCNTs和(b)P(2A5P)/MWCNTs的透射电镜图Fig.2 TEM imagesof(a)MWCNTsand(b)P(2A5P)/MWCNTs
2.2 优化pH
P(2A5P)/MWCNTs/GCE和被测分析物之间的结合是π-π键、离子键和疏水结合等作用力,所以检测结果受pH值影响。采用循环伏安法(CV)测定在不同pH下P(2A5P)/MWCNTs/GCE对 HQ、CC和PC的电化学响应,峰电流与峰电位值随pH的变化如图3所示。从图3A可知,pH从4.5增加至7.0,峰电流值随着pH的增加而增大,随后,pH从7.0增加至8.5,峰电流值随着pH的增大而减小。从图3B可见,随着pH的增加,峰电位负向移动,说明质子参与了电极反应过程。为了得到更高的灵敏度和选择性,该文把pH7.0作为适宜的检测pH。
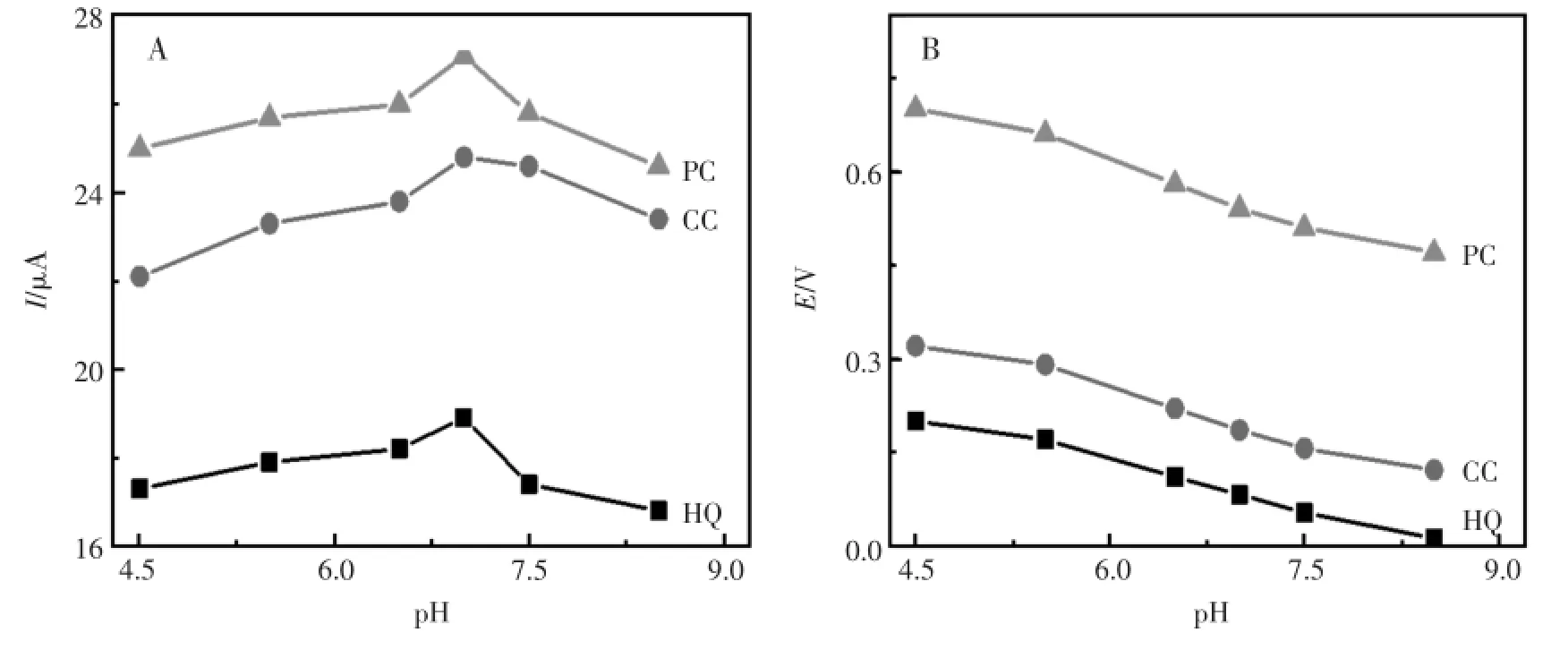
图3 pH对P(2A5P)/MWCNTs/GCE的(A)循环伏安峰电流及(B)峰电位的影响Fig.3 Effectof pH on(A)CV peak currentsand(B)CV peak potentials for the oxidation of0.2mmol/LHQ,0.2 mmol/LCCand 0.2mmol/LPC in 0.10mmol/LPBSatP(2A5P)/MWCNTs/GCE
2.3 修饰电极的电化学性能
采用CV对电极的电化学性能进行了研究。图4显示了裸GCE,MWCNTs/GCE和P(2A5P)/ MWCNTs/GCE修饰电极同时响应HQ、CC和PC的循环伏安图谱。如图4所示,HQ、CC和PC在裸电极上几乎没有响应(曲线a),而在MWCNTs/ GCE上呈现出三个良好的且分离的氧化峰(曲线b)。P(2A5P)/MWCNTs/GCE电极不仅呈现出良好的三个分离峰,而且对比于MWCNTs/GCE,峰电流明显增加(曲线c)。体现了目标电极P(2A5P)/ MWCNTs/GCE同时检测这三种酚类物质的优越性。可能的原因是MWCNTs促进了电子的传递,提高了电极灵敏度,而聚噻吩增大了电极的表面积,MWCNTs与聚噻吩的协同作用提高了修饰电极对酚类物质的催化氧化。
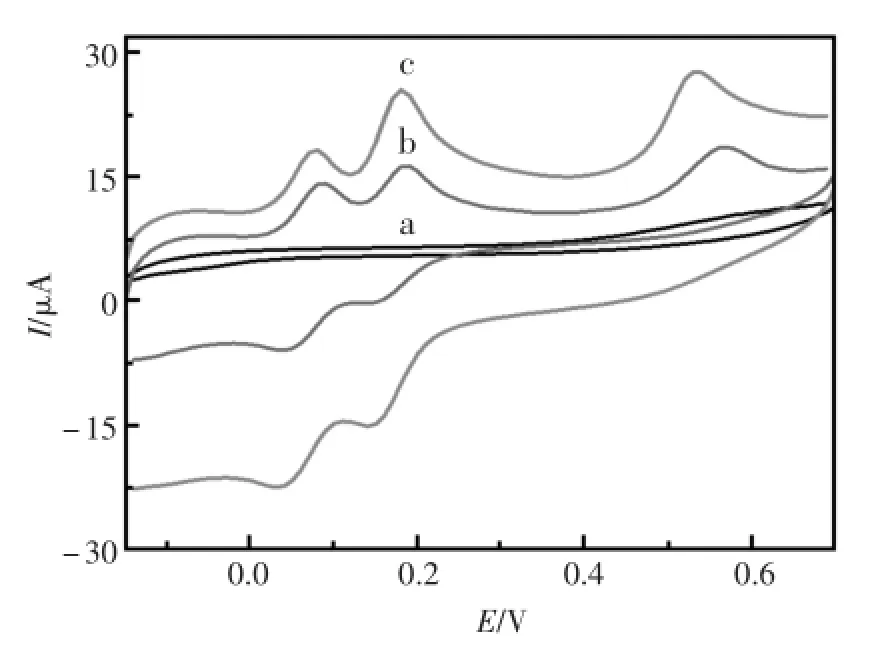
图4 (a)bareGCE,(b)MWCNTs/GCE and(c)P(2A5P)/ MWCNTs/GCE响应0.2mmol/LHQ、0.2mmol/LCC和0.2mmol/LPC的循环伏安图谱Fig.4 CV response to 0.2mmol/LHQ,0.2mmol/LCC and 0.2mmol/LPC in 0.10mol/LPBS(pH7.0)at(a)bareGCE,(b)MWCNTs/GCEand(c)P(2A5P)/MWCNTs/GCE.Scan rate:50mV/s
2.4 同时测定HQ、CC和PC
图5曲线a,b,和c分别为电极P(2A5P)/ MWCNTs/GCE响应单一的HQ、CC和PC的循环伏安图谱。可见,三者的氧化峰电位之间有明显电位差。图5曲线d为电极响应HQ、CC和PC三者混合物的循环伏安图谱。HQ和CC的氧化峰电位差为105mV,HQ和PC的氧化峰电位差为320mV,由此可知用P(2A5P)/MWCNTs/GCE同时对HQ、CC和PC进行检测是可以实现的。
由于DPV比CV法具有更高的灵敏度和更好的检测效果,因此该文采用DPV法测定了P(2A5P)/MWCNTs/GCE对HQ、CC和PC的响应。测试时,在CC,HQ和PC的混合溶液中,保持其中两种的浓度不变,改变一种物质的浓度以实现对CC,HQ和PC的分别检测,结果如图6所示。图6(a)为保持CC和PC的浓度均为0.2mmol/L,HQ的浓度从10μmol/L逐渐增加至800μmol/L时的DPV响应曲线,DPV峰电流与HQ浓度在1.0×10-5~8.0×10-4mol/L范围内呈良好的线性关系,如插图所示。响应方程为Ip,HQ(μA)= 47.6+0.061 3 c(HQ)(μmol/L)(r=0.990 8),检测限为3.0×10-6mol/L。图6(b)为保持HQ和PC的浓度为0.2mmol/L不变,改变CC的浓度从5μmol/L至550μmol/L的DPV响应曲线,响应电流与CC浓度在5.0×10-6~5.5×10-4mol/L范围内呈良好的线性关系,如插图所示。响应方程为Ip,CC(μA)= 35.3+0.107c(CC)(μmol/L)(r=0.991 1),检测限为1.7×10-6mol/L。如图6(c)所示,保持HQ和CC的浓度为0.2mmol/L不变,PC浓度从5μmol/L增加至750μmol/L,DPV峰电流增加,峰电流与PC的浓度在5.0×10-6~7.5×10-4mol/L范围内呈良好线性关系,如插图所示。响应方程为Ip,PC(μA)= 18.0+0.022 4c(PC)(μmol/L)(r=0.990 5),检测限为2.0×10-6mol/L。
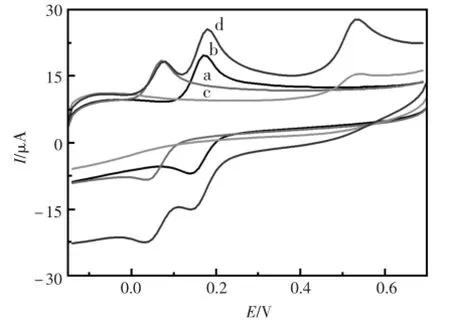
图5 P(2A5P)/MWCNTs/GCE对(a)0.2mmol/L HQ,(b)0.2mmol/LCC,(c)0.2mmol/LPC和(d)三者的混合液的循环伏安响应;扫速:50mV/sFig.5 CV response of P(2A5P)/MWCNTs/GCE towards(a)0.2mmol/LHQ,(b)0.2mmol/LCC,(c)0.2mmol/LPCand(d)themixtrue in 0.10mol/LPBS(pH7.0)ata scan rateof 50mV/s
将文献中所报道的传感器与该文中的传感器的性能进行了对比,结果示于表1中。如表1所示,该工作制得的电极有更宽的线性范围和较低的检测限。
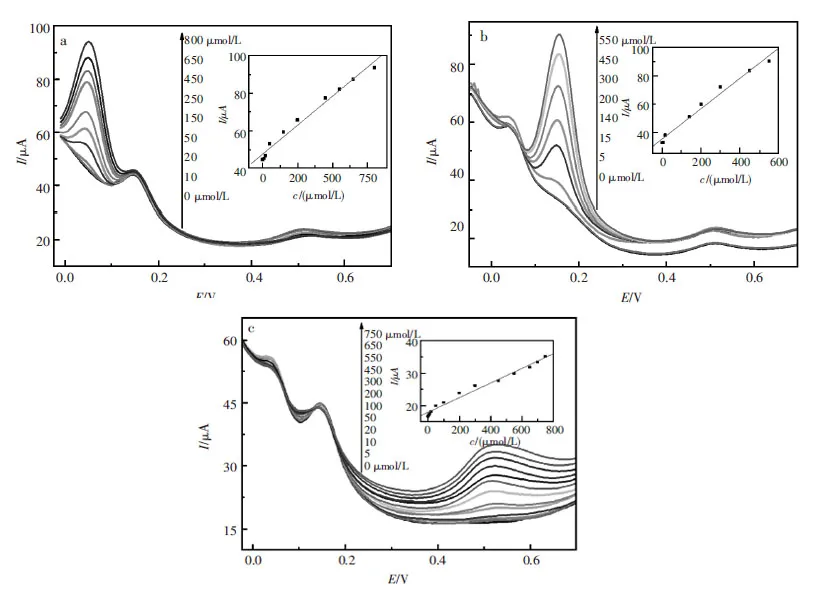
图6 在0.10mol/LPBS(pH7.0)中,(a)保持CC和PC浓度为0.2mmol/L,改变HQ浓度;(b)保持HQ和PC浓度为0.2mmol/L,改变CC浓度;(c)保持HQ和CC浓度为0.2mmol/L,改变PC浓度时,P(2A5P)/MWCNTs/ GCE的DPV响应曲线,插图为相应的响应曲线Fig.6 DPV curvesofP(2A5P)/MWCNTs/GCE to(a)changed HQ concentration and constant0.2mmol/LCC and PC,(b)changed CC concentration and constant0.2mmol/LHQand PC,and(c)changed PC concentration and constant0.2mmol/LCCand HQ in 0.10mol/LPBS(pH7.0)
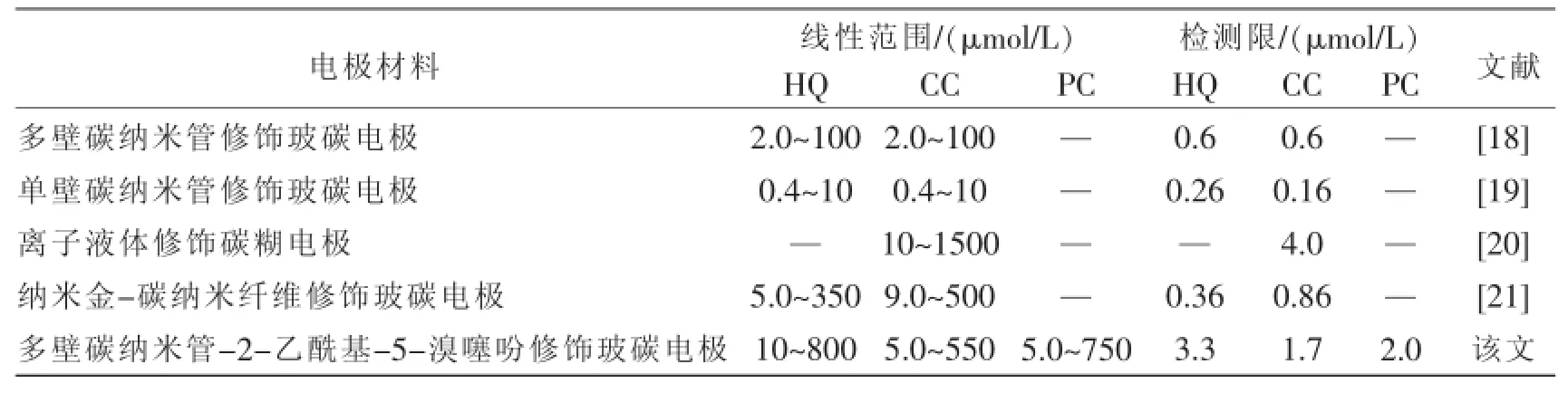
表1 不同电化学传感器用于HQ、CC和PC测定的比较Tab.1 Comparison for the simultaneousdeterm ination of CC,HQ and PC at the different modified electrodes
2.5 干扰性和稳定性
为了研究目标电极的选择性能,该文测试了NaCl、KCl、CaCl2、MgSO4、ZnCl2、Al(NO3)3、Zn(NO3)2、K2CO3、ZnCO3和葡萄糖等的干扰。实验结果表明,在同时检测CC(100μmol/L)、HQ(10μmol/L)和PC(10μmol/L)时,上述物质没有明显的干扰。同时,还研究了制得电极的稳定性。目标电极置于4°C条件下保存,15 d后测试其对HQ、CC和PC的响应,发现响应电流分别下降了7.3%,7.8%和6.2 %。以上结论表明目标电极具有良好的抗干扰性能和稳定性。
3 结论
该文成功制备了多壁碳纳米管与聚(2-乙酰基-5-溴噻吩)复合纳米材料。由于此复合纳米材料集多壁碳纳米管与聚(2-乙酰基-5-溴噻吩)优良性能于一体,其修饰的电极成功地实现了对HQ、CC和PC的同时检测。与其它所报道的酚类传感器相比,该修饰电极具有较宽的线性范围和较高的灵敏度。此外,该修饰电极还有良好的抗干扰性和稳定性,且成本低廉、操作简单。
[1] Howard PH.Handbook of environmental fate and exposure date for organic chemicals[M].Boca Raton:Taylor &Francis,1989.
[2]Clayton GD,Clayton FE.Patty’s IndustrialHygieneand Toxicology[M].New York:Wiley,1991.
[3]Ventura F,Boleda M R,Lloret R,et al.Strategies for the identification of compounds causing odours in water:a study of creosote spills[J].Wat.Res.,1998,32:503~509.
[4]Bukowska B,Kowalska S.Phenoland catechol induce prehemolytic and hemolytic changes in human erythrocytes[J].Toxicol.Lett.,2004,152:73~84.
[5]Lee BL,Ong H Y,ShiCY,etal.Simultaneousdetermination of hydroquinone,catechol and phenol in urine usinghigh-performance liquid chromatographywith fluorimetric detection[J].J.Chromatogr.B.,1993,619:259~266.
[6]Hu Y,Li X,Pang Z.Indirect chemiluminescence detection for capillary zone electrophoresisofmonoaminesand catecholusing luminol-K3[Fe(CN)6]system[J].J.Chromatogr.A.,2005,1091:194~198.
[7]傅应强,姚岚,陈宁生.人工神经网络阻抑动力学光度法同时测定对苯二酚和邻苯二胺[J].光谱实验室,2011,28(4):1 654~1 658.
[8]Chen L,Tang Y,Wang K,etal.Directelectrodeposition of reduced graphene oxide on glassy carbon electrode and its electrochemical application[J].Electrochem.Commun.,2011,13(2):133~137.
[9]Fu Y,Lin Y,Chen T,et al.Study on the polyfurfural film modified glassy carbon electrode and its application in polyphenols determination[J].J.Electroanal.Chem.,2012,687(1):25~29.
[10]Hu S,Wang Y,Wang X,etal.Electrochemical detection of hydroquinone with a gold nanoparticle and graphene modified carbon ionic liquid electrode[J].Sens.Actuators,B,2012,168(20):27~33.
[11]Li C,Su Y,Lv X,etal.Electrochemical acetylene sensor based on Au/MWCNTs[J].Sens.Actuators,B,2010,149:427~431.
[12]张克营,张娜,徐基贵.聚茜素黄R/多壁碳纳米管修饰电极同时测定邻苯二酚和对苯二酚[J].分析实验室,2012,31(11):50~53.
[13]余芬,万其进,朱丽娜,等.聚L-半胱氨酸/多壁碳纳米管复合修饰电极同时测定邻苯二酚和对苯二酚[J].理化检验,2009,45(4):375~379.
[14]Hu F,Chen S,Wang C,etal.Study on the application of reduced graphene oxide and multiwall carbon nanotubes hybridmaterials for simultaneous determination of catechol,hydroquinone,p-cresol and nitrite[J].Anal.Chim.Acta,2012,724:40~46.
[15]Wang H S,Li T H,JiaW L,et al.Highly selective and sensitive determination of dopamine using a Nafion/carbon nanotubes coated poly(3-methylthiophene)modified electrode[J].Biosens.Bioelectron.,2006,22(5):664~669.
[16]Antiochia R,Gorton L.A new osmium-polymermodified screen-printed graphene electrode for fructose detection[J].Sens Actuators B,2014,195:287~293.
[17]Feng X,GaoW W,Zhou SH,et al.Discrimination and simultaneous determination of hydroquinone and catechol by tunable polymerization of imidazolium-based ionic liquid on multi-walled carbon nanotube surfaces[J].Anal.Chim.Acta,2013,805(17):36~44.
[18]Ding Y P,Liu W L,Wu Q S,et al.Direct simultaneous determination of dihydroxybenzene isomers at C-nanotube-modified electrodes by derivative voltammetry[J].J.Electroanal.Chem.,2005,575(2):275~280.
[19]Wang ZH,LiSJ,Lv Q Z.Simultaneous determination of dihydroxybenzene isomers at single-wall carbon nanotube electrode[J].Sens Actuators B,2007,127(2):420~425.
[20]Zhang Y,Zhang JB.Comparative investigation on electrochemical behavior of hydroquinone at carbon ionic liquid electrode,ionic liquid modified carbon paste electrode and carbon paste electrode[J].Electrochim.Acta,2007,52(25):7 210~7 216.
[21]Yu JJ,DuW,Zhao FQ,etal.High sensitive simultaneousdetermination of catecholand hydroquinoneatmesoporous carbon CMK-3 electrode in comparison with multi-walled carbon nanotubes and Vulcan XC-72 carbon electrodes[J].Electrochim.Acta,2009,54(3):984~988.
M ulti-walled carbon nanotubesand poly(2-acetyl-5-bromothiophene)modified electrode for the simultaneous determ ination of catechol,hydroquinoneand p-cresol
LiWen-jin,WeiSha-ping*
(College of Chemistry and ChemicalEngineering,SouthwestUniversity,Chongqing 400715,China)
Multi-walled carbon nanotubes(MWCNTs)and poly(2-acetyl-5-bromothiophene)were used tomodify glassy carbon electrode for the simultaneous determination ofhydroquinone(HQ),catechol(CC),and p-cresol(PC).Themodified electrode was characterized by differential pulse voltammetric(DPV),cyclic voltammetry(CV)and transm ission electron microscope(TEM).Themodified electrode showed a high sensibility and selectivity to the determination ofHQ、CCand PCwith the linear rangesof1.0×10-5~8.0×10-4mol/L,5.0×10-6~5.5×10-4mol/Land 5.0×10-6~7.5×10-4mol/L,respectively.The detection limitswere 3.0×10-6mol/L,1.7×10-6mol/L and 2.0×10-6mol/L,respectively.
multi-walled carbon nanotubes;electrochemicalsensor;catechol;hydroquinone;p-cresol
*通讯联系人,E-mail:shapingw@swu.edu.cn,Tel:023-68253172,Fax:023-68253172

