基于氧化石墨烯修饰的DNA生物传感器用于苯酚的检测
徐运妹,李丹,张玲,童海霞,杨蕊琼,安振宇,李文杞
(长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,湖南长沙 410004)
基于氧化石墨烯修饰的DNA生物传感器用于苯酚的检测
徐运妹,李丹*,张玲,童海霞,杨蕊琼,安振宇,李文杞
(长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,湖南长沙 410004)
作为一种典型的优先控制污染物,苯酚一直是环境监测和污染控制的重要对象。基于氧化石墨烯大的比表面积、优良的电子传导性等特性,以其为桥梁,为DNA在玻碳电极上的固定提供了可能,并加大了DNA在电极上的电化学响应信号,由此而构建了一种性能优良的DNA生物传感器。将该传感器浸在含有苯酚的溶液中,由于苯酚对DNA的损伤作用,降低了DNA在电极上的电化学响应。实验发现,响应信号与苯酚的浓度对数呈现良好的线性关系,响应范围为1.0×10-8~1.0×10-4mol/L,此外,该生物传感器表现出良好的稳定性和重现性。
苯酚;氧化石墨烯;DNA生物传感器;电化学响应
0 引言
自Watson和Crick[1]发现生物遗传分子DNA的双螺旋结构以来,人们对于DNA的研究也越来越重视,尤其是对于DNA和其他物质相互作用的研究[2]。目前对DNA与其它物质作用的技术主要有光谱技术、表面分析技术、电化学技术等一系列的方法[3~5]。其中,电化学技术主要用于检测环境中的污染物等,其由于具有精确度和灵敏度高、特异性强、响应和检测迅速,操作简单、携带方便等一系列的优点而备受人们关注。环境优先污染物是对众多有毒污染物进行分级排队,从中筛选出潜在危害大,在环境中出现频率高的污染物作为监测和控制对象,对于这类污染物的监测称为优先监测;它具有难以降解、在环境中有一定残留水平、出现频率高、具有生物积累性、属于“三致”(致突变、致畸、致癌)物质等特点[6~12]。水体中含有的许多无机、有机毒性污染物通过各种途径进入人体,由于其易于与DNA相互作用从而损伤DNA,导致生命学上的基因突变,继而引发人体的各种病变乃至癌变,严重危害和威胁人类的生命健康[13~16]。
苯酚,又名石炭酸、羟基苯,是一种毒性较强的有机酚类化合物,并伴随着较强的腐蚀性,有少数报道称其有致癌的风险。苯酚是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料,在化工原料、烷基酚、合成纤维、塑料、合成橡胶、医药、农药、香料、染料、涂料和炼油等工业中有着重要用途[17~20]。同时,苯在人体内可代谢为苯酚、氢醌、苯醌等多种代谢产物。目前,研究这些有毒物质与DNA相互作用的方法有体内同位素前标记法、体外加合物的研究[21]等,这些方法多在生物体内或在体外细胞组织中进行,由于毒性物质组分的复杂性,单种毒物与DNA的相互作用的实验结果不明确,不能考察单种毒物对DNA的损伤机制[22~25]。因此,从分子水平讨论DNA与毒物的相互作用,可以更加准确地阐明DNA损伤机制,为认识致癌机制、有效治疗癌症提供依据[26]。该文通过循环伏安法、循环/差分脉冲伏安法、紫外光谱法、SEM研究了苯酚与DNA的相互作用。
石墨烯(Graphene)自2004年被英国曼彻斯特大学的教授Geim等[27]报道后,以其奇特的性能引起了科学家的广泛关注和极大的兴趣,被预测很有可能在很多领域引起革命性的变化。它作为一种新的形态,是sp2杂化碳原子组成的单层材料[27~32]。由于其有高比表面积、高电传导性、室温下极好的电子迁移率、高机械性能和灵活性,因此可以作为制备电化学传感器和生物传感器的一个理想材料[33~35]。将氧化石墨烯应用于DNA生物传感器的制备,以其为介质,可以有效地将DNA吸附到电极表面并提高DNA在电极表面的电化学响应信号,从而制得性能优良的DNA/GO/ GCE复合电极,并在此基础上考查DNA与苯酚之间的相互作用[36~39]。这为低浓度苯酚的测定提供了一种有效的、快速的、准确的方法和途径。
1 实验部分
1.1 仪器与试剂
KQ3200B型超声波清洗器(上海司乐仪器有限公司),PHSJ-3F型pH计(上海雷磁仪器厂),BS124S型电子天平(北京赛多利斯仪器系列有限公司),10μL微量进样器(上海医用激光仪器厂),CHI660A型电化学工作站(Gaoss Union),TU-1901型双光束紫外可见分光光度计(北京谱析通用仪器有限责任公司)。三电极体系:217型双盐桥参比电极(甘汞电极,金属为Hg,难溶盐为Hg2Cl2(s),易溶盐溶液为KCl溶液,电极可表示为Cl-/Hg2Cl2(s)/Hg,上海康宁电光技术有限公司);辅助电极(铂金CHI115电极);工作电极(玻碳电极)。
DNA(Sigma D-3159),氧化石墨烯(自制),0.05μm Al2O3(武汉高仕睿联科技有限公司),苯酚、NaH2PO4和Na2HPO4(国药集团化学试剂有限公司)。所用试剂均为分析纯,实验配置非生物试剂用水均为超纯水,试验器皿和缓冲溶液均为经高温高压灭菌。
1.2 玻碳电极的预处理
玻碳电极首先分别用3#、5#金相砂纸打磨10 min,用超纯水冲洗后,用0.05μm Al2O3抛光粉沿着一个方向打磨10min,然后依次置于超纯水、乙醇、超纯水中各超声清洗20min。将清洗好的电极置于5 mmol/L铁氰化钾/亚铁氰化钾+0.1 mol/L KCl的溶液中进行循环伏安法(CV)扫描,若曲线峰值差小于80mV且峰形稳定,说明该裸玻碳电极表面已清洗干净,可以进行电极修饰。
1.3 DNA/GO/GCE复合电极的制备
氧化石墨烯用超纯水溶解,常温下,超声分散30min。用微量进样器吸取5μL的相应浓度的氧化石墨烯溶液均匀地滴涂在处理好的玻碳电极表面,获得GO/GCE电极,晾干。
将晾干好的电极置于pH=7.00的相应浓度的DNA溶液中,以计时电流法施以+0.500 V的电压将DNA有效地吸附到电极表面,持续时间200 s,获得DNA/GO/GCE复合电极,取出,用超纯水冲洗,晾干。
1.4 苯酚的检测
将获得的DNA/GO/GCE复合膜电极置于不同浓度的苯酚溶液中,静置1 h。用循环/示差脉冲伏安法(DPV+Cyclic)进行扫描。
2 结果与讨论
2.1 氧化石墨烯修饰电极的表征以及DNA/GO/ GCE复合电极的电化学行为
图1为裸玻碳电极经过氧化石墨烯修饰后的扫描电子显微镜(SEM)图。从图1可以看出,氧化石墨烯均匀地分散在玻碳电极表面,这为DNA的有效吸附以及电化学信号的放大提供了良好的平台。

图1 氧化石墨烯修饰电极的SEM图Fig.1 SEM imageofgrapheneoxide-modified electrode
图2为DNA/GO/GCE(ox)(图2-b)电极和GCE(ox)电极(图2-a)在0.1mol/LPBS缓冲溶液(pH=5.0)中的线性扫描伏安图,从图中可以看出DNA/GO/GCE(ox)电极在0.8 V和1.12 V两处观察到DNA特有的氧化峰,分别对应于DNA中鸟嘌呤(G)和腺嘌呤(A)的氧化峰。图2-a是未吸附DNA的对照实验,GCE(ox)在0.8V和1.12V两处没有观察到氧化电流峰。这表明通过恒电位吸附能使DNA成功固定于预处理的玻碳电极表面。
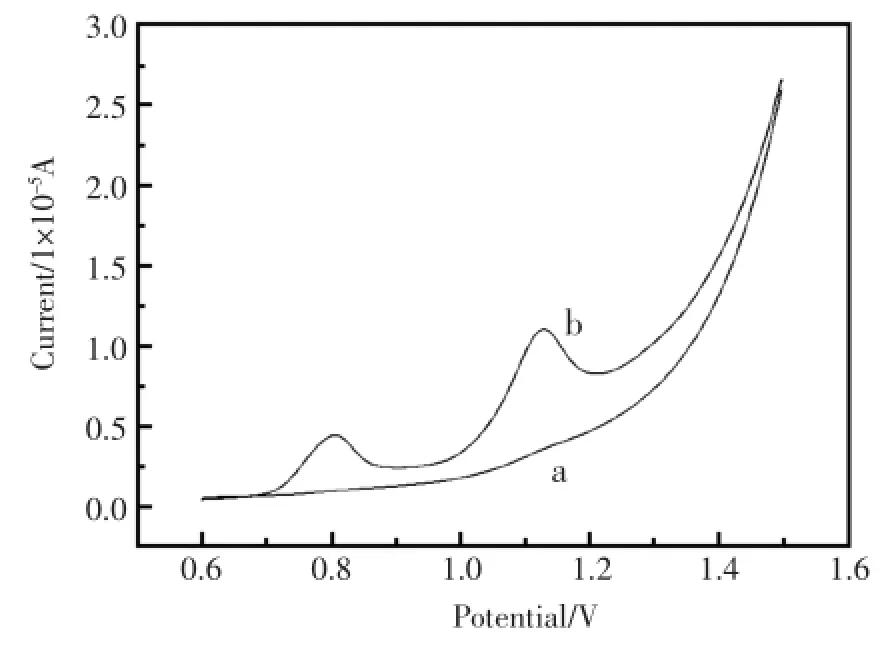
图2 不同电极在0.1mol/LPBS缓冲溶液(pH=5.0)的线性扫描伏安图(a:GCE(ox);b:DNA/GO/GCE(ox);DNA浓度:0.5mg/mL)Fig.2 The linear sweep voltammogramsofdifferent electrodes in 0.1mol/LPBSbuffer solution(pH=5.0)(a:GCE(ox);b:DNA/GO/GCE(ox);c(DNA)=0.5mg/mL)
2.2 最佳pH的选择
被测溶液的pH值对DNA/GO/GCE复合电极的氧化催化活性有一定的影响,以6.0~7.5作为pH的考查范围,采用循环伏安法进行扫描,比较了0.1mmol/L的苯酚在不同pH的PBS缓冲溶液中的电化学响应。从图3和图4中可以看出,当pH为7.0时,电极的氧化峰电流达到最大,且峰电位未发生明显偏移。故此分析体系选择pH= 7.0的PBS缓冲溶液。
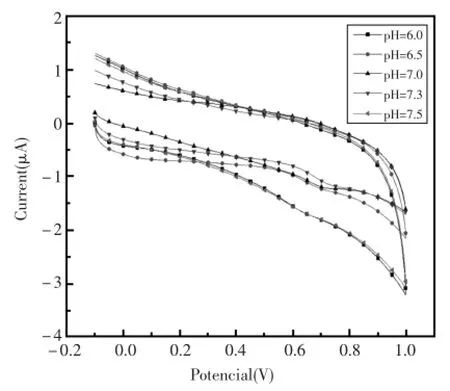
图3 空白玻碳电极在不同pH的PBS缓冲溶液中的电位响应曲线Fig.3 Blank glassy carbon electrode in PBSbuffer solutionofdifferentpH potentiometric response curve
2.3 最佳氧化石墨烯、DNA浓度的选择
实验考查了氧化石墨烯、DNA浓度对DNA/ GO/GCE复合电极电化学响应的影响,考查的氧化石墨烯浓度范围为0.2mg/m L~2mg/mL,DNA的浓度范围为3mg/mL~7mg/mL。
从图5和图6中可以看出,当石墨烯的浓度为1mg/mL、DNA的浓度为5mg/mL时,电极的氧化峰电流最大,且峰电位未发生明显偏移。这是因为随着浓度的逐渐增大,电极上吸附DNA的量逐渐增多,但是玻碳电极的面积是固定的,当达到一定浓度时,吸附DNA的量达到了饱和,继续加大石墨烯和DNA的浓度时,电极上吸附DNA的膜变厚,电极的导电性变差,抑制了DNA分子与电极表面的静电作用,峰电流开始变低,故此分析体系选择石墨烯的浓度为1 mg/mL、DNA的浓度为5mg/mL。
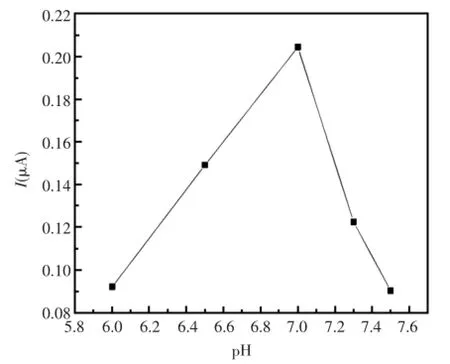
图4 不同pH的PBS缓冲液与峰电流的关系曲线Fig.4 DifferentpH PBSbuffer and the peak currentcurve
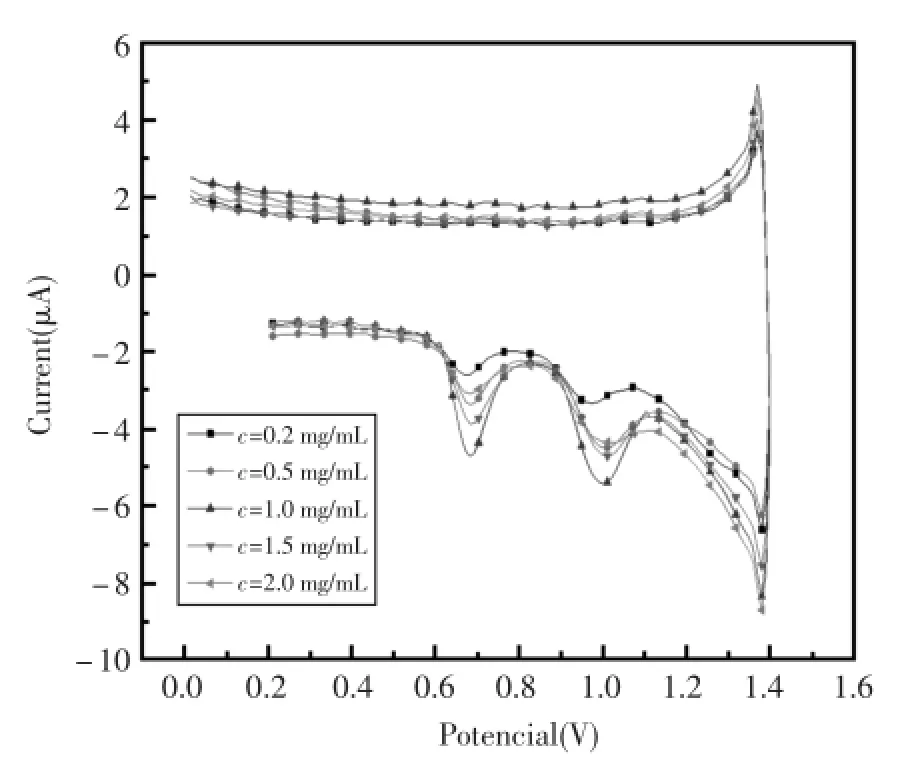
图5 不同浓度的石墨烯吸附DNA后在pH=7.0的PBS缓冲溶液中的电位响应曲线Fig.5 Differentconcentrationsofgrapheneadsorption of DNA in pH=7.0PBSbuffer solution in the potentiometric response curve
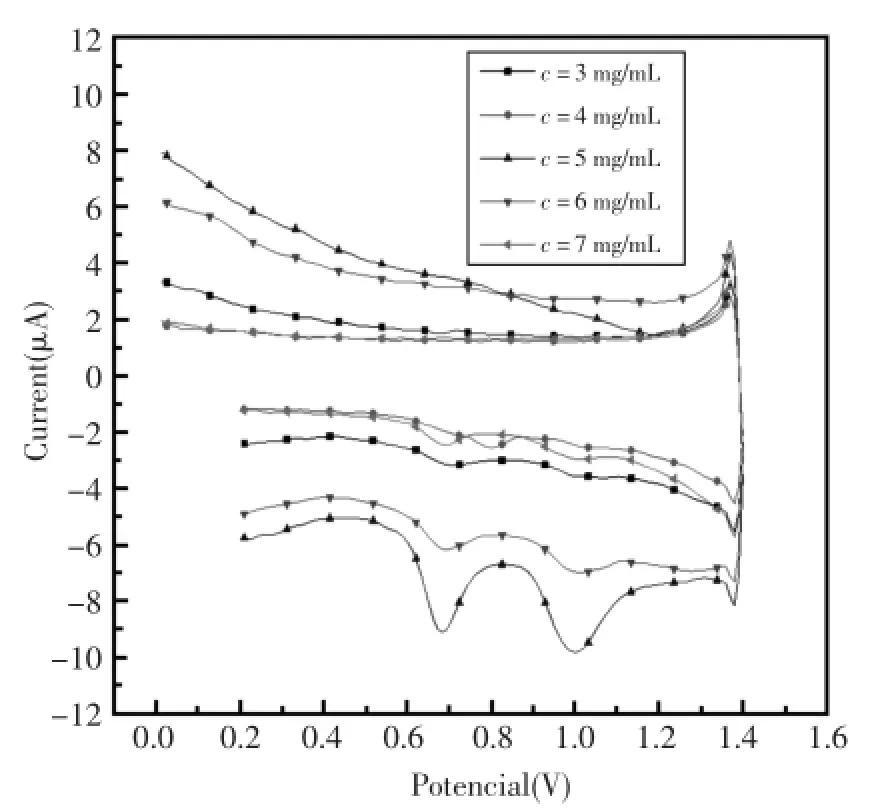
图6 不同浓度的DNA在pH=7.0的PBS缓冲溶液中的电位响应曲线Fig.6 Potentiometric response curvesofdifferent concentration ofDNA in the pH=7.0PBSbuffer solution
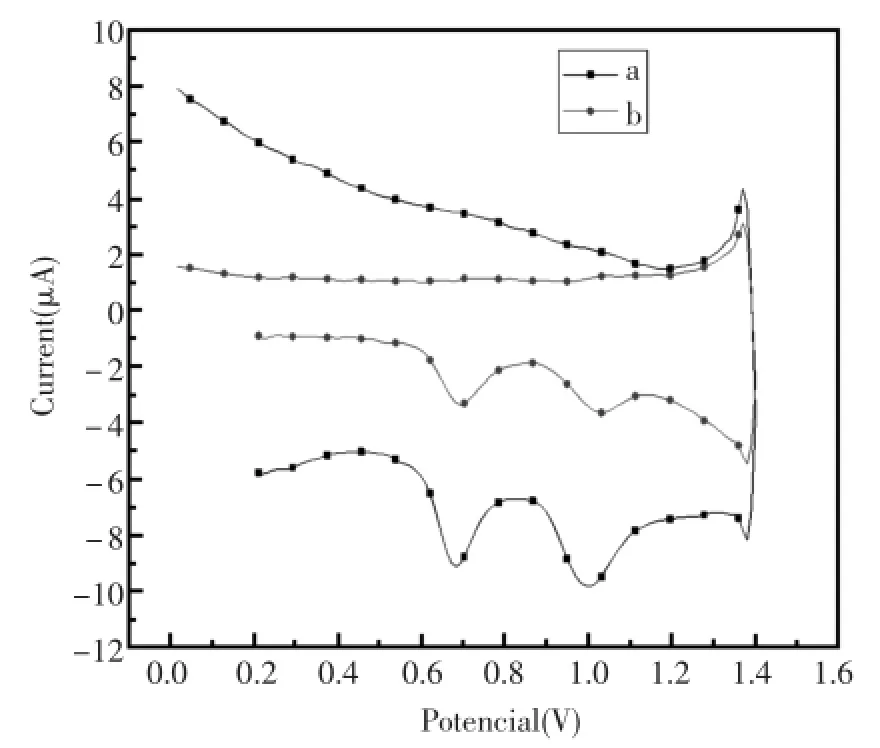
图7 0.1mmol/L的苯酚在DNA传感器上的电位响应曲线Fig.7 0.1mmoL/Lofphenolin thepotentialon the DNA sensor response curve
2.4 苯酚在DNA/GO/GCE复合电极上电化学行为、线性响应范围及重现性
图7中,曲线(a)为DNA/GO/GCE复合电极在pH=7.0的PBS缓冲溶液中的脉冲伏安曲线,曲线(b)为DNA/GO/GCE复合电极在含有0.1mmol/L的苯酚的pH=7.0的PBS缓冲溶液中的对比图,从图中可以看出,苯酚的加入降低了DNA的鸟嘌呤和腺嘌呤在0.7 V和1.0V左右的氧化峰,因为苯酚破坏了DNA分子的碱基对,该作用可体现在鸟嘌呤(G)和腺嘌呤(A)氧化峰电流降低这一电化学行为上。
图8为DNA/GO/GCE复合电极在不同浓度的苯酚溶液中的脉冲伏安图,如图所示,不同浓度的苯酚对氧化峰电流改变量不同。当苯酚浓度超过0.1mmol/L时,鸟嘌呤和腺嘌呤的氧化峰电流降至最低,继续增大污染物的浓度到1×10-3mol/L时,DNA修饰电极对污染物没有响应了,因为苯酚浓度的增大会增加DNA分子的损伤程度,当损伤达到饱和,DNA完全脱离电极表面时,使得电极在未氧化之前失去了活性,从而使DNA复合膜传感器无法对其响应。
从图9可以看出,苯酚浓度在1×10-4~1×10-8mol/L范围内与DNA复合膜传感器响应,氧化峰电流呈良好的线性关系,线性方程为y=0.314 2 x+ 2.534 3,相关系数为0.995 9。
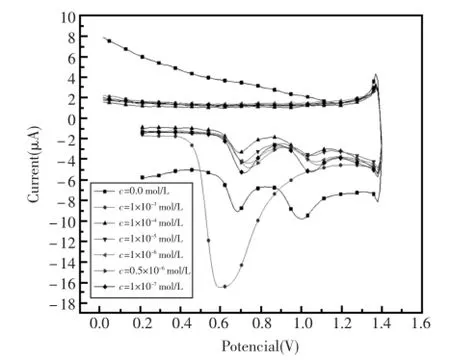
图8 不同浓度的苯酚溶液在DNA复合膜传感器上的电化学行为Fig.8 Differentconcentrationsofphenolin the electrochemicalbehaviorofDNA composite film sensor
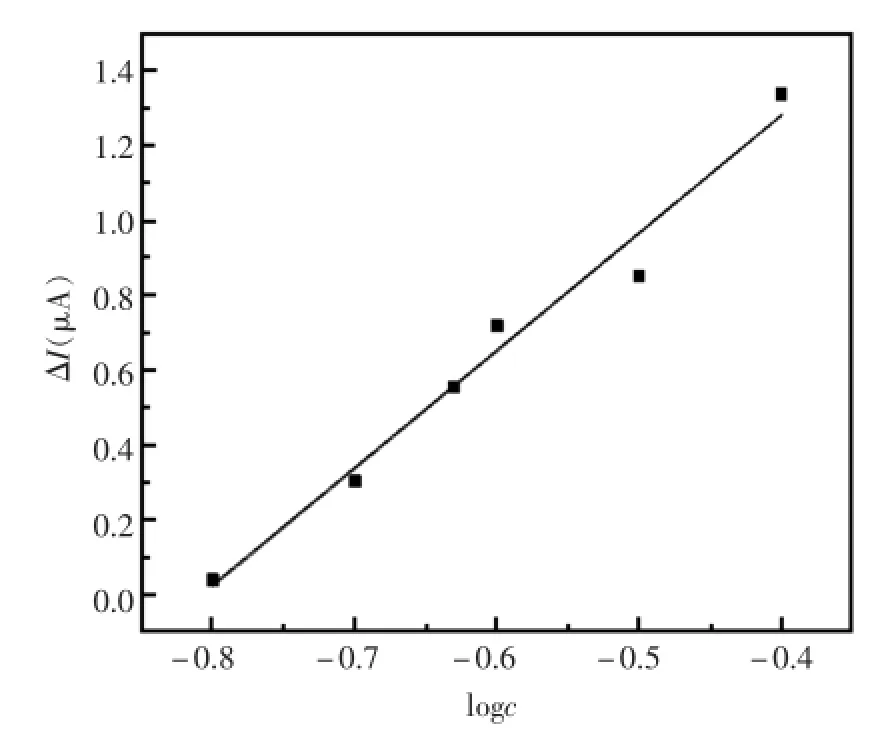
图9 DNA传感器氧化峰电流与苯酚浓度关系Fig.9 DNA sensoroxidation peak currentand phenol concentration
从表1可以看出,电极具有较好的重现性,峰电流的相对标准偏差为2.02%。
表1 DNA复合膜传感器在pH=7.0的PBS缓冲液中的重复测定Tab.1 DNA composite film sensor reproducibility of the determ ination of pH=7.0 PBSbuffer
2.5 紫外光谱法研究苯酚与DNA的作用机理
图10为在pH=7.0的PBS缓冲溶液中,采用紫外光谱法研究苯酚与DNA的作用,a曲线为pH=7.0的PBS缓冲溶液中含有1m L 0.05mg/mL的DNA的紫外可见吸收,b曲线为pH=7.0的PBS缓冲溶液中含有1 mL 0.05 mg/mL的DNA与1mL 0.1mmol/L的苯酚溶液的紫外可见吸收,从图中可以看出,两者均在260 nm左右有吸收,同时还发现,再加入污染物之后,吸光度值明显降低了,同时最大吸收波长出现红移,这是由于在加入苯酚之后,污染物苯酚嵌入到了DNA的双螺旋结构中,使得DNA的双螺旋结构发生扭曲等变化,因此,可以判断出污染物苯酚与DNA的作用为嵌入作用。
图10 苯酚与DNA作用紫外光谱图Fig.10 UV spectrum of interaction phenolwith DNA
3 结论
该文提供了一种可以用于检测苯酚的氧化石墨烯修饰的DNA生物传感器,其制备过程简单、成本低、重现性好,显现出良好的电化学传感性能。在优化的实验条件下,该DNA/GO/GCE传感器的电化学响应信号与苯酚的浓度对数在1.0×10-8~1.0×10-4mol/L范围内呈现良好的线性关系,相关系数为0.995 9,检测下限为1.0×10-8mol/L。该传感器的测定环境为中性,这为实际水样的检测提供了便利,具有一定的理论和实际价值。但该传感器也存在一定的缺陷,它不可重复使用,每次测定前都需重新对电极进行处理,这将是以后的工作需要着重克服的难点。
[1]Watson JD,Crick F H.Molecular structure of nucleic acids:A structure for deoxyribose nucleic acid[J].Nature,1953,171:737~738.
[2]王建龙.DNA生物传感器在环境污染监测中的应用[J].生物化学与生物物理进展,2001,1:125~128.
[3]Wu Z,Zhen Z,Jiang J-H,et al.Term inal protection of small-molecule-linked DNA for sensitive electrochemicaldetection ofprotein binding via selective carbon nanotube assembly[J].J.Am.Chem.Soc.,2009,131(34):12 325~12 332.
[4]张中林.优先污染物优先监测的环境要素研究[J].上海环境科学,1994,1:28~30.
[5]Pumera M,Ambrosi A,BonanniA,etal.Graphene for electrochemical sensing and biosensing[J].Trend.Anal.Chem.,2010,29:954~965.
[6]Oliveira SCB,Corduneanu O,Oliveira-Brett AM.In situ evaluation of heavy-DNA interactions using an electrochemical DNA biosensor[J].Bioelectrochemistry,2008,72:53~58.
[7]王立衡,高凤,蒋淑恋,等.以对苯二甲酸为手臂连接剂的大肠杆菌DNA传感器[J].高等学校化学学报,2013,5:1 072~1 077.
[8]Dora A R,Silvia Aparapani,Stephen Neidle.Triazole acridine conjugates redox mechanisms and in situ electrochemical evaluation of interaction with double-stranded DNA[J].Bioelectrochemistry,2013,89:50~56.
[9]孙星炎,徐春,刘胜辉.DNA电化学传感器在DNA损伤研究中的应用[J].高等学校化学学报,1998,19:1 393~1 396.
[10]Zhang Y-L,Huang Y,Jiang J-H,et al.Electrochemical aptasensor based on proximity-dependent surface hybridization assay for single-step,reusable,sensitive protein detection[J].J.Am.Chem.Soc.,2007,129(50):15 448~15 449.
[11]Lazerges M,Perrot H,Zeghib N.In situ QCM DNA-biosensor probemodification[J].Sensors and Actuators B,2006,120:329~337.
[12]蒋文,袁若.纳米材料在电化学生物传感器及生物电分析领域中的应用[J].分析测试学报,2011,30(11):1 200~1 211.
[13]Castaneda M T,Merkoci A,Pumera M,et al.Electrochemical genosensors for biomedical applications based on gold nanoparticles[J].Biosens Bioelectron,2007,22:1 961~1 967.
[14]张爱春,周存.DNA电化学生物传感器的研究进展[J].天津工业大学学报,2010,29(3):66~80.
[15]Giovanna Marrazza,Iva Chianella,Marco Mascini.Disposable DNA electrochemical biosensors for environmental monitoring[J].Anal.Chim.Acta,1999,387:297~307.
[16]Ting B-P,Zhang J,Gao Z-Q.ADNA biosensorbased on the detection of doxorubicin-conjugated Ag nanopartical labelsusing solid-state voltammetry[J].Biosensors and Bioelectronics,2009,25:282~287.
[17]韦明元,郭良宏,陈浩.用于核酸损伤和化合物基因毒性检测的新型DNA电化学传感器[J].生态毒理学报,2006,1:80~87.
[18]Tapas Kuila,Saswata Bose,Partha Khanra.Recent advances in graphene-based biosensors[J].Biosensorsand Bioelectronics,2011,26:4 637~4 648.
[19]Wang Y,Zhou D-M,Wu Z,etal.Terminal protection of smallmolecule-linked ssDNA-SWNT nanoassembly for sensitive detection ofsmallmoleculeand protein interaction[J].Chinese Chemical Letters,2013,24:107~110.
[20]Nunlnuam A,Karin Y,Torres C,et al.Aptamer-based potentiometricmeasurements of proteins using iIon-selective m icroelectrodes[J].Anal.Chem.,2008,80(3):707~712.
[21]Zhen Z,Tang L-J,Lin J,etal.Endonucleolytic inhibition assay ofDNA/Fok Itransducerasa aensitive platform for homogeneous fluorescence detection of smallmoleculeprotein interactions[J].Anal.Chem.,2012,84(13):5 708~5 715.
[22]叶旭,陈冬梅,李娴.重金属污染物与DNA相互作用的研究进展[J].化工时刊,2010,24(7):49~52.
[23]Long F,Gao C,Shi H-C,etal.Reusable evanescentwaveDNA biosensor for rapid highly sensitive and selective detection of mercury ions[J].Biosensors and Bioelectronics,2011,26:4018~4 023.
[24]Yang M,JavadiA,Gong S.Sensitive electrochemical immunosensor for the detection of cancer biomarker using quantum dot functionalized graphene sheetsas labels[J].Sens.ActuatorsB,2011,155:357~360.
[25]Zhou J,Huang H,Xuan J,et al.Quantum dots electrochemical aptasensor based on three-dimensionally orderedmacroporousgold film for the detection of ATP[J].Biosens Bioelectron,2010,26:834~840.
[26]陶丽华,蔡燕,李在均,等.石墨烯/CdS量子点复合材料的电化学性能研究[J].无机材料学报,2011,26(9):912~916.
[27]Novoselov K S,Geim A K,Morozov SV,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306(5296):666~669.
[28]Hu K-C,Lan D-X,LiX-M,etal.Electrochemical DNA biosensorbased on nanoporous gold electrode and multifunctional encoded DNA-Au bio bar codes[J].Anal.Chem.,2008,80:9 124~9 130.
[29]Zhao J,Chen G,Zhu L,etal.Graphene quantum dotsbased p latform for the fabrication of electrochemical biosensors[J].Electrochem Commun,2011,13:31~33.
[30]韩金土,王兰,宋小进.一步电沉积纳米铜/石墨烯/壳聚糖复合膜修饰玻碳电极测定邻苯二酚[J].化学研究与应用,2012,24(7):1 064~1 068.
[31]Kavanagh P,Leech D.Redox polymer and probe DNA tethered to gold electrodes forenzyme-amplified amperometric detection of DNA hybridization[J].Anal.Chem.,2006,78(8):2 710~2 716.
[32]Wu Z,Wu Z-K,Tang H,etal.Activity-based DNA-gold nanoparticle probe as colorimetric biosensor for DNA methyltransferase/glycosylase assay[J].Anal.Chem.,2013,85(9):4 376~4 383.
[33]卜晓阳,吴敏,周家宏,等.光谱法研究有机农药污染物与DNA的相互作用[J].应用化学,2011,28(4):458~463.
[34]ZengQ,Cheng J-S,Liu X-F,etal.Palladium nanoparticle/chitosan-grafted graphene nanocomposites for construction of a glucose biosensor[J].Biosensors and Bioelectronics,2011,26:3 456~3 463.
[35]Takenaka S,Uto Y,Kondo H,et al.Electrochemically active DNA Probes:Detection of target DNA sequences at femtomole level by hightper formance liquid chromatography with electrochemical detection[J].Anal.Biochem,1994,218:436~443.
[36]Long Y-E,Jiang D-L,Zhu X,etal.Trace Hg2+analysis viaquenchingor the fluorescenceofa CdS-encapsulated DNA nanocomposite[J].Anal.Chem.,2009,81:2 652~2 657.
[37]Liu Chi-Wei,Huang Chih-Ching,Chang Huan-Tsung.Highly selective DNA-based sensor for lead(Ⅱ)and mercury(Ⅱ)ions[J].Anal.Chem.,2009,81:2 383~2 387.
[38]Ren X-H,Xu Q-H.Label-free DNA sequence detection with enhanced sensitivity and selectivity using cationic conjugated polymersand picoGreen[J].Langmuir,2009,25:43~47.
[39]Liu S-J,Wen Q,Tang L-J,etal.Phospholipid-graphene nanoassembly as a fluorescence biosensor for sensitive detection of phospholipase D activity[J].Anal.Chem.,2012,84(14):5 944~5 950.
Based on graphe meoxide modified DNA biosensor for phenol detection
Xu Yun-mei,LiDan*,Zhang Ling,Tong Hai-xia,Yang Rui-qiong,An Zhen-yu,LiWen-qi
(Hunan Provincial Key Laboratory ofMaterials Protection for Electric and Transportation,SchoolofChem istry and Biological Engineering,Changsha University of Scienceand Technology,Changsha410004,China)
Asa typical priority pollutant,phenolhasalways been the importantobjectofenvironmentalmonitoring and pollution control.In the presentwork,we developed a biosensor for phenolmonitoring based on the composite film ofgraphene oxide and DNA.Graphene oxide provided large surface area for DNA immobilization and promoted the electrochemical response of immobilized DNA.Thus,a biosensor using DNA as transducer was constructed.When this biosensorwas immersed in phenol solution,the voltammetric response of DNA was decreased due to the interaction of phenolwith DNA.The signalof the biosensorwas linear to the concentration of phenol in the range of 1.0×10-8~1.0×10-4mol/L.Moreover,the biosensorshowed good stability and reproducibility.
phenol;grapheneoxide;DNA biosensor;electrochemical response
湖南省自然科学基金(12JJ3013,11JJ5010)、长沙理工大学电力与交通材料保护湖南省重点实验室开放基金(2013CL04),湖南省科技厅计划项目(2013NK3002,2011RS4069)
*通讯联系人,E-mail:ld1004@126.com,电话:0731-85258733

