基于石墨烯-海藻酸钠复合材料的辣根过氧化物酶传感器研究
肖福兵,杨欣,2,田锐,张瑞莲,梅琼之,吴朝阳*
(1.湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙 410082)(2.怀化学院化学与化学工程系,湖南怀化 418008)
基于石墨烯-海藻酸钠复合材料的辣根过氧化物酶传感器研究
肖福兵1,杨欣1,2,田锐1,张瑞莲1,梅琼之1,吴朝阳1*
(1.湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙 410082)(2.怀化学院化学与化学工程系,湖南怀化 418008)
构建了一种以海藻酸钠-石墨烯(SA-GR)为基底的新型过氧化氢电化学酶传感器。利用滴涂法将生物相容性良好的海藻酸钠-石墨烯复合物固定在玻碳电极表面,再通过酰胺键将HRP连接在SA-GR复合膜上,从而制备出了性能良好的过氧化氢电化学酶传感器。该传感器重现性好、灵敏度较高,并且响应速度快(3 s),米氏常数较低(Km=0.663),对H2O2检测的线性范围为1.0×10-4~1.2×10-3mol/L,检测下限为5.7×10-6mol/L。
海藻酸钠;石墨烯;辣根过氧化物酶
0 引言
石墨烯作为一种新型的二维纳米材料,其晶体薄膜只有一个碳原子的厚度,是目前室温下导电速度最快、导热能力最强、力学强度最大的材料之一。因其独特的性质,石墨烯引起了极大的关注,在工业中有了广泛的应用,如储能[1],催化剂载体[2],热传输介质[3]和电子元件[4]等。同时,石墨烯具有良好的生物相容性,所以其在电化学生物传感器中也广泛被应用[5~7]。
海藻酸钠,又叫褐藻酸钠,是从褐海藻中提取出的天然多糖,具有良好的亲水性,生物相容性,并且无毒性。在Ca2+存在下能形成不溶于水的海藻酸钙凝胶,海藻酸钙常用作生物催化剂的负载基底。同时,海藻酸钠又是一种很好的成膜材料,能与其它材料在电极表面形成复合膜,其表面可以固定蛋白质或其它生物分子[8~9]。
过氧化氢,在生物体内,是许多酶催化反应的代谢产物,是体内氧化应激重要的标志物[10];在工业生产中,是工业和食品等领域的副产物。此外,在临床、药物和环境分析等领域过氧化氢含量的测定也非常重要[11~12]。随着分析方法的不断发展,测定过氧化氢的方法也越来越多,如滴定分析法[13]、荧光法[14]、高效液相色谱法[15]、比色法[16]、分光光度法[17]、化学发光法[18]和电化学法[19]等。其中,电化学方法由于具有操作简单,选择性和灵敏度高等优点被广泛应用于过氧化氢的分析。
该文利用海藻酸钠、石墨烯复合材料在电极表面共同成膜,再通过Ca2+对膜进行交联固化后,用EDC/NHS活化复合膜表面的羧基,最后通过酰胺键将辣根过氧化物酶固定在电极表面,从而构建出一种以海藻酸钠和石墨烯为基底的新型过氧化物酶电化学传感器,并研究了该传感器对过氧化氢的分析测定和其电化学行为。
1 实验部分
1.1 试剂和仪器
海藻酸钠(SA,Sigma-Aldrich);石墨烯(GR,南京先丰纳米材料有限公司);辣根过氧化物酶(HRP,上海鼎国生物技术有限公司);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,Sigma-Aldrich);N-羟基丁二酰亚胺(NHS,上海源叶生物科技有限公司);0.3μm和0.05μm铝粉(上海辰华仪器有限公司);二水磷酸氢二钠、十二水磷酸二氢钠、铁氰化钾、亚铁氰化钾、氯化钾、氯化钙均购于(国药集团化学试剂有限公司,分析纯)。其它试剂均为分析纯,所用到的水溶液均用超纯水(R=18.25MΩ)配制。
CHI900B电化学工作站(上海辰华仪器有限公司);三电极系统:修饰辣根过氧化物酶-海藻酸钠-石墨烯的玻碳电极(HRP-SA-GR/GC)作为工作电极,饱和Hg2Cl2电极(SCE)作为参比电极,铂电极(Pt)作为对电极。
1.2 海藻酸钠-石墨烯修饰电极的制备及HRP的固定
取4mg石墨烯和4mg海藻酸钠于3mL的血清瓶中,加入2mL灭菌水,对其超声分散2 h,得到均匀分散的黑色悬浊液(SA-GR)。将此悬浊液置于冰箱4℃保存备用。
玻碳电极的预处理:玻碳电极在使用前,首先分别用0.3μm和0.05μm的氧化铝粉末打磨处理,至电极表面成光滑的镜面,再将电极分别用超纯水、乙醇、超纯水各超声5min洗净,最后用N2吹干。
在已预处理的玻碳电极表面滴加8μL已制备的SA-GR黑色悬浊液,在室温条件下让其自然干燥;待完全风干后,在其上滴加5μL 4% CaCl2溶液,反应1 h,让海藻酸钠与Ca2+反应生成不溶于水的海藻酸钙,超纯水清洗电极表面未反应的Ca2+,氮气吹干;将8μL EDC(126mmol/L)/ NHS(63mmol/L)溶液滴在修饰电极表面,活化羧基1 h;最后,8μL 20mg/mLHRP滴在上面已修饰好的电极表面,放于湿度为100%、温度为4℃的密闭容器中反应过夜。这样即制得了辣根过氧化物酶传感器(HRP-SA-GR/GC)。构建过程如图1所示。
2 结果与讨论
2.1 电极修饰过程的电化学表征
采用循环伏安法对电极的修饰过程进行了表征。图2是不同电极在电位区间为0.3~-0.8 V、缓冲液为0.1 mol/L PBS(pH=7.0)中的循环伏安曲线。由图2可知,裸玻碳电极(GC)(曲线c)和SA-GR修饰的玻碳电极(曲线b)均未出现明显的氧化还原峰,但是SA-GR修饰的玻碳电极背景电流有显著增加,这说明GR-SA显著地增大了电极的导电能力和有效表面积。HRPSA-GR电极(曲线a)在-0.4 V和-0.1 V附近出现了一对氧化还原峰,通过与曲线a、b进行对比可知这是HRP的氧化还原峰。综合比较图2曲线a、b、c可得知,HRP成功的被修饰在SA-GR基底表面并且能够较好的进行直接电子转移反应。
2.2 扫描速度对峰电流的影响
考察了扫描速度对HRP-SA-GR/GC峰电流的影响,分别选取扫速为100、200、300、400、500 mV/s。如图3,HRP-SA-GR/GC的氧化还原峰电流随着扫描速率的增加而增大。由图4可知氧化、还原峰电流与扫描速率(100~500mV/s)呈良好的线性关系,说明在该扫描速率范围内,电极反应受表面过程控制。
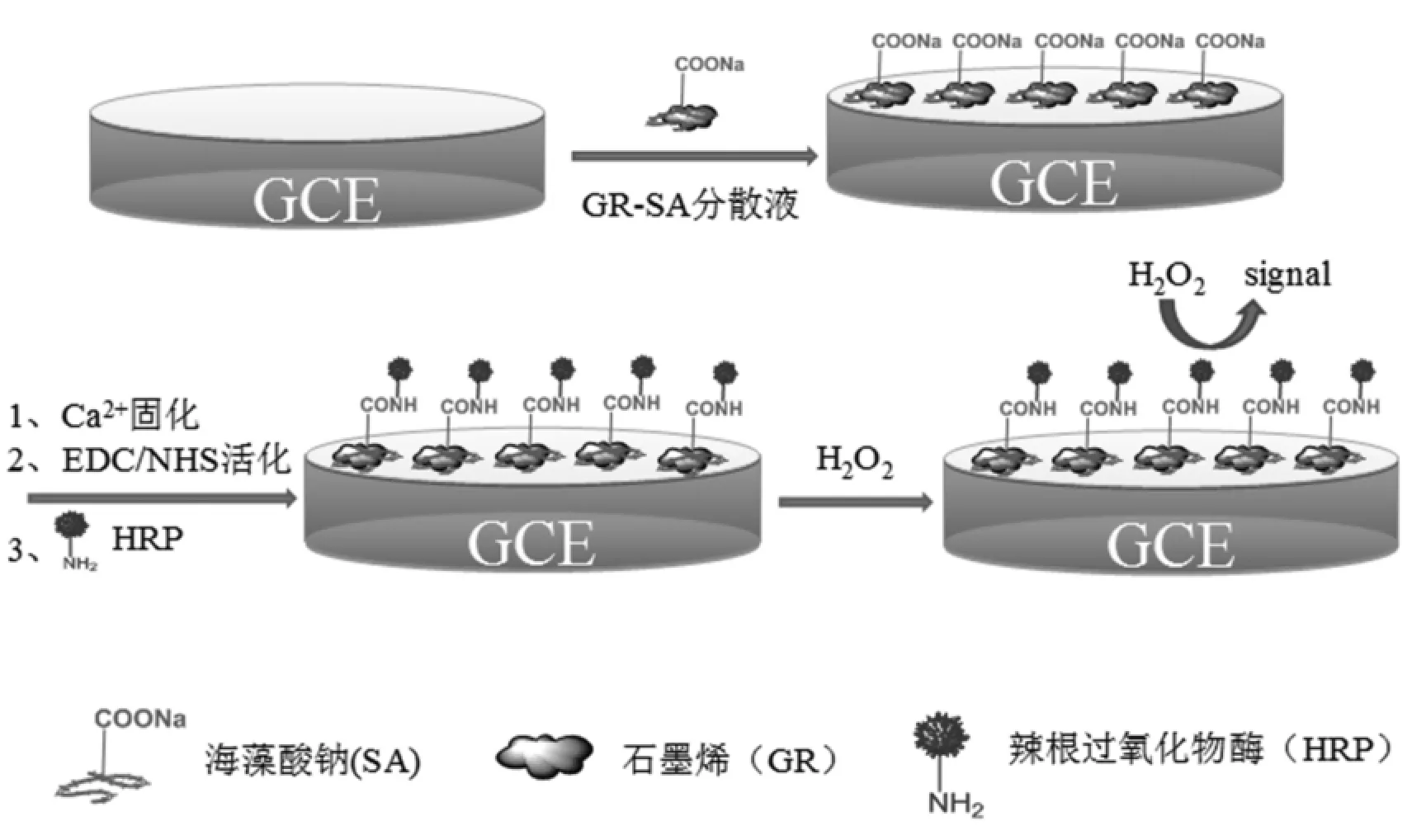
图1 辣根过氧化物酶传感器构建示意图Fig.1 The schematic of the HRPbiosensor fabrication process
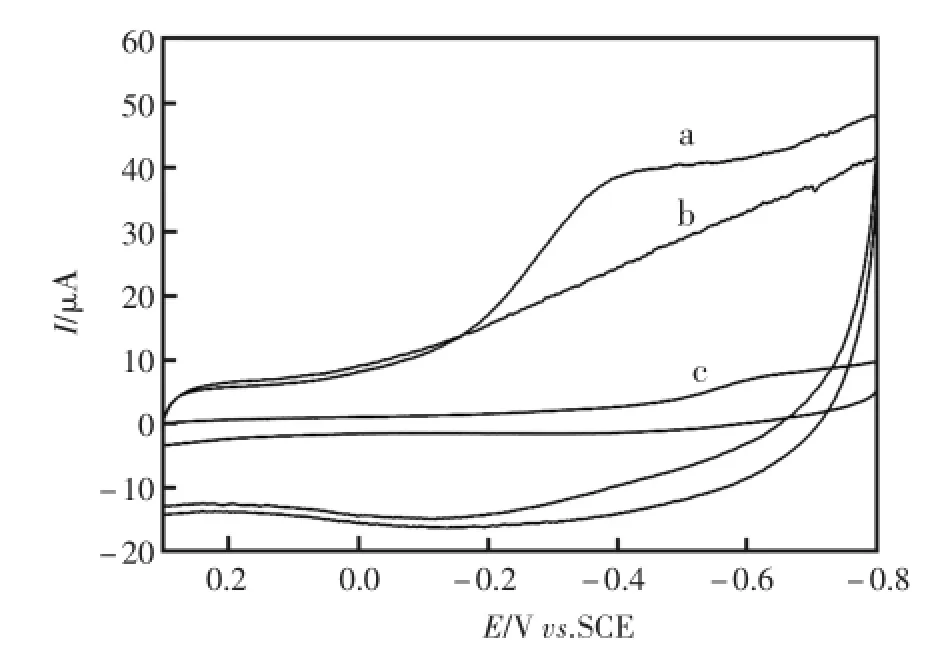
图2 不同修饰电极的循环伏安图a)HRP-SA-GR/GC,b)SA-GR/GC和c)GCFig.2 The CVsof differentmodified electrodes a)HRP-SA-GR/GC,b)SA-GR/GC and c)GC
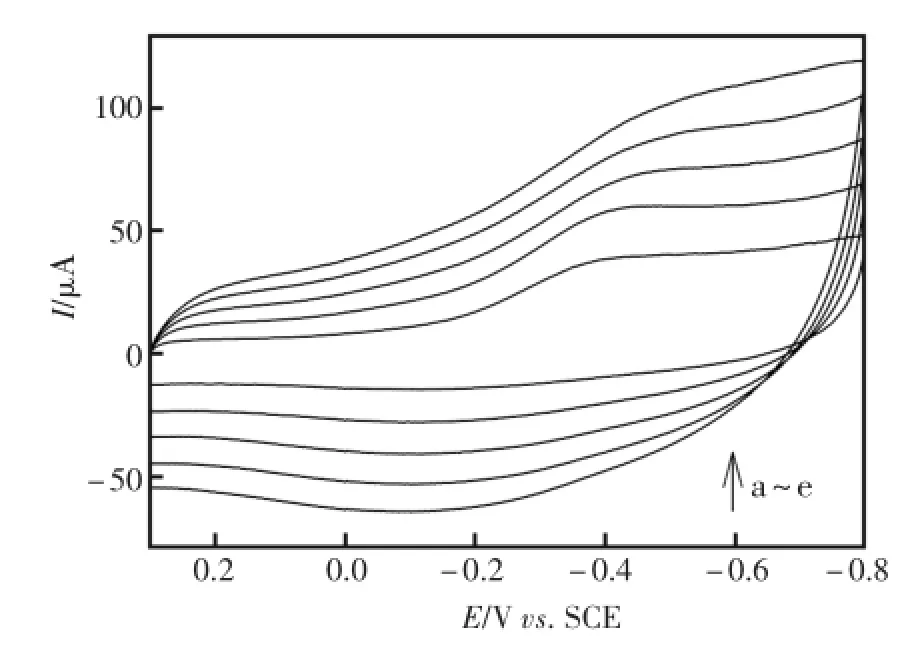
图3 不同扫速下的循环伏安图a~e:500、400、300、200和100mV/sFig.3 The CVsof themodified electrodeatdifferentscan rates.a~e:500、400、300、200 and 100mV/s
2.3 pH值对催化活性的影响
由于酶的活性受pH值的影响很大,实验研究了缓冲液的pH值对酶传感器的影响。图5(A~E)是酶电极在pH6.0~pH8.0的PBS中加入1 mmol/LH2O2的计时电流曲线。由图5(F)可知,在pH6.0~pH8.0的范围内,随着pH的增大i-t曲线响应电流的变化先增大后减小,在pH=7.0时响应电流为最大值,同时比较图5(A~E)可以看出,当pH=6.0时酶电极的响应时间变长,响应时间由最快的3 s延长到20 s以上,这可能是由于pH过低导致酶电极活性受到抑制,因此选择pH= 7.0的PBS作为检测缓冲溶液。
2.4 干扰实验
为了考察酶电极的特异性,加入了一些常见的干扰物质来研究传感器的抗干扰能力。如图6所示,向pH=7.0的PBS溶液中依次加入1 mmol/LH2O2、10mmol/L葡萄糖(GLC)、10mmol/L抗坏血酸(AA);以酶电极为工作电极,在-0.4 V下进行计时电流扫描。从图中可以很明显的看出,相对于H2O2的电流响应抗坏血酸和葡萄糖的电流响应很小,基本可以忽略。说明此传感器对H2O2有着良好的选择性,具有很好的抗干扰能力。
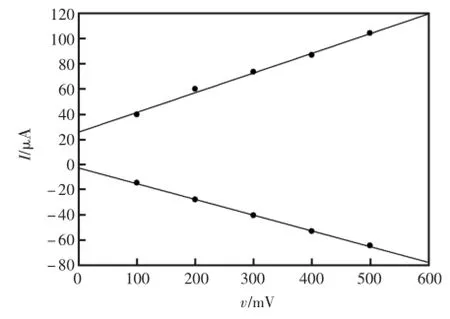
图4 峰电流与扫描速度的关系Fig.4 The relationship between peak currentand the sweep rate
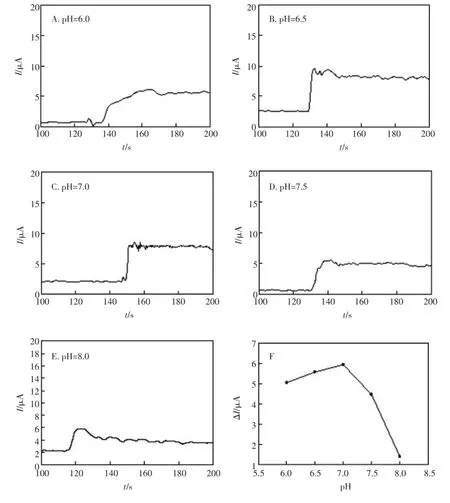
图5 不同pH值下催化H2O2的计时电流曲线Fig.5 Amperometric responsesofH2O2catalysed atdifferentpH values
2.5 对过氧化氢的计时电流响应
为了研究HRP-SA-GR/GC中HRP对过氧化氢的电催化能力,分别对SA-GR/GC和HRPSA-GR/GC在PBS缓冲溶液(pH=7.0,0.1mol/L)中进行计时电流扫描,如图7所示,曲线a为HRP-SA-GR/GC在加入1mmol/LH2O2的缓冲溶液中的计时电流曲线,曲线b为SA-GR/GC在加入1mmol/LH2O2的缓冲溶液中的计时电流曲线。可以得知SA-GR/GC的电流响应较小,而HRP-SA-GR/GC电极对过氧化氢的响应明显,曲线a的响应电流约为曲线b的7倍。对比可知,曲线a相对于曲线b增大的电流即是HRP对H2O2的催化还原电流。以上实验结果表明,固定在SA-GR上的HRP保持其良好的生物催化活性,能有效催化H2O2的电化学还原。
同时,通过采用计时电流实验研究了酶电极的电流响应与H2O2浓度之间的关系。实验的电位设定在-0.4 V,缓冲液为pH=7.0的PBS(通入N2除氧),实验结果如图8,图9所示,HRP-SAGR/GC对H2O2的响应随着其浓度的增加,响应电流逐渐变大,当加入的H2O2浓度越大,电流变化越明显;并且响应电流与过氧化氢的浓度在1.0×10-4~1.2×10-3mol/L范围内呈现出了良好的线性关系。线性方程为:I(μA)=2.83+0.003 8 c(μmol/L)(r=0.998)。基于3倍信噪比,可求得该传感器的检测下限为5.7×10-6mol/L(S/N=3)。
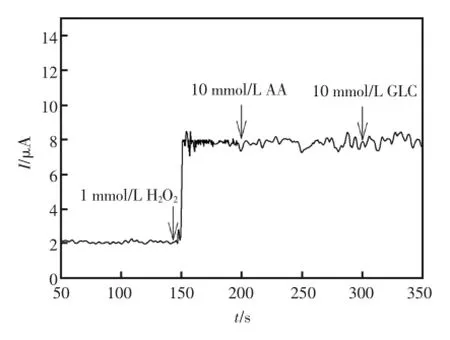
图6 干扰实验Fig.6 Interference experiment
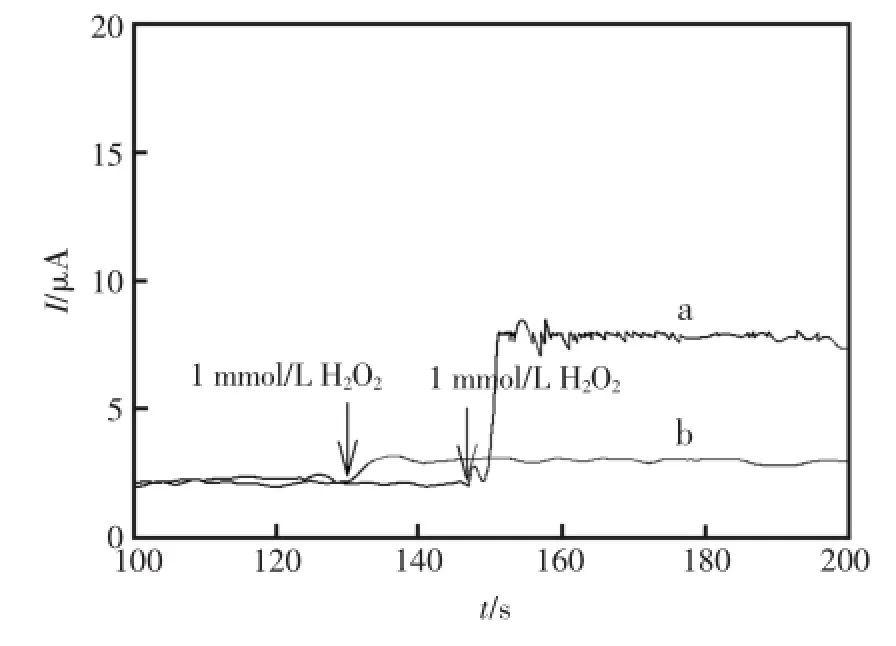
图7 不同修饰电极对1mmol/LH2O2的响应a)HRP-SA-GR/GC和b)SA-GR/GCFig.7 The responseofdifferentelectrodes for1mmol/L H2O2.a)HRP-SA-GR/GCand b)SA-GR/GC
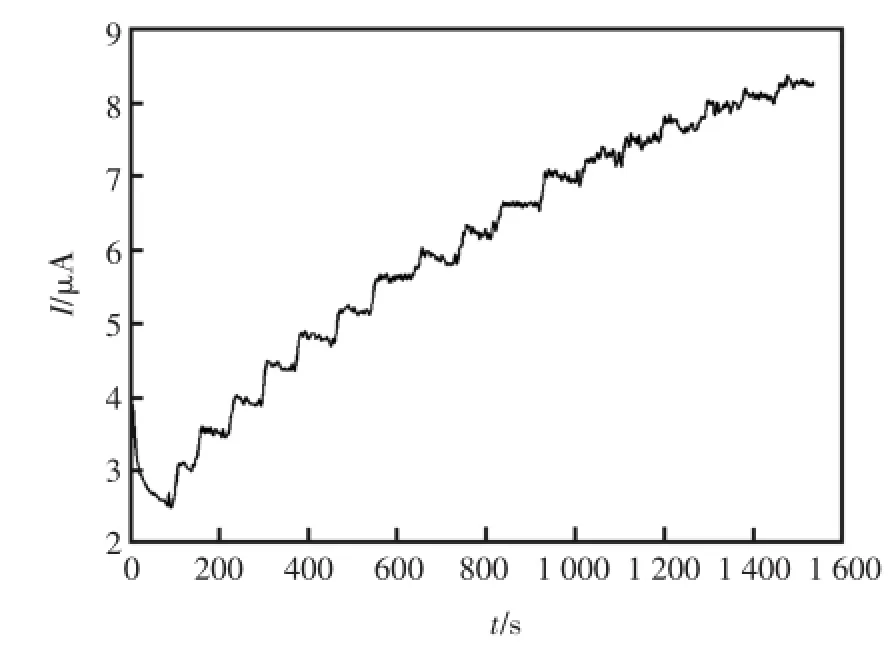
图8 连续加入100μmol/LH2O2的计时电流响应曲线Fig.8 The response forsuccessiveaddition of100μmol/L H2O2
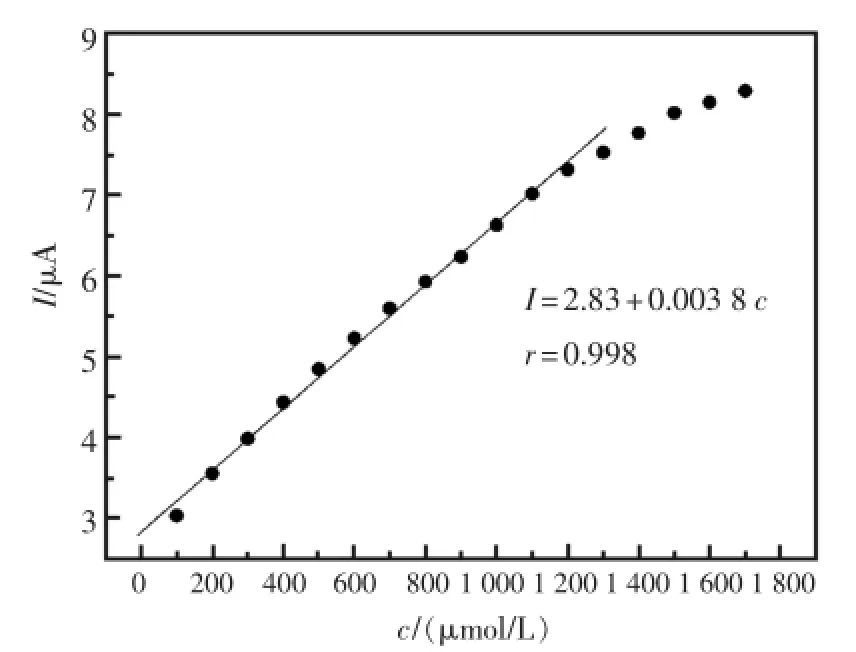
图9 H2O2浓度与电流的线性关系Fig.9 The linear relationship between the concentration of H2O2and the current
2.6 HRP-SA-GR/GC表观米氏常数的测定
如图9,酶电极HRP-SA-GR/GC测定H2O2时,当过氧化氢的浓度较小时,它的稳态响应电流I随c线性增大;当c较大时,I与c基本无关,表现出Michaelis-Menten的动力学特征。根据Michaelis-Menten方程Iss-1=1/Imax+Km/(Imaxc),其中的Iss为加入一定浓度底物后的响应电流,Imax为所加底物饱和时的极限(最大)电流,c为加入的底物浓度,米氏常数是表征酶与底物之间亲和力的统计标准[20]。通过对H2O2的浓度的倒数(c-1)和其对应的电流响应的倒数(Iss-1)作图(图10)可求算出该生物传感器的米氏常数为0.663mmol/L,这比文献中报道的值要小[21~24]。较小的米氏常数表明通过该方法固定的酶能保持其良好催化活性,同时也说明它与H2O2的亲和力较大。
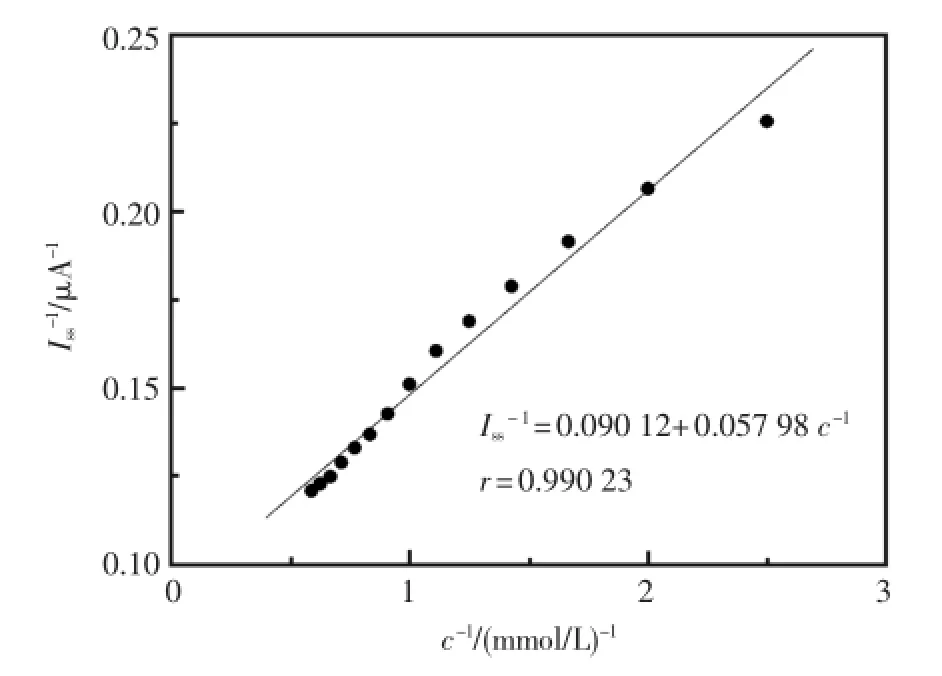
图10 米氏常数的测定Fig.10 The determ ination ofm ichaelis constant
3 结论
通过滴涂法把生物相容性良好的复合膜SA-GR固定到电极表面,然后再通过酰胺键将HRP固定在SA-GR复合膜上,从而制备出了性能良好的过氧化氢电化学酶传感器。HRP在PBS缓冲液中能发生直接电子转移。该传感器灵敏度较高,重现性好,具有较低的米氏常数(Km=0.663),对H2O2的检测线性范围为1.0×10-4~1.2×10-3mol/L,检测下限为5.7×10-6mol/L(S/N= 3),响应时间低至3 s。SA-GR复合材料为生物催化和生物电化学传感器的研究提供了一个良好的检测平台。
[1]Wu Z S,Zhou G,Yin L C,etal.Graphene/metal oxide composite electrode materials for energy storage[J].Nano Energy,2012,1(1):107~131.
[2]Li Y,Tang L,Li J.Preparation and electrochem ical performance for methanol oxidation of Pt/graphene nanocomposites[J].Electrochemistry Communications,2009,11(4):846~849.
[3]Baby T T,Ramaprabhu S.Enhanced convective heat transfer using graphene dispersed nanofluids[J].Nanoscale Research Letters,2011,6(1):1~9.
[4]Avouris P.Graphene:Electronic and photonic properties and devices[J].Nano Letters,2010,10(11):4 285~4 294.
[5]Shao Y,Wang J,Wu H,et al.Graphene based electrochemical sensors and biosensors:a review[J].Electroanalysis,2010,22(10):1 027~1 036.
[6]Feng R,Zhang Y,Ma H,et al.Ultrasensitive non-enzymatic and non-mediator electrochemical biosensor using nitrogen-doped graphene sheets for signal amplification and nanoporousalloy as carrier[J].Electrochimica Acta,2013,97:105~111.
[7]Shan C,Yang H,Song J,etal.Directelectrochemistry of glucose oxidase and biosensing for glucose based on graphene[J].Anal.Chem.,2009,81(6):2 378~2 382.
[8]Zhao H,ZhengW,Meng Z,et al.Bioelectrochemistry of hemoglobin immobilized on a sodium alginate-multiwall carbon nanotubes composite film[J].Biosensors and Bioelectronics,2009,24(8):2 352~2 357.
[9]WeiS,Dandan W,Ruifang G,et al.Direct electrochemistry and electrocμatalysis of hemoglobin in sodium alginate film on a BMIMPF6modified carbon paste electrode[J].Electrochemistry Communications,2007,9(5):1 159~1 164.
[10]Baek K H,Oh KW,LeeW Y,etal.Association of oxidative stress with postmenopausal osteoporosis and the effects of hydrogen peroxide on osteoclast formation in human bone marrow cell cultures[J].Calcified Tissue International,2010,87(3):226~235.
[11]Jv Y,LiB,Cao R.Positively-charged gold nanoparticles as peroxidiasemimic and their application in hydrogen peroxide and glucose detection[J].Chemical Communications,2010,46(42):8 017~8 019.
[12]Ng SM,Choi JY,Han H S,etal.Novelmicroencapsulation of potential drugs with low molecular weight and high hydrophilicity:Hydrogen peroxide as a candidate compound[J].International Journal of Pharmaceutics,2010,384(1):120~127.
[13]Klassen NV,Marchington D,McGowan H C.H2O2determination by the I3-method and by KMnO4titration[J].Anal.Chem.,1994,66(18):2 921~2 925.
[14]Abbas M,LuoW,Zhu L,et al.Fluorometric determination ofhydrogen peroxide inmilk by using a Fenton reaction system[J].Food Chemistry,2010,120(1):327~331.
[15]PinkernellU,Effkemann S,KarstU.SimultaneousHPLC determination of peroxyacetic acid and hydrogen peroxide[J].Anal.Chem.,1997,69(17):3 623~3 627.
[16]EisenbergG.Colorimetric determination ofhydrogen peroxide[J].Industrial&Engineering Chemistry Analytical Edition,1943,15(5):327~328.
[17]Matsubara C,Kawamoto N,Takamura K.Oxo[5,10,15,20-tetra(4-pyridyl)porphyrinato]titanium(IV):an ultrahigh sensitivity spectrophotometric reagent for hydrogenperoxide[J].Analyst,1992,117(11):1 781~1 784.
[18]Yuan J,Shiller AM.Determ ination of subnanomolar levelsofhydrogen peroxide in seawaterby reagent-injection chemiluminescence detection[J].Anal.Chem.,1999,71(10):1 975~1 980.
[19]Huang K J,Niu D J,Liu X,etal.Direct electrochemistry of catalase at amine-functionalized graphene/gold nanoparticles composite film for hydrogen peroxide sensor[J].Electrochimica Acta,2011,56(7):2 947~2 953.
[20]Li J,Lin X.Glucose biosensor based on immobilization of glucose oxidase in poly(o-aminophenol)film on polypyrrole-Pt nanocomposite modified glassy carbon electrode[J].Biosensors and Bioelectronics,2007,22(12):2 898~2 905.
[21]Zhou K,Zhu Y,Yang X,etal.A novelhydrogen peroxide biosensor based on Au-graphene-HRP-chitosan biocomposites[J].Electrochimica Acta,2010,55(9):3 055~3 060.
[22]Xiang C,Zou Y,Sun L X,et al.Direct electrochemistry and enhanced electrocatalysis of horseradish peroxidase based on flowerlike ZnO-gold nanoparticle-Nafion nanocomposite[J].Sensors and Actuators B:Chem ical,2009,136(1):158~162.
[23]Chen H,Dong S.Direct electrochemistry and electrocatalysis of horseradish peroxidase immobilized in solgel-derived ceramic-carbon nanotube nanocomposite film[J].Biosensors and Bioelectronics,2007,22(8):1 811~1 815.
[24]Tan X,Zhang J,Tan S,et al.Amperometric hydrogen peroxide biosensor based on horseradish peroxidase immobilized on Fe3O4/chitosan modified glassy carbon electrode[J].Electroanalysis,2009,21(13):1 514~1 520.
Graphene-sodium alginate com positebased horseradish peroxidase biosensor
Xiao Fu-bing1,Yang Xin1,2,Tian Rui1,Zhang Rui-lian1,MeiQiong-zhi1,Wu Zhao-yang1*
(1.State Key Laboratory ofChemo/Biosensingand Chemometrics,CollegeofChemistry and ChemicalEngineering,Hunan University,Changsha410082,China)(2.DepartmentofChemistry and Chemical Engineering,Huaihua Collge,Huaihua418008,China)
A new type of enzyme electrochemicalsensor for hydrogen peroxidewas constructed alginate-graphene(SA-GR)composite.The biocompatible alginate-graphene composite is fixed to the glassy carbon electrode surface by drop-coatingmethod,and then HRP is linked to the SA-GRmembrane through an am ide bond,thereby the HRP electrochemicalbiosensorwith good performance is prepared for hydrogen peroxide.This biosensor has high sensitivity,good reproducibility,fast response(3 s),low Michaelis constant(Km=0.663)and agood linear relationship for detection H2O2in the range from 1.0×10-4to1.2×10-3mol/L.The detection limitwasestimated tobe5.7×10-6mol/L.
sodium alginate;graphene;horseradish peroxidase
国家自然科学基金(批准号:J1210040,J1103312)
*通讯联系人,Email:zywu@hnu.edu.cn

