盐酸伊托必利片的处方筛选及生物等效性研究
崔瑾瑾
(湖北中医药大学附属襄阳市中医医院,湖北襄阳 441000)
盐酸伊托必利片的处方筛选及生物等效性研究
崔瑾瑾
(湖北中医药大学附属襄阳市中医医院,湖北襄阳 441000)
目的:筛选确定盐酸伊托必利片的最佳处方,并确定其生物等效性。方法:利用片剂基本性能评价筛选出盐酸伊托必利片合适的处方,再考察体外溶出度,优化出最佳的处方配比。利用其试制药品与参比药品在大鼠体内的药代动力学曲线比较,确定生物等效性。结果:处方确定为盐酸伊托必利50 g,微晶纤维素24 g,乳糖40 g,羧甲淀粉钠7 g,1%羟丙甲纤维素溶液适量,硬脂酸镁0.6 g,制成1 000片。试制药与参比药的血药浓度变化趋势基本一致,与参比药品相比具有生物等效性。结论:按照上述处方制成的成品,处方合理,方法简单,便于生产。
盐酸伊托比利;体外溶出度;处方筛选;生物等效性
盐酸伊托必利具有多巴胺D2受体拮抗活性和乙酰胆碱酯酶抑制活性,通过两者的协同作用发挥胃肠促动力作用,本研究根据国外已上市的盐酸伊托比利片的释药特点及药动学特点,研究并筛选盐酸伊托必利片处方,以体外溶出度为指标优化处方工艺,通过比较其与参比药品在大鼠体内的药代动力学曲线,确定处方的合理性。现将筛选方法介绍如下:
1 仪器与试药
1.1 仪器
ZP21W旋转式压片机;BYJ-C型崩解仪;RC-8药物溶出仪;UV2401岛津紫外分光光度仪;KQ2200E型超声波清洗器。
1.2 试药
盐酸伊托比利(批号:H090607,修正药业集团柳河制药有限公司);参比样品(批号:58048YQ,Abbott Japan Co.Ltd);其余辅料均符合药典要求;试剂均为分析纯。
2 方法与结果
2.1 处方筛选
根据辅料的作用和类别,初步拟定崩解剂羧甲淀粉钠、黏合剂1%羟丙甲纤维素溶液,考察片剂填充剂、润滑剂(处方辅料筛选及试验设计见表1,2),通过片剂基本性能评价处方筛选结果(见表3)。

表1 处方辅料筛选

表2 处方试验设计
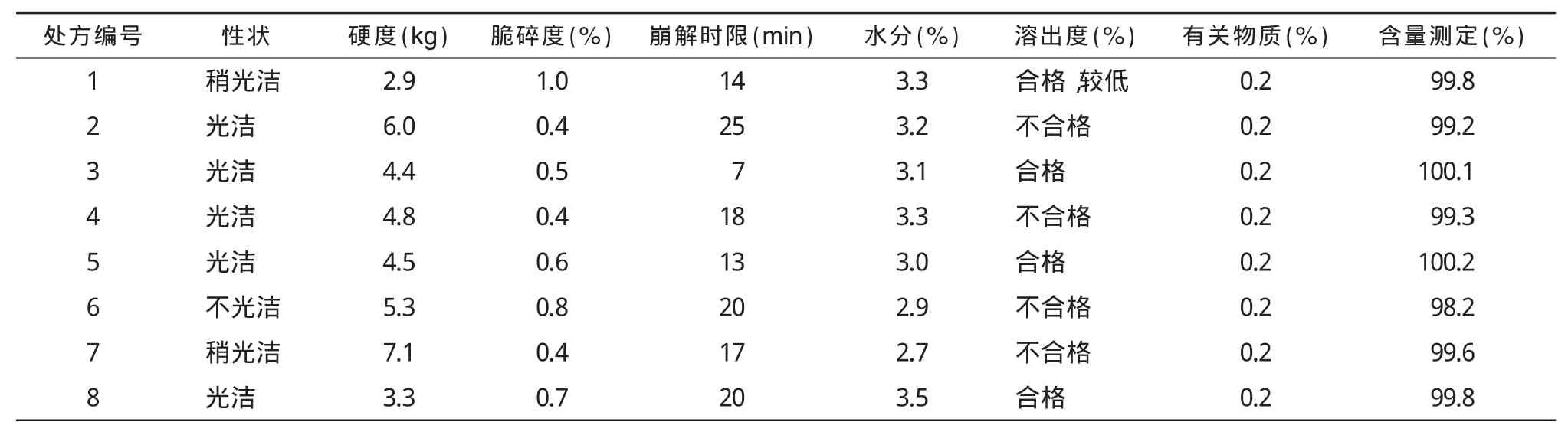
表3 处方筛选基本性能评价
2.1.1 处方筛选结果从表3可知,处方1,6,7性状不光洁,且崩解时间较长,溶出率均值89%,最低溶出率仅82%,不理想;处方2,4崩解时间较长,且处方2溶出有3片不合格,溶出度较低,不理想;处方3,5,8在压力一致的前提下,处方3崩解时间较为适中,溶出率无差别,故初步确定采用处方3进行优化。
2.2 处方优化
根据上述试验确定的处方,对处方3进行优化,优化后的处方分别为处方9~12。结果见表4,5,6及图1。
2.2.1 处方优化结果由表5可知,处方3,处方9~12的成片性状、硬度、脆碎度、水分、有关物质几项指标间无较大差别,只在崩解时间与含量测定上有些许差异,从表6不同处方累积溶出度的比较可知,处方10与参比样品的体外溶出曲线较为一致,并且表5显示此处方的崩解时间适中,含量测定为100%左右,故确定处方10作为盐酸伊托必利片的处方。
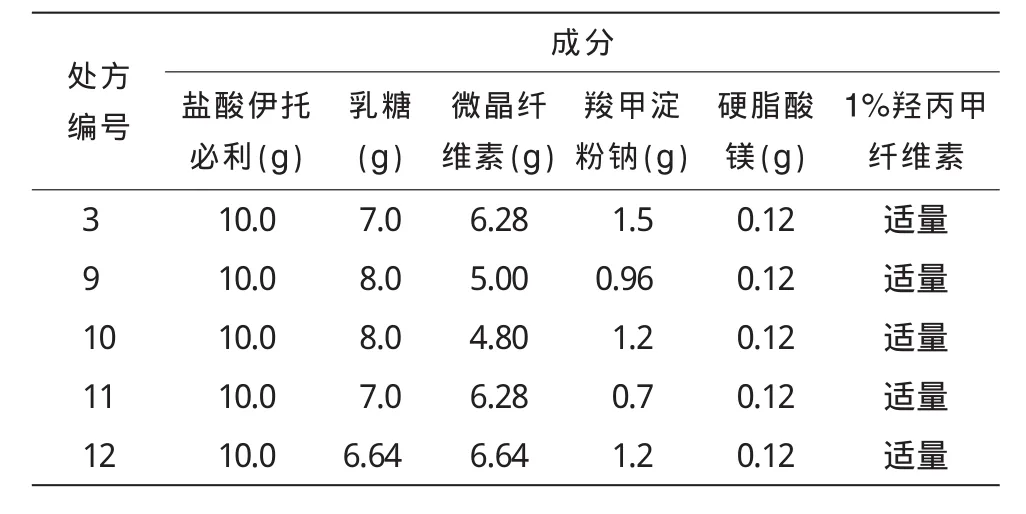
表4 处方优化结果
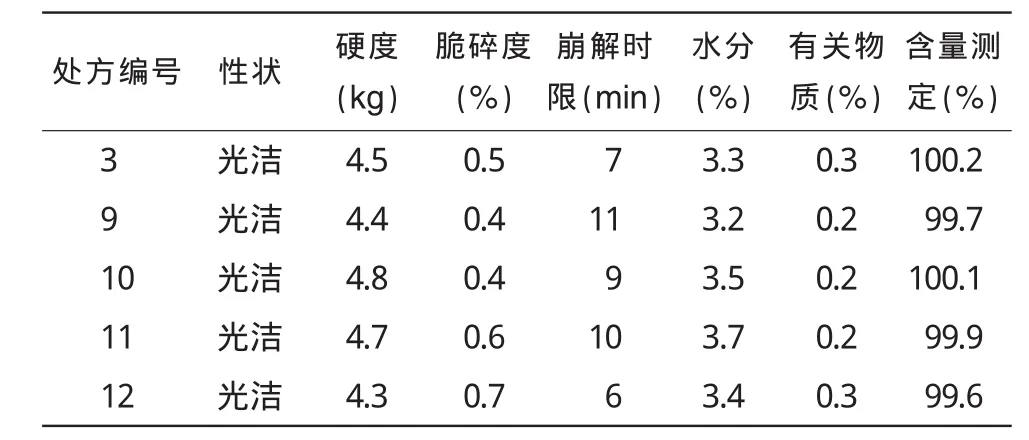
表5 处方优化基本性能评价
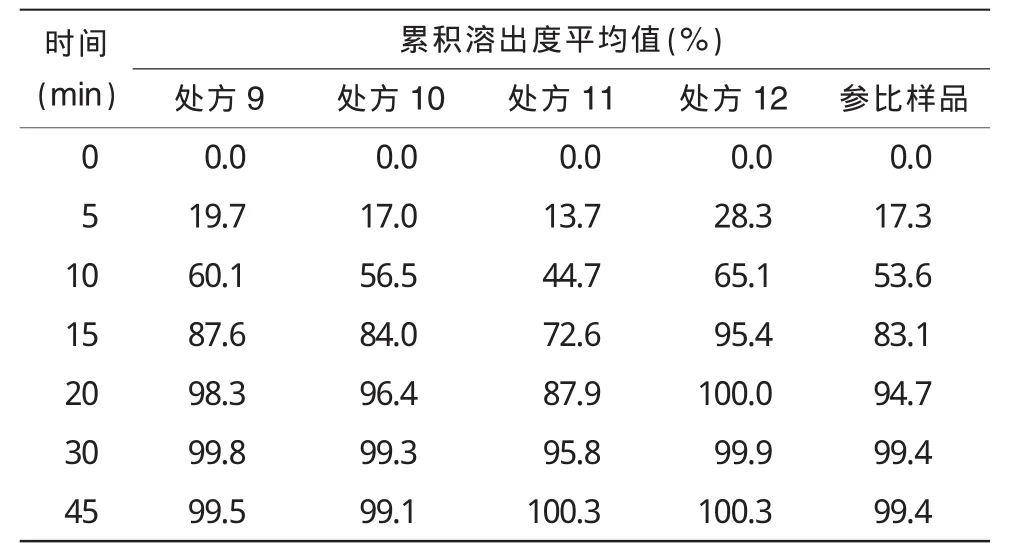
表6 不同处方累积溶出度的比较
2.3 处方确定
根据处方设计和处方优化,确定盐酸伊托必利片的处方为盐酸伊托必利50 g,微晶纤维素24 g,乳糖40 g,羧甲淀粉钠6 g,1%羟丙甲纤维素溶液适量,硬脂酸镁0.6 g,制成1 000片。
3 试制药在大鼠体内的血药浓度测定
3.1 试验材料
3.1.1 动物SD大鼠,20只,体质量270~330 g,雌雄各半,由武汉生物制品研究所提供。动物合格证号:SCXK(颚2003-0003)。
3.1.2 试药盐酸伊托必利标准品,批号:100939-200701,由中国药品生物制品检定所提供。参比样品,批号:58048YQ(Abbott Japan Co.Ltd)。盐酸伊托比利片试制品,批号:20140612,规格50 mg,由襄阳市中医医院药研所提供。试验前取若干片研粉,取平均片质量用注射用水配制成约0.12 g/m L的溶液备用。
3.1.3 动物饲养环境室温:(22±1)℃,湿度:60%~75%,试验动物设施合格证号:SYXK(颚)2008-2009。 3.1.4仪器与试剂岛津LCMS-8030液相色谱串联质谱联用仪;3-30KS高速台式冷冻离心机;GRANT V-32型多功能旋涡混合器;KL512型氮吹仪;KQ2200E型超声波清洗器;TG328A型光学读书分析天平;0.45 μm微孔滤膜;试剂:实验中所用乙腈为色谱纯,其他均为分析纯,试验用水为二次重蒸水。
3.2 试验方法
3.2.1 单次给药试制组与参比组各10只大鼠,按40 m L/kg体积灌胃给药,血浆样本的采集为给药前(药前3 h),给药后的0.25,0.5,1.0,1.5,2.0,3.0,4.0,6.0,8.0,10.0,12.0,24.0 h,每组内大鼠随机分两组(每组5只),第1组在0.25,1.0,2.0,4.0,8.0,12.0时取血,第2组在0.5,1.5,3.0,6.0,10.0,24.0时取血,每次均取血4 m L,在3 000 r/min离心10 m in分离血清,于-20℃保存。
3.2.2 血样处理取1.0 m L血清,加入1 mol/L氢氧化钠0.5 m L,乙醚6 m L,涡流混合2 min,2 500 r/m in离心10 m in。分取上层有机相于另一试管中,40℃空气流下吹干,残留物加入100 μL流动相溶解,取20 μL进样分析。
3.2.3 色谱条件固定相:Diamonsil C18柱(250mm× 4.6 mm,5 μm));流动相:0.05 mol/L磷酸二氢钾(pH3.5):乙腈(80∶20);流速1 m L/m in;检测波长:257 nm;柱温:35℃。
3.3 结果
单次给药后大鼠盐酸伊托比利血药浓度曲线见图1,由图可见试制药与参比药的血浓度变化趋势基本一致,两种制剂在个体间、剂型间、周期间符合生物等效的假设,可以确认优化后的处方制成的盐酸伊托比利片与参比药品具有生物等效性。
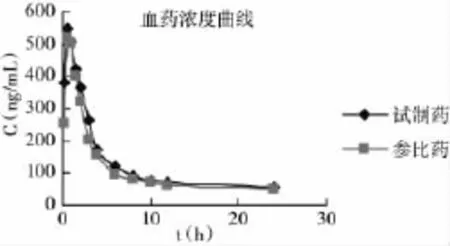
图1 单次给药后大鼠盐酸伊托比利血药浓度曲线
4 结论
本实验根据《化学药物制剂研究技术指导原则》的要求,按照主药、辅料1∶5的比例混合进行原辅料相容性考察,在高温、高湿、光照三种条件下利用高效液相色谱法测定混合后主药的有关物质,结果原辅料之间无相互作用。采用羟丙甲纤维素的水溶液作黏合剂,用量少,黏合力强,对片剂崩解影响小。试制药品在大鼠体内测得的主要药代动力学参数与参比药品基本一致,有待进行人体药代动力学试验。
[1]国家药典委员会.中华人民共和国药典(2010年版)二部[S].北京:中国医药科技出版社,2010.
[2]卫生部药典委员会.国家药品标准工作手册[S].1992.
[3]彭朝霞,朱宏吉,李耀湘,等.咪唑斯汀缓释片的处方工艺筛选[J].中国医院药学杂志,2007,27(6):732-735.
Study on Formulation Screening of Itopride Hydrochloride Tablets and the Bioequivalence
Objective:To choose and decide the optimum formulation of itopride hydrochloride tablets and determine the bioequivalence.Methods:According to the basic property of tablets the appropriate formulation of itopride hydrochloride tablets was selected and the formula was optimized through the study on the dissolution tested in vitro.Bioequivalence was determ ined by comparison of the curves of pharmacokinetics in rat of the trial drug and the reference.Results:The preparation formula of 1 000 itopride hydrochloride tablets was decided which was 50 g of itopride hydrochloride,24 g of m icrocrystalline cellulose,40 g of lactose,7 g of carboxymethyl starch sodium,1%hydroxypropyl methylcellulose qs and 0.6 g of magnesium stearate.The trial drug had almost the same change trend of blood concentration with that of the reference,and bioequivalencewasobtained against the reference.Conclusion:The productwasmade according to the above formulation,itwasshowed that the formulation is reasonable,themethod is simple and applicable to production.
Itopride Hydrochloride;Dissolution Tested in vitro;Formulation Screening;Bioequivalence
10.3969/j.issn.1672-5433.2014.08.006
2014-06-21)
崔瑾瑾,女,硕士。研究方向:院内制剂研发与申报。E-mail:cuijinjin_8023@126.com
Cui Jinjin(Hospital of Traditional ChineseMedicine in Xiangyang City A ffiliated to Hubei University of Chinese Medicine, Hubei Xiangyang 441000,China)

