高龄男性慢性肾脏病患者冠状动脉钙化及影响因素分析
敖强国,马 强,程庆砾
(解放军总医院南楼临床部肾脏病科,北京 100853)
心血管疾病(cardiovascular disease,CVD)是慢性肾脏病(chronic kidney disease,CKD)最主要的并发症,也是导致CKD患者死亡的首要原因。CKD患者CVD患病率显著高于普通人群,钙磷代谢紊乱、血管钙化是CKD患者发生CVD的重要的非传统危险因素。多层螺旋计算机断层扫描(multi-slice spiral computed tomography,MSCT)可以定量检测冠状动脉钙化,通过钙化程度预测心血管事件的发生[1]。本研究应用MSCT检查,探讨高龄CKD患者冠状动脉钙化程度及其影响因素。
1 对象与方法
1.1 研究对象
选取2011年1月至2012年12月于解放军总医院住院治疗的高龄(≥80岁)男性非透析CKD3~5期患者共126例。所有患者符合CKD及透析的临床实践指南[即肾脏病预后质量倡议(Kidney Disease Outcomes Quality Initiative,K-DOQI)]CKD诊断标准[2];采用肾脏病膳食改良研究(Modification of Diet in Renal Disease Study,MDRD)公式计算肾小球滤过率(glomerular filtration rate,GFR)。根据GFR不同分为3组:A组[30≤GFR<60ml/(min·1.73m2)]共45例,年龄(86.34±4.95)岁,GFR(48.41±8.72)ml/(min·1.73m2);B组[15≤GFR<30ml/(min·1.73m2)]共46例,年龄(87.00±5.71)岁,GFR(22.84±4.74)ml/(min·1.73m2);C组[GFR<15 ml/(min·1.73m2)]共35例,年龄(88.12±6.32)岁,GFR(11.65±2.24)ml/(min·1.73m2)。排除标准:严重内分泌紊乱,原发性甲状旁腺亢进症,精神疾患,自身免疫性疾病,严重感染,近1个月内使用激素或免疫抑制剂,近1个月内发生急性心血管事件,恶性肿瘤,严重营养不良等。
1.2 方法
所有患者完成一般情况采集,包括年龄、体质量指数(body mass index,BMI)、平均动脉压(mean arterial pressure,MAP)=舒张压+1/3(收缩压-舒张压)、吸烟史(每天吸>10支并持续≥5年)以及并发症史等。同时完善血生化检验和MSCT检查。MSCT扫描由影像专科医师完成,使用PHILIPS Brilliance 64排螺旋CT机,采用心电门控,于一次屏气中完成。通过Agatston积分法计算冠状动脉钙化积分(coronary artery calcification score,CACS)。
1.3 统计学处理
2 结 果
2.1 各组患者基线资料比较
C组心肌梗死病史、脑梗死病史显著高于A、B两组,差异有统计学意义(P<0.05);其余临床资料3组间比较,差异均无统计学意义(P>0.05;表1)。
2.2 各组患者生化及CACS指标比较
本研究通过GFR进行分组,从A组到C组血清肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN)均呈逐级上升趋势,各组间SCr、BUN和GFR差异均有统计学意义(P<0.01)。与A、B组比较,C组血清磷(phosphorus,P)和钙磷乘积(calcium- phosphorus product,Ca×P)均明显升高,差异有统计学意义(P<0.05)。患者均存在冠状动脉钙化,CACS值随GFR降低逐级升高,3组间比较差异均有统计学意义(P<0.01)。总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、低密度脂蛋白胆固醇(high-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和血清校正钙离子(calcium,Ca)3组间比较则无显著差异(P>0.05;表2)。
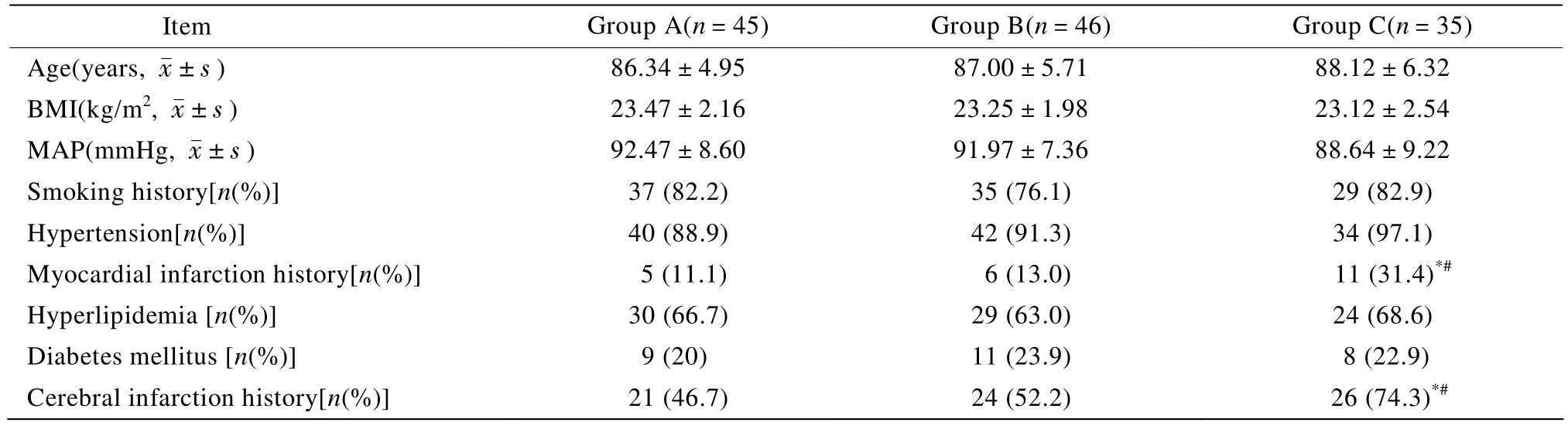
表1 各组间基线资料比较Table 1 Baseline clinical characteristics of all subjects
表2 各组患者生化及CACS指标比较Table 2 Levels of biochemical indices and CACS in each group(±s)
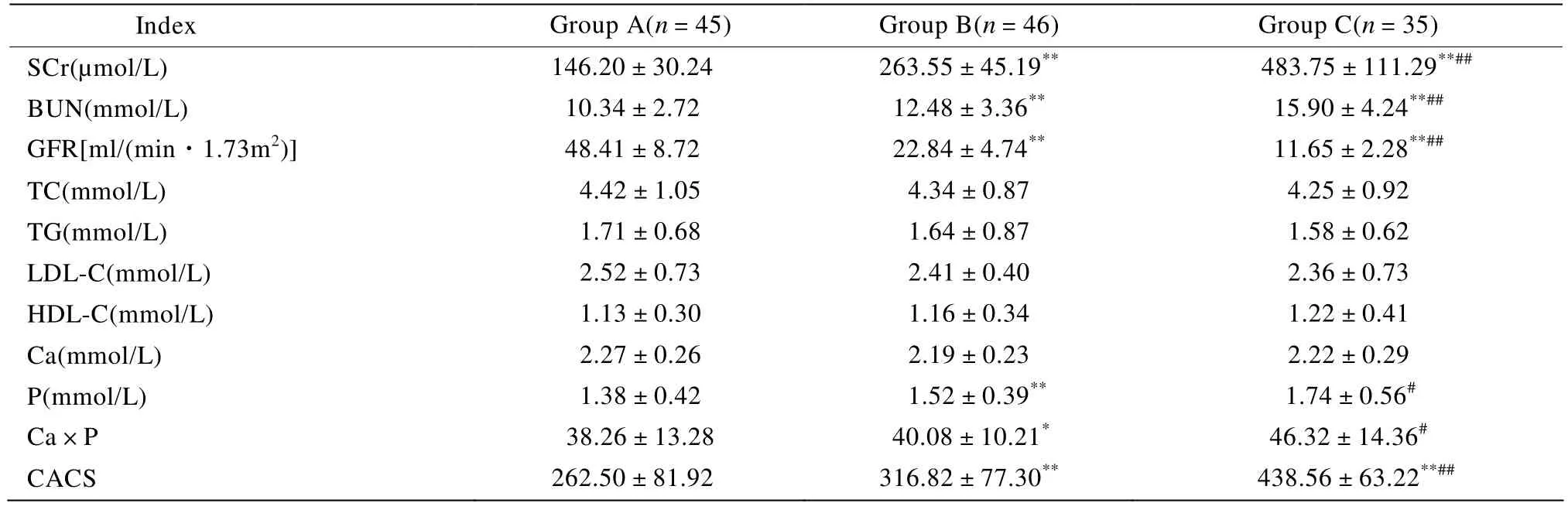
表2 各组患者生化及CACS指标比较Table 2 Levels of biochemical indices and CACS in each group(±s)
SCr:serum creatinine;BUN:blood urea nitrogen;GFR:glomerular filtration rate;TC:total cholesterol;TG:triglycerides;LDL-C:low-density lipoprotein cholesterol;HDL-C:high-density lipoprotein cholesterol;Ca:calcium;P:phosphorus;Ca×P:calcium-phosphorus product;CACS:coronary artery calcification score.Compared with group A,*P<0.05,**P<0.01;compared with group B,#P<0.05,##P<0.01
Index Group A(n=45)Group B(n=46)Group C(n=35)SCr(µmol/L)146.20±30.24 263.55±45.19** 483.75±111.29**##BUN(mmol/L)10.34±2.72 12.48±3.36** 15.90±4.24**##GFR[ml/(min·1.73m2)]48.41±8.72 22.84±4.74** 11.65±2.28**##TC(mmol/L)4.42±1.05 4.34±0.87 4.25±0.92 TG(mmol/L)1.71±0.68 1.64±0.87 1.58±0.62 LDL-C(mmol/L)2.52±0.73 2.41±0.40 2.36±0.73 HDL-C(mmol/L)1.13±0.30 1.16±0.34 1.22±0.41 Ca(mmol/L)2.27±0.26 2.19±0.23 2.22±0.29 P(mmol/L)1.38±0.42 1.52±0.39** 1.74±0.56#Ca×P 38.26±13.28 40.08±10.21* 46.32±14.36#CACS 262.50±81.92 316.82±77.30** 438.56±63.22**##
2.3 与CACS水平升高的相关因素分析
CACS各组间比较差异均有统计学意义(P<0.01)。Spearman相关分析显示,GFR、BUN、SCr与CACS水平密切相关(P<0.01);年龄、BMI、心肌梗死病史、脑梗死病史、血磷和钙磷乘积与CACS水平相关(P<0.05;表3)。
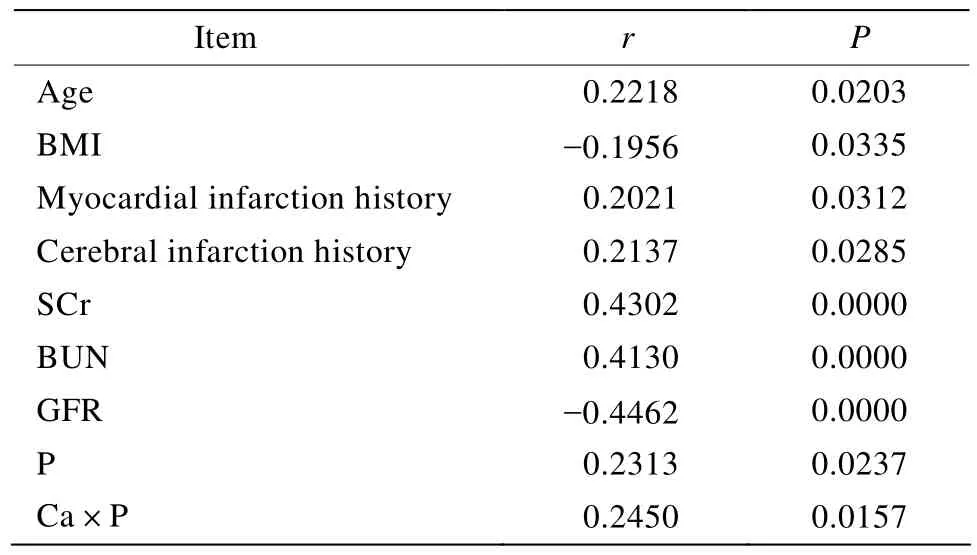
表3 CACS水平升高的相关因素分析Table 3 Spearman correlation analysis for CACS
3 讨 论
CKD患病率在全球范围内呈持续增长趋势,己成为严重危害公众健康的重要问题。CKD患者在进展成为终末期肾病阶段前,多数死于相关的严重并发症。CVD正是导致CKD患者死亡的首位原因,CKD患者并发CVD死亡率约占总死亡率的44%~51%,而冠状动脉粥样硬化性心脏病又是最主要的CVD之一。大型流行病学研究已证实,CKD患者是发生心血管事件的极高危人群,随着CKD的进展,与CVD和心血管事件有关的肾特异性危险因子开始发挥作用[3]。传统观点认为,CKD患者发生CVD的危险因素包括性别、年龄、家族史、吸烟、肥胖、高血脂等;但这些并不能完全解释CKD患者心血管疾病高发的原因,目前更多研究指出CKD患者发生CVD与继发性甲状旁腺功能亢进症、血管钙化、蛋白尿、营养不良、氧化应激等有密切关系[4,5]。
血管钙化指磷酸钙矿物质在血管壁中沉积,常见于动脉粥样斑块钙化和动脉平滑肌层钙化。冠状动脉钙化是冠状动脉粥样硬化相关性疾病,钙化与粥样斑块密切相关,钙化的斑块约占总斑块的20%,CACS与斑块面积的总量成线性相关。冠状动脉钙化可见于粥样斑块发展的任何阶段,并与年龄密切相关,青中年人群冠状动脉钙化对冠心病预测的敏感性为50%,特异性高达100%,说明冠状动脉一旦钙化,即可能存在冠状动脉狭窄。研究表明,在老年人群中,CACS也是CVD强烈的独立预测因子[6]。CACS对CVD的预警作用在CKD患者中同样适用,Shantouf等[7]研究证实血管钙化是血液透析患者发生心血管风险的独立危险因素。在临床应用上,钙化积分的进展常常预示了疾病的进展程度,合理利用CACS对临床诊疗具有非常重要的意义。
本研究通过64排螺旋CT对126例高龄男性非透析CKD3~5期患者冠状动脉钙化进行检测。结果显示,CACS与肾功能水平、年龄、BMI、心肌梗死病史、脑梗死病史、血清磷和钙磷乘积均相关,与血清钙离子水平无相关性。然而,Graland等[8]研究提出,传统的心血管危险因素及血钙水平是CKD患者冠状动脉钙化的独立危险因素,与GFR无相关性。考虑研究结论不一致的原因与研究对象有关,该研究主要入组的是无明确CVD诊断的CKD患者。CKD患者多存在矿物质和骨代谢异常,表现为钙、磷、甲状旁腺素、维生素D代谢异常。通过补充钙剂,可迅速纠正低钙血症;然而,传统的高磷血症治疗,如限磷饮食、透析治疗,往往不能较好改善高血磷状态。高血磷成为引起钙磷乘积升高的主要原因,是增加CKD患者发病率、死亡率和住院率的独立危险因素。Hruska等[9]研究证实血磷在血管钙化中起关键作用,不仅介导异位钙盐沉积,而且是刺激CKD血管钙化的信号分子。动物实验也证实,高磷血症可促进血管内膜表达具有锌指结构的成骨细胞特异性转录因子骨桥接素(osterix),生成骨形成蛋白2等,形成类成骨细胞,引起血管壁钙化[10]。并且,随着GFR不断下降,肾脏对磷的清除功能不断受损,使得中晚期的CKD患者容易并发高磷血症。在儿童透析病例中的研究也发现高磷与血管壁增厚、动脉弹性减弱、冠状动脉钙化有关。高血磷可能导致了过早老化。平稳控制血磷已经成为CKD矿物质和骨代谢异常治疗重点[11]。
综上所述,冠状动脉钙化在高龄非透析CKD患者中发生率高,年龄、BMI、肾功能和钙磷代谢紊乱均与冠状动脉钙化相关。但是,GFR与冠状动脉钙化的相关性仍有争议,还需大样本前瞻性研究进一步探讨血管钙化与CKD的关系。
【参考文献】
[1]Bellasi A,Lacey C,Taylor AJ,et al.Comparison of prognostic usefulness of coronary artery calcium in menversuswomen(results from a meta- and pooled analysis estimating all-cause mortality and coronary heart disease death or myocardial infarction)[J].Am J Cardiol,2007,100(3):409-414.
[2]National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification[J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-S266.
[3]Gansevoort RT,Correa-Rotter R,Hemmelgarn BR,et al.Chronic kidney disease and cardiovascular risk:epidemiology,mechanisms,and prevention[J].Lancet,2013,382(9889):339-352.
[4]Zoungas S,Lui M,Kerr PG,et al.Advanced chronic kidney disease,cardiovascular events and the effect of diabetes:data from the Atherosclerosis and Folic Acid Supplementation Trial[J].Intern Med J,2011,41(12):825-832.
[5]Schiffrin EL,Lipman ML,Mann JF.Chronic kidney disease:effects on the cardiovascular system[J].Circulation,2007,116(1):85-97.
[6]Sekikawa A,Curb JD,Edmundowicz D,et al.Coronary artery calcification by computed tomography in epidemiologic research and cardiovascular disease prevention[J].J Epidemiol,2012,22(3):188-198.
[7]Shantouf RS,Budoff MJ,Ahmadi N,et al.Total and individual coronary artery calcium scores as independent predictors of mortality in hemodialysis patients[J].Am J Nephrol,2010,31(5):419-425.
[8]Graland JS,Holden RM,Groome PA,et al.Prevalence and associations of coronary artery calcification in patients with stages 3 to 5 CKD without cardiovascular disease[J].Am J Kidney Dis,2008,52(5):849-858.
[9]Hruska KA,Mathew S,Lund R,etal.Hyperphosphatemia of chronic kidney disease[J].Kidney Int,2008,74(2):148-157.
[10]Mathew S,Tustison KS,Sugatani T,et al.The mechanism of phosphorus as a cardiovascular risk factor in CKD[J].J Am Soc Nephrol,2008,19(6):1092-1105.
[11]Shroff R.Phosphate is a vascular toxin[J].Pediatr Nephrol,2013,28(4):583-593.

