慢性阻塞性肺疾病患者血清低氧诱导因子-1α水平与早期肾损伤相关性分析
曹 丽,罗红艳,李 博,郑亚莉
(宁夏人民医院肾脏内科,银川 750001)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是中老年人群的常见病、多发病,是以气道、肺实质、肺血管的慢性炎症和呼气功能持续进展性受限为特征的慢性缺氧性呼吸系统疾病。低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是机体在低氧条件下诱导产生的一种细胞氧自稳态保护性调节因子。许多研究证实,HIF-1α在保护机体适应缺氧的同时,也可以诱导其下游的许多细胞因子高表达,引起肾损伤[1,2]。结缔组织转化生长因子-β(transforming growth factor-β,TGF-β)就是近几年研究较多和肾纤维化高度相关的此类因子之一[3-5]。但这些研究多是建立在缺氧动物组织模型上的,用于人体研究通过肾穿刺活检获取组织标本缺少临床适应证,且存在一定风险,是不现实的。能否在血清中找到反映慢性缺氧患者早期肾损伤的生物标志物具有重要的临床意义。本研究选取COPD稳定期患者为研究对象,以健康体检者作对照,通过检测血清HIF-1α水平及其他肾损伤因子,旨在探讨血清HIF-1α与早期肾损伤的相关性及其临床意义。
1 对象与方法
1.1 研究对象
收集2012年1月至7月新入住宁夏人民医院呼吸内科首次确诊为COPD稳定期的患者58例作为COPD组,其中男33例,女25例,年龄62~75(68.0±3.5)岁;选择同期该院体检中心的健康体检者50例作为对照组,其中男32例,女18例,年龄50~70(65.0±5.8)岁。两组年龄、性别差异无统计学意义(P>0.05)。
1.2 纳入及排除标准
COPD的诊断符合2011年中华医学会呼吸病学分会慢性阻塞性肺疾病学组制订的《慢性阻塞性肺疾病诊治指南》的诊断标准。所有入组者采血前都未给氧疗或其他特殊药物治疗。排除标准:(1)排除既往患有各种原发和继发性肾病者如慢性肾小球肾炎、糖尿病性肾病、高血压性肾损害、系统性红斑狼疮性肾炎、紫癜性肾炎、骨髓瘤性肾病、乙肝相关性肾炎等;(2)排除各种原因引起的多器官功能衰竭的患者以及年龄>80岁的高龄老年患者;(3)排除系COPD并发症之外各种原发、继发的心脏病患者;(4)排除COPD以外引起急慢性缺氧及存在急性期感染的患者。
1.3 研究方法
依据血气分析氧分压(PaO2)检测结果,将COPD组患者分为Ⅰ、Ⅱ、Ⅲ级3个不同缺氧亚组,其中Ⅰ级(60mmHg<PaO2≤80mmHg;1mmHg=0.133kPa)、Ⅱ级(40mmHg<PaO2≤60mmHg)、Ⅲ级(PaO2≤40mmHg)。收集COPD组及对照组清晨空腹静脉血,及COPD组动脉血血气分析检测结果,采用ELISA方法严格按要求测定血清HIF-1α、胱抑素C(cystatin C,CysC)、TGF-β。试剂盒购自武汉华美CUSABIO生物工程有限公司。采用全自动生化分析仪检测血清肌酐(serum creatinine,SCr)数值。以慢性肾脏病流行病学合作研究(chronic kidney disease epidemiology collaboration,CKD-EPI)公式[6]计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR)[ml/(min·1.73m2)]:女性SCr值≤62µmol/L采用144×(SCr/62)-0.329×(0.993)年龄公式计算,SCr>62µmol/L采用144×(SCr/62)-1.209×(0.993)年龄公式计算;男性SCr≤80µmol/L采用141×(SCr/80)-0.411×(0.993)年龄公式计算,SCr>80µmol/L采用141×(SCr/80)-1.209×(0.993)年龄公式计算。
1.4 统计学处理
采用SPSS19.0软件进行统计学分析。计量数据以均数±标准差表示,两组间均数比较采用独立样本t检验,多组间均数比较应用单因素方差分析,两指标间相关性分析采用Pearson分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组血清HIF-1α,CysC,TGF-β,SCr及eGFR水平比较
与对照组比较,COPD组血清HIF-1α、CysC水平显著升高,差异有统计学意义(P<0.05,P<0.01),而TGF-β,SCr,eGFR变化不明显,差异无统计学意义(P>0.05;表1)。
2.2 COPD各亚组及对照组血清HIF-1α,CysC,TGF-β,SCr及eGFR水平比较
与对照组及Ⅰ级缺氧亚组比较,COPD组患者血清HIF-1α在Ⅱ、Ⅲ级缺氧亚组水平明显升高,与对照组比较CysC在各级缺氧亚组水平均明显升高,eGFR仅在Ⅲ级缺氧亚组水平才明显降低,差异均有统计学意义(P<0.05),而血清SCr及TGF-β在各缺氧亚组中均无明显升高,差异无统计学意义(P>0.05;表2)。
表1 COPD组和对照组血清HIF-1α,CysC,TGF-β,SCr,eGFR比较Table 1 Comparison of the serum HIF-1α,CysC,TGF-β,SCr and eGFR between COPD group and control group(±s )

表1 COPD组和对照组血清HIF-1α,CysC,TGF-β,SCr,eGFR比较Table 1 Comparison of the serum HIF-1α,CysC,TGF-β,SCr and eGFR between COPD group and control group(±s )
COPD:chronic obstructive pulmonary disease;HIF-1α:hypoxia-inducible factor-1α;CysC:cystatin C;TGF-β:transforming growth factor-β;SCr:serum creatinine;eGFR:estimated glomerular filtration rate.Compared with control group,*P<0.05,**P<0.01
Group n HIF-1α(µg/L )CysC(µg/L )TGF-β(µg/L)SCr(µmol/L)eGFR[ml/(min·1.73m2]Control 50 260.15±76.55 108.41±35.35 25.01±11.00 73.23±13.87 90.31±21.45 COPD 58 332.15±92.74** 126.68±34.60* 29.21±4.56 78.26±29.21 87.12±14.91
表2 COPD各缺氧亚组及对照组血清HIF-1α,CysC,TGF-β,SCr,eGFR比较Table 2 Comparison of the serum HIF-1α,CysC,TGF-β,SCr and eGFR between three subgroups and control group(±s )
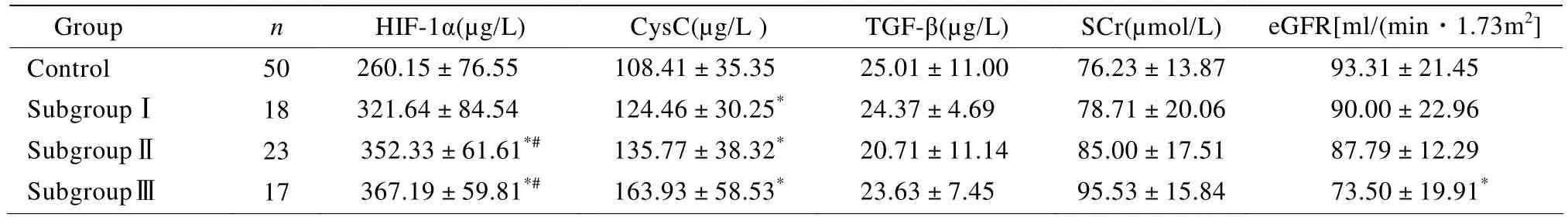
表2 COPD各缺氧亚组及对照组血清HIF-1α,CysC,TGF-β,SCr,eGFR比较Table 2 Comparison of the serum HIF-1α,CysC,TGF-β,SCr and eGFR between three subgroups and control group(±s )
Subgroup Ⅰ:60mmHg<PaO2≤80mmHg;SubgroupⅡ:40mmHg<PaO2≤60mmHg;Subgroup Ⅲ:PaO2≤40mmHg;COPD:chronic obstructive pulmonary disease;HIF-1α:hypoxia-inducible factor-1α;CysC:cystatin C;TGF-β:transforming growth factor-β;SCr:serum creatinine;eGFR:estimated glomerular filtration rate.1mmHg=0.133kPa.Compared with control group,*P<0.05;compared with control subgroup Ⅰ,#P<0.05
Group n HIF-1α(µg/L)CysC(µg/L )TGF-β(µg/L)SCr(µmol/L)eGFR[ml/(min·1.73m2]Control 50 260.15±76.55 108.41±35.35 25.01±11.00 76.23±13.87 93.31±21.45 SubgroupⅠ 18 321.64±84.54 124.46±30.25* 24.37±4.69 78.71±20.06 90.00±22.96 SubgroupⅡ 23 352.33±61.61*# 135.77±38.32* 20.71±11.14 85.00±17.51 87.79±12.29 SubgroupⅢ 17 367.19±59.81*# 163.93±58.53* 23.63±7.45 95.53±15.84 73.50±19.91*
2.3 COPD组HIF-1α与CysC的相关性及HIF-1α,CysC,TGF-β与eGFR的相关性
血清HIF-1α与CysC呈正相关(r=0.665,P=0.001);血清HIF-1α,CysC与eGFR呈负相关(r=-0.739,r=-0.827,P<0.001);血清TGF-β与eGFR无明显相关(P>0.05;表3,图1,图2,图3)。
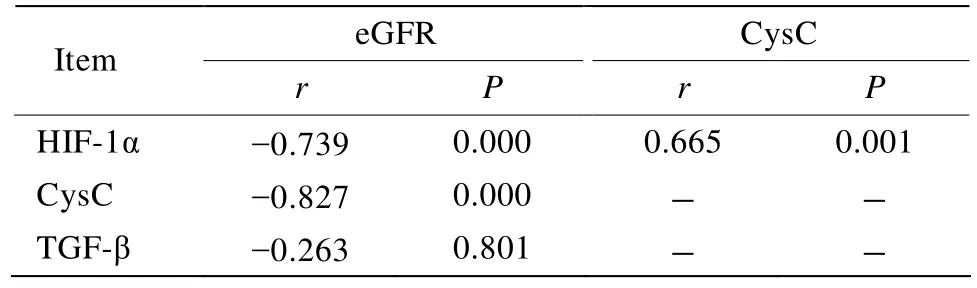
表3 COPD组HIF-1α与CysC相关性及HIF-1α,CysC,TGF-β与eGFR的相关性Table 3 The correlation of HIF-1α with CysC,and of HIF-1α,CysC and TGF-β with eGFR in COPD group
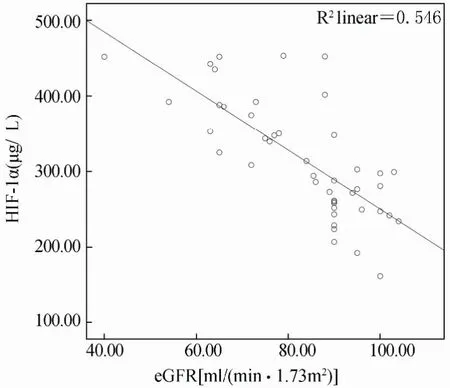
图1 HIF-1α与eGFR相关性散点图Figure 1 The correlation between HIF-1α and eGFR
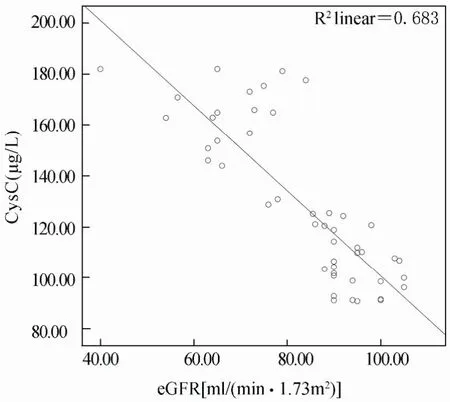
图2 CysC与eGFR相关性散点图Figure 2 The correlation between CysC and eGFR
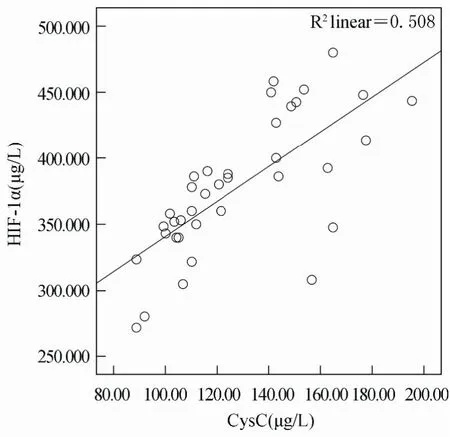
图3 HIF-1α与CysC相关性散点图Figure 3 The correlation between HIF-1α and CysC
3 讨 论
慢性缺氧所致的肾脏损害和慢性肾脏病在我国患病人数正逐年升高[7]。由于其起病隐匿,不能被及时发现而易造成误诊、漏诊,一旦进入终末期肾病往往预后较差,给家庭、社会造成沉重的负担。故探讨及评估慢性缺氧引起的早期肾损伤意义重大。HIF-1α是机体在低氧状态下做出适应性反应的独特的细胞氧自稳态调节因子。尽管许多文献报道HIF-1α具有促进肾损伤修复的保护作用[8-11],但也有研究证实,慢性缺氧会损伤肾小管上皮细胞的吸收和排泌功能,促进细胞因子和炎性介质的释放,诱导肾小球内皮细胞凋亡[1,2]。许多研究也证实,HIF-1α尚可以诱导TGF-β等细胞因子的高表达,肾小管上皮细胞的转分化,启动间充质成纤维细胞,导致肾组织纤维化,肾功能损伤进行性加重[3-5]。但在临床诊疗实践中通过肾穿刺活检获取组织标本往往是不现实的,而获取血清则有方便易得、易于操作等优势。慢性缺氧患者HIF-1α在血清中的表达水平及其和早期肾损伤的相关性尚未见报道。临床常用的SCr及eGFR等指标虽能对肾功能变化做出较为准确的监测,但常常因其较为滞后且受影响的因素较多而受限。近些年,血清CysC对高血压、糖尿病早期肾损伤的评估作用已受到广大学者的认可[12,13],但CysC对慢性缺氧早期肾损伤的评估作用有待于进一步观察。本研究在检测血清HIF-1α表达水平的同时也检测了CysC,eGFR及SCr等指标的水平。结果发现,COPD组血清HIF-1α和CysC较对照组明显升高,差异有统计学意义(P<0.05),且二者呈正相关,而eGFR及SCr等指标升高不明显,差异无统计学意义(P>0.05)。表明HIF-1α和CysC评估慢性缺氧性肾损伤较eGFR和SCr早且敏感。进一步对各缺氧亚组比较发现,血清HIF-1α在缺氧较重的Ⅱ、Ⅲ级亚组明显升高,CysC在各级缺氧亚组均升高,而eGFR在缺氧最重的Ⅲ级亚组才明显降低,差异均有统计学意义(P<0.05)。HIF-1α,CysC和eGFR呈负相关,说明肾损伤和缺氧的程度相关,血清HIF-1α虽可能对缺氧性肾损伤的敏感性不及CysC但较eGFR和SCr高,即缺氧越重,肾损伤越重,和组织观察结果一致。尽管TGF-β被认为是慢性缺氧重要的致肾纤维化因子[3-5],但在本研究观察结果和相关性分析中均未发现有统计学意义。表明TGF-β在血清中的表达并不敏感,不是反映早期肾损伤的生物标志物。也可能和样本量较小,存在一定的检验误差有关,有待在今后的观察中进一步扩大样本量。
综上所述,血清HIF-1α可能也是评估慢性缺氧患者早期肾损伤较好的生物标志物之一,其与CysC联合检测可能具有更好的临床实用价值。
【参考文献】
[1]Yuan MX,Tang R,Zhou QL,et al.Effect ofCordyceps sinensison expressions of HIF-1α and VEGF in the kidney of rats with diabetic nephropathy[J].J Cent South Univ(Med Sci),2013,38(5):448-457.[袁明霞,唐 荣,周巧玲,等.冬虫夏草对糖尿病大鼠肾组织HIF-1α及VEGF表达的影响[J].中南大学学报(医学版),2013,38(5):448-457.]
[2]Tanaka T,Nangaku M.The role of hypoxia,increased oxygen consumption,and hypoxia-inducible factor-1 alpha in progression of chronic kidney disease[J].Curr Opin Nephrol Hypertens,2010,19(1):43-50.
[3]Sekiguchi Y,Zhang J,Patterson S,et al.Rapamycin inhibits transforming growth factor β-induced peritoneal angiogenesis by blocking the secondary hypoxic response[J].J Cell Mol Med,2012,16(8):1934-1945.
[4]Basu RK,Hubchak S,Hayashida T,et al.Interdependence of HIF-1α and TGF-β/Smad3 signaling in normoxic and hypoxic renal epithelial cell collagen expression[J].Am J Physiol Renal Physiol,2011,300(4):F898-F905.
[5]Li N,Sun JP,Gao YX,et al.The expression and significance hypoxia inducible factor-1α in renal interstitial fibrosis[J].Chin J Integr Tradit Western Nephrol,2012,13(1):18-21.[李 娜,孙建平,高延霞,等.缺氧诱导因子-1α在肾间质纤维化中的表达及意义[J].中国中西医结合肾病杂志,2012,13(1):18-21.]
[6]Wang HB,Xia XK,Wu JH.Assessment of CKD-EPI equation estimating glomerular filtration rate[J].J Int Lab Med,2011,32(9):936-941.[王宏斌,夏先考,吴建华.CKD-EPI方程估算肾小球滤过率的评价[J].国际检验医学杂志,2011,32(8):936-941.]
[7]Zhang L,Wang F,Wang L,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[8]Schley G,Klanke B,Schödel J,et al.Hypoxia-inducible transcription factors stabilization in the thick ascending limb protects against ischemic acute kidney injury[J].J Am Soc Nephrol,2011,22(11):2004-2015.
[9]Yu HL,Zhou QL,Huang RF,et al.Effect ofCordyceps sinensison the expression of HIF-1α and NGAL in rats with renal ischemia reperfusion injury[J].J Cent South Univ(Med Sci),2012,37(1):57-66.[余洪磊,周巧玲,黄仁发,等.冬虫夏草对大鼠肾缺血再灌注模型肾组织HIF-1α及NGAL表达的影响[J].中南大学学报(医学版),2012,37(1):57-66.]
[10]Bi LY,Guo JG,Zhang RX,et al.Bone marrow stem cell mobilization with stem cell factor and granulocyte colony-stimulating factor for treatment of renal ischemia-reperfusion injury[J].Chin J Tissue Eng Res,2012,16(41):7681-7687.[毕凌云,郭金岗,张瑞霞,等.干细胞因子和粒细胞集落刺激因子动员自身骨髓干细胞治疗缺血再灌注肾损伤[J].中国组织工程研究,2012,16(41):7681-7687.]
[11]Guo JG,Yang M,Yang DS,et al.Effect of mobilization bone marrow stem cells on hypoxia inducible factor-1α and epidermal growth factor in rats with renal injury induced by ischemic reperfusion[J].J Appl Clin Pediatr,2013,28(17):1338-1342.[郭金岗,杨 媚,杨达胜,等.动员骨髓干细胞对大鼠缺血再灌注肾损伤缺氧诱导因子-1α和表皮生长因子表达的影响[J].中华实用儿科临床杂志,2013,28(17):1338-1342.]
[12]Cai JL,Hong GQ,Chen JP.The study of inspection index screening in early renal damage for diabetes[J].J Clin Exp Med,2013,12(13):1017-1018.[蔡锦亮,洪桂清,陈静萍.CysC、Hcy、HbAlc、hs-CRP在糖尿病早期肾损伤中的应用研究[J].临床和实验医学杂志,2013,12(13):1017-1018.]
[13]Duan SB,Liu GL,Yu ZQ,et al.Urinary KIM-1,IL-18 and Cys-c as early predictive biomarkers in gadolinium-based contrast-induced nephropathy in the elderly patients[J].Clin Nephrol,2013,80(5):349-354.

