淫羊藿苷对酒精致雄性小鼠生殖损伤的影响*
刘忠平李质馨**田洪艳潘晓燕孙艳美
1. 吉林医药学院组织胚胎学教研室(吉林 132013); 2. 吉林医药学院病原实验室
·论 著·
淫羊藿苷对酒精致雄性小鼠生殖损伤的影响*
刘忠平1李质馨1**田洪艳1潘晓燕1孙艳美2
1. 吉林医药学院组织胚胎学教研室(吉林 132013); 2. 吉林医药学院病原实验室
目的探讨淫羊藿苷对酒精致雄性小鼠生殖损伤的保护作用,为临床治疗酒精致男性不育提供理论依据。方法成年雄性小鼠随机分为正常组(蒸馏水)、模型组(酒精组)和给药组(酒精+淫羊藿苷组),灌胃5周后处死并制备附睾精子悬液,分别测定精子密度、精子活动率、存活率、精子畸形率;JC-1染色法检测线粒体膜电位改变;制备睾丸组织切片,观察睾丸组织病理改变。结果模型组小鼠精子密度、精子活动率和存活率明显低于正常组,精子畸形率明显增加;给药组精子密度、精子活动率和存活率较模型组明显升高,精子畸形率明显降低。线粒体膜电位分析,模型组去极化细胞(凋亡细胞)比例明显高于正常组;给药组去极化细胞(凋亡细胞)比例低于模型组。睾丸组织切片观察发现,与正常组比较,模型组生精细胞层数减少,结构紊乱稀疏;给药组生精小管结构明显改善。结论 淫羊藿苷对酒精致雄性小鼠生殖损伤有一定保护作用。
淫羊藿甙; 饮酒; 精子能动性; 细胞凋亡
酗酒已成为当今世界日益严重的公共卫生问题,极大地影响了我国的人口素质,过度饮酒也是导致受孕机会下降和出生缺陷发生的主要原因之一。酒精作为一种睾丸毒物对男性生育能力的影响不容忽视,酒精对男性生殖系统的损害也已被大量的实验研究所证实。酗酒可使血清睾酮水平下降,性功能减退并导致后代发育和行为异常[1],酒精可以通过减少睾丸内细胞增殖、加快细胞凋亡来抑制生殖能力[2]。淫羊藿属于小蘖科淫羊藿属植物,其性味辛、甘、温,李时珍在《本草纲目》中称其有“益精气,坚筋骨,补腰膝,强心力”之功效,是中药中常见的助阳药,广泛用于不孕、不育、性功能障碍等疾病的治疗。淫羊藿苷是淫羊藿的主要有效成分,研究发现淫羊藿苷可以提高D-半乳糖所致衰老小鼠血清睾酮水平[3],减少亚急性衰老雄性大鼠生殖细胞凋亡,改善睾丸组织的退行性变化,延缓性腺衰老[4],淫羊藿苷对肾阳虚小鼠血清睾酮含量下降、性腺雄激素受体mRNA和蛋白质的表达下降也有一定的抑制作用[5],有助于增强性功能。精液质量状况是反映男性生育力的客观的实验室检测指标。精液分析也是评价男性生育力的重要依据[6]。线粒体膜电位变化为凋亡的特异性改变。本实验在建立酒精损伤小鼠模型的基础上,观察淫羊藿苷对小鼠精液质量、线粒体膜电位变化及睾丸组织改变的影响,探讨淫羊藿苷对酒精致小鼠生殖功能损伤的保护作用,旨在为淫羊藿苷治疗男性不育提供理论依据。
材料与方法
一、实验动物及分组
实验选用健康成年雄性昆明种小鼠30只,体质量(25±2)g(吉林大学白求恩医学部基础医学院实验动物中心提供),随机分为正常组(蒸馏水)、模型组(酒精组)和给药组(酒精+淫羊藿苷组),每组10只。小鼠饲养环境温度18~22℃,湿度50%~60%,自然光照。适应性饲养1周后开始实验。
二、主要仪器与试剂
三用恒温水箱,上海精宏实验设备有限公司;血细胞计数板,上海求精生化试剂仪器有限公司;淫羊藿苷(规格:98%,HPLC),黄色粉末,陕西森弗高科实业有限公司,用双蒸水配成36mg/mL的混悬液,置4℃冰箱保存备用;白酒(56%),北京红星股份有限公司;多聚甲醛,国药集团化学试剂有限公司;Nucleo Counter NC-3000TM线粒体膜电位检测仪,丹麦。
三、实验方法
(一)建立动物模型
模型组每天上午10点按10ml/kg灌胃28%的酒精(白酒与蒸馏水以1:1比例稀释);给药组每天上午10点按10ml/kg灌胃28%的酒精,下午2点按90mg/k灌胃淫羊藿苷;正常组给予等量蒸馏水灌胃;连续灌胃5周。
(二)精子密度的测定
颈椎脱臼处死小鼠,打开腹腔,快速剥离双侧附睾,置于盛有2mL生理盐水(37℃预温)的平皿中,用眼科剪刀剪数剪,再将平皿37℃孵育10min,待精子自由游出,即制成精子悬液。精子密度采用血细胞计数板测定法计数。
(三)精子活动率与精子存活率的计算
取上述精子悬液10μL置于玻片上,盖上盖玻片后镜下观察计数至少200个精子,计算精子活动率。用1%刚果红染色法检测精子存活率,死精子着红色,活精子不着色,用活精子数与总精子数的比值表示精子存活率。
(四)精子畸形率的计算
取精子悬液用4层擦镜纸过滤,涂片,干燥,甲醇固定,干燥,2%伊红溶液染色1h,用水轻冲,干燥。在高倍镜下找到背景清晰、精子重叠较少的部位计数1000个完整精子,计算总精子畸形率。
(五)细胞线粒体膜电位检测
处死小鼠取下附睾后,每组取5只小鼠的睾丸,剪开白膜,用注射器芯剥出生精小管置于100目细胞筛上,轻轻研磨,过滤,离心,弃上清,收集细胞,加PBS,制备细胞混悬液,采用Nucleo Counter NC 3000TM对细胞线粒体膜电位进行检测。
(六)睾丸组织切片标本制备
每组余下5只小鼠的睾丸放入4%多聚甲醛中固定,石蜡包埋,常规 5μm切片, 经脱蜡、脱水处理后, 苏木精-伊红染色, 脱水,透明,常规封片,镜下观察。
四、统计学分析
所有实验数据采用SPSS 13.0 软件进行统计分析,数据以±s表示,P<0.05为差异具有统计学意义。
结 果
一、淫羊藿苷对酒精损伤小鼠精液质量的影响
模型组小鼠精子密度、精子活动率、存活率较正常组明显降低,差异有统计学意义(P<0.01),给药组小鼠精子密度、精子活动率、存活率较模型组得到明显提高,差异有统计学意义(P<0.01)。见表1。结果提示淫羊藿苷可以拮抗酒精对小鼠精子密度、精子活动率、存活率的影响。
表1 淫羊藿苷对酒精损伤小鼠精液质量的影响(n=10,±s)

表1 淫羊藿苷对酒精损伤小鼠精液质量的影响(n=10,±s)
注:*与正常组相比较, P<0.01;△与模型组相比较, P<0.01
组别 精子密度(×106个/mL) 活动率(%) 存活率(%)正常组 31.52±1.76 82.16±1.35 90.36±1.81模型组 10.87±1.07*63.51±1.62*71.53±1.82*给药组 21.27±1.69△73.63±1.92△82.39±2.21△
二、淫羊藿苷对酒精损伤小鼠精子畸形率的影响
模型组小鼠精子畸形率为(5.97±0.32)%,较正常组(2.95±0.30)%明显提高,差异有统计学意义(P<0.01),给药组小鼠精子畸形率为(4.19±0.28)%,较模型组明显降低,差异有统计学意义(P<0.01)。结果提示淫羊藿苷可以拮抗酒精对小鼠精子形态造成的损伤作用。
三、细胞线粒体膜电位检测
JC-1染色,Nucleo Counter NC-3000TM检测分析,健康细胞呈红色荧光,凋亡细胞呈绿色荧光,利用红色荧光与绿色荧光的强度比判断细胞的线粒体膜电位是否发生去极化和凋亡。模型组去极化细胞(凋亡细胞)比例为(75.80±1.50)%(图1B),明显高于正常组(32.50±1.22)%(图1A);给药组去极化细胞(凋亡细胞)比例为(56.10 1.33)%,低于模型组(图1C),差异均具统计学意义(P<0.01)。
四、小鼠睾丸组织病理形态学的改变
光镜下观察可见,正常组睾丸生精小管结构完整,生精细胞排列紧密有序,层次清楚(图2A)。模型组睾丸生精小管管壁萎缩变薄,生精细胞层数减少、排列紊乱稀疏(图2B)。给药组睾丸生精小管的形态较模型组有所改善,各级生精细胞数量明显增加细胞排列较整齐(图2C)。

图1 Nucleo Counter NC-3000TM对线粒体膜电位的检测
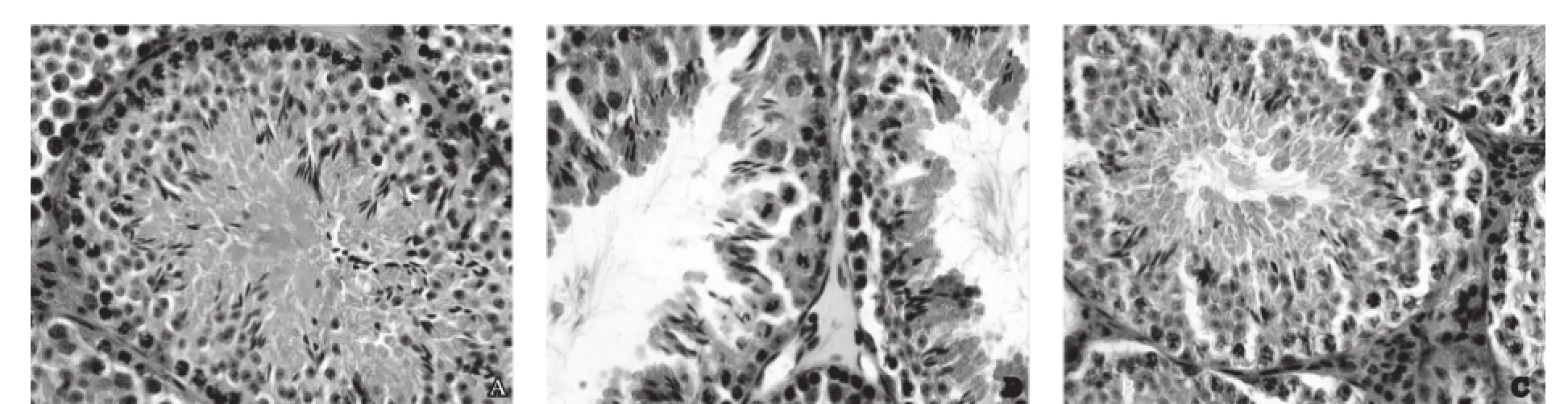
图2 小鼠睾丸组织病理改变(HE,×400)
讨 论
生殖健康是人类社会文明的核心,但在过去几十年里,研究资料显示人类精液质量正逐渐下降[7],而且降低具有低龄化的趋势。人类的生殖功能正在不断衰退。其中酒精对生殖能力的影响毋庸置疑。酒精有明显的生殖毒性,孕期过量饮酒可引起胎儿酒精综合征。酒精可以导致精母细胞退化,精子数量减少[8],初级精母细胞染色体畸变率增高,精液质量下降,睾酮合成受到抑制。酒精可以抑制睾丸内维生素A的活性,造成维生素A和锌的缺乏,从而引起生精上皮细胞发育不良,睾丸萎缩,导致少精子症或无精子症[9]。淫羊藿是传统医学中的补益中药, 具有温阳补肾、强筋健骨等功效。淫羊藿苷是淫羊藿中的主要活性成分,也是研究含有淫羊藿中成药药理作用的首选成分。研究发现淫羊藿苷有明显的性激素样作用,可直接刺激性腺而发挥其“壮阳”作用。淫羊藿苷能作用于睾丸Leydig细胞而提高睾酮的合成[10],促进幼年小鼠附睾及精囊的发育,对离体培养的大鼠睾丸间质细胞睾酮的基础分泌和cAMP 的生成也有促进作用[11]。淫羊藿苷可以直接作用于高级生殖调控中枢,起到补肾助阳的作用。淫羊藿苷有很强的促进生殖的效果,但其对酒精所致生殖系统损伤的影响及机制仍有待研究。精子密度、存活率是反映生育能力的主要参数。精子运动能力是精子结构与功能的综合体现,精子运动能力的改变可作为衡量环境因素对雄性生殖功能影响的一项重要指标[12]。精子形态与精子功能密切相关,任何形态上的缺陷都将导致受精功能下降,影响男性生育力。线粒体是参与细胞凋亡的重要细胞器,在细胞凋亡中,线粒体膜电位将发生变化。本实验从精液质量、精子畸形、细胞线粒体膜电位检测、睾丸组织病理改变几方面观察淫羊藿苷对酒精致小鼠生殖损伤的影响,结果发现给药组小鼠精子密度、精子活动率、存活率均较模型组明显提高,精子畸形率明显降低;去极化细胞(凋亡细胞)比例明显降低;生精小管结构得到明显改善,说明淫羊藿苷对酒精致雄性小鼠生殖损伤有一定的保护作用,但其具体保护机制还有待于进一步研究。
1 Kumar S, Kumari A, Murarka S. Lifestyle factors in deteriorating male reproductive health.Indian J Exp Biol2009; 47(8): 615-624
2 Koh PO, Kim MO. Ethanol exposure decreases cell proliferation and increases apoptosis in rat testes.J Vet Med Sci2006; 68(10): 1013-1017
3 陈凯, 刘浩然, 苏燕慧, 等. 淫羊藿苷对D-半乳糖致衰老模型小鼠睾丸病变的影响. 中国老年学杂志 2011 31(10): 1816-1818
4 章振保, 田生平, 杨镜秋, 等. 淫羊藿苷与睾酮治疗亚急性衰老雄性大鼠的实验研究. 中国男科学杂志 2006; 20(8): 13-18
5 包宇, 杨建雄, 孙润广. 淫羊藿苷可缓解肾阳虚小鼠睾酮及性腺雄激素受体基因的表达下调. 中国生物化学与分子生物学报 2011; 27(2): 174-179
6 王奇玲, 唐立新, 唐运革, 等. 生育力男性精液检测与计算机辅助分析参数的主成分分析. 中国男科学杂志2010; 24(11): 30-36
7 Olsen J, Zhu JL, Ramlau-Hansen CH.Has fertility declined in recent decades?.Acta Obstet Gynecol Scand2011; 90(2): 129-135
8 Wallock-Montelius LM, Villanueva JA, Chapin RE,et al. Chronic ethanol perturbs testicular folate metabolism and dietary folate def ciency reduces sex hormone level in the Yucatan micropig.Biol Reprod2007; 76(3): 455-465
9 Muthusami KR.Effect of chronic alcoholism on male fertility hormones and semen quality.Fertil Steril2005; 84(4): 919-924
10 Zhang ZB, Yang QT. The testosterone mimetic properties of icariin.Asian J Androl2006; 8(5): 601-605
11 高学勇, 王玮. 淫羊藿苷对环磷酰胺诱导生精障碍大鼠睾丸的影响. 中外医疗 2009; 28(17): 19, 21
12 Herath CB, Jin W, Watanabe G,et al.Adverse effects of environmental toxicants, octylphenol and bisphenol A, on male reproductive functions in pubertal rats.Endocrine2004; 25(2): 163-172
(2014-06-26收稿)
Effects of icariin on reproductive damage in alcohol-treated male mice*
Liu Zhongping1, Li Zhixin1**, Tian Hongyan1, Pan Xiaoyan1, Sun Yanmei2
1.Deparment of Histology and Embryology,Jilin Medical College, Jilin 132013, China;
2. Pathogenic Laboratory,Jilin Medical College
Li Zhixin, E-mail: lzx-62@163.com
ObjectiveTo explore the protective effects of icariin on reproductive damage in alcohol-treated male mice,and provide the theoretical basis for clinical treatment of male infertility induced by alcohol.MethodsAdult male mice were randomly divided into the normal group, the model group and the treated group. Mice in the model group were made by gavage with alcohol. Mice in the treatedgroup were treated by gavage with alcohol and icariin simultaneously. Mice in the normal group were given distilled water. After 5weeks, all the mice were killed and the epididymis were made into sperm suspension. Sperm density,sperm motility,sperm viability and sperm malformation rate were detected respectively. Mitochondrial potential was examined with JC-1. The pathological changes of testes specimens were observed under the microscope.ResultsThe sperm density,sperm motility and sperm viability in the model group was lower than that in the normal group, andthe rate of sperm deformation was signif cantly increased. The sperm density,sperm motility and sperm viability in the treated group was higher than that in the model group, and the rate of sperm deformation was decreased. The rate of depolarization cells(apoptosis cells) in the treated group was lower than that in the model group. The layer number of spermatogenic cells decreased in the model group, and the structure of seminiferous tubules were disorganized.The structure of seminiferous tubules was improved signif cantly in the treated group.ConclusionThe icariin has protective effects on reproductive damage in alcohol-treated male mice .
Icariin; alcohol drinking; sperm motility; apoptosis
10.3969/j.issn.1008-0848.2014.12.001
R 698.2
资助: 吉林省教育厅科学技术研究项目(2013477;2012484); 吉林省科技发展计划项目(20140204033YY);吉林市科技发展计划资助项目(2013625023)
**
, E-mail: lzx-62@163.com

