男性不育患者体重指数、精浆中游离脂肪酸、抑制素B与精液参数关系的研究
白双勇王剑松*赵庆华
1. 昆明医科大学第二附属医院泌尿外科(昆明 650000); 2. 昆明医科大学第二附属医院妇科
男性不育患者体重指数、精浆中游离脂肪酸、抑制素B与精液参数关系的研究
白双勇1王剑松1*赵庆华2
1. 昆明医科大学第二附属医院泌尿外科(昆明 650000); 2. 昆明医科大学第二附属医院妇科
目的为进一步了解肥胖对男性生育力影响,探究不同体重指数(BMI)、精浆中游离脂肪酸(Free fatty acid, FFA)和抑制素B(Inhibin B, INHB)对于精液参数的影响,以及三者之间的相关关系。方法通过整群抽样抽取177个男性不育患者,其中正常体质量组:58人;超质量组:60人;肥胖组:59人。通过检测精液常规,ELISA法检测精浆中FFA、INHB。结果超质量组精液量(2.27±0.98)mL与正常体重组精液量(2.71±0.92)mL相比精液量减少,(P<0.05)。肥胖组精液量(1.96±0.76)mL少于正常体重组精液量,(P<0.05)。肥胖组与超质量组相比较,(P>0.05)。肥胖组总精子数(103.75±78.38)×106低于正常体质量组总精子数(146.39±111.87)× 106,(P<0.05)。肥胖组精液的畸形精子率(80.46±9.92)%高于正常体质量组(76.59±9.92)%,(P<0.05)。正常体质量组精浆中FFA(348.64±119.72)ng/mL,超质量组(535.81±133.90)ng/mL,肥胖组(595.26±146.69)ng/mL,正常体质量组与超质量组比较(P<0.05),正常体质量组与肥胖组比较(P<0.05),超质量组与肥胖组比较差异有显著性(P<0.05)。精浆中FFA与体重指数呈显著正相关(r=0.57,P<0.01)。正常体质量组精浆中INHB(30.61±11.17)ng/L,超质量组(48.09±11.66)ng/L,肥胖组(48.40±13.95)ng/L,正常体质量组与超质量组(P<0.05),正常体质量组与肥胖组比较(P<0.05),超质量组与肥胖组比较(P>0.05)。精浆中INHB与BMI显著正相关(r=0.46,P<0.01)。精浆中FFA与INHB也呈正相关(r=0.47,P<0.01)。结论 在随着BMI增加,精液量减少,精子畸形率增加,精浆中FFA、INHB也增加,为临床分析肥胖影响男性生育的病因,也为临床治疗肥胖男性不育患者提供依据。
体重质量指数; 游离脂肪酸; 抑制素B; 肥胖; 不育, 男性
肥胖人口比率不仅在发达国家趋势持续增长,在世界的其他国家也在增长。因而肥胖男性和女性被诊断为不育不孕的人口数目持续增长,这个问题已引起人们的重视。相较全球肥胖人群的增加而男性生育力逐渐下降[1]。有趣的是在由国家环境健康研究所主导的一项研究表明:随着男性体质量指数的增加导致男性不育的可能性也增加许多研究显示在过去的50年中,随着肥胖率的上升,男性的精子数量降低,生育力逐渐下降。有研究显示体质量指数的增加可能导致精子密度降低,正常形态精子比率下降,精子DNA碎片增加[2]。抑制素B(Inhibin B,INHB)是一种新的性腺激素由生精细胞和支持细胞合成可以作用于垂体抑制FSH对精子的激发作用,是精子生成的敏感指标[3]。肥胖者中血清游离脂肪酸(Free fatty acid,FFA)常常升高,游离脂肪酸可以导致胰岛素抵抗,诱发动脉粥样心血管疾病。游离脂肪酸可以导致线粒体超氧化物生成增多,作用于生殖细胞,影响精子生成[4]。肥胖对于女性生育力影响已经引起大家的重视,而肥胖对于男性精液参数的影响,目前研究尚未引起重视,本研究的目的就是初步探讨肥胖对于男性生育力的影响,主要探讨体重指数与精液参数之间的关系,精浆中游离脂肪酸、抑制素B的检测与体重指数之间关系,为临床诊疗提供一定参考。
材料和方法
一、研究对象
(一)受检对象
本研究在昆明医科大学第二附属医院伦理委员会同意下进行,每个参与的患者都被告知相应的权利。男性不育症标准为:有规律性生活未避孕一年而未使妻子受孕的男性。男性年龄最小不小于23岁,最大不超过50岁。排除标准:与超质量/肥胖无关的疾病或异常病史(包括:精索静脉曲张,隐睾症,肿瘤,男性绝育术,睾丸扭转);有明显的影响生育力的毒物接触如农药厂工人也在排除范围。为进一步研究体质量指数对男性生育力的影响,严重少弱精子症和无精子症也排除。
(二)分组方法
在昆明医科大学第二附属医院生殖中心就诊人群中根据患者体重指数分组整群抽取男性不育患者,符合课题标准的男性不育症患者共177人,其中正常体质量组:58人,超重组:60人;肥胖组:59人。
二、方法
(一)精液分析
所有参与课题男性不育症患者禁欲48~72h后,通过手淫办法获取精液,严格按照世界卫生组织2010年第五版人类精液检验与处理实验室手册要求,由昆明医科大学第二附属医院男科实验室工作人员按操作规程检验。
(二)测定BMI
所有患者着轻便衣服不穿鞋情况下测量,身高:站立位足底到头部最高点垂直距离。体质量:人体的总质量。体质量指数(Body mass index,BMI):体质量(kg)与身高(m)平方的比值。根据中华人民共和国国家卫生和计划生育委员会2013年10月1日实施卫生行业标准,成人体质量判定标准,男性正常体重指数标准:24.00>BMI≥18.5;超质量组:28.00>BMI≥24.0;肥胖组:BMI≥28.0。
(三)检测精浆中FFA、INHB
常规检测后的精液标本经2000×g,离心25min获取精浆,行酶联免疫法ELISA(上海鑫乐生物有限公司试剂盒)检测精浆中FFA、INHB。加样:空白对照孔不加样品,生物素标记的抗FFA、INHB抗体,链霉亲和素-HRP,只加显色剂A&B和终止液,其余各步操作相同;标准品孔:加入标准品50μl,链霉素-HRP 50μl;待测样品孔:加入样本40μl,然后各加入抗-FFA抗体10μl、抗-INHB抗体10μl、链酶亲和素-HRP50μl,盖上封板膜,轻轻振荡混匀,37℃温育60min。配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复4次,拍干。显色:每孔先加入显色剂A 50μl,再加入显色剂B 50μl,轻轻震荡混匀,37℃避光显色15min。终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。测定:以空白孔调零,450nm波长依序测量各孔的吸光度(OD值)。 测定应在加终止液后15min以内进行。根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。
三、统计分析
所有数据均输入SPS17.0处理,通过单因素方差分析(ANOVA)Post Hoc Tests比较各组间的统计学差异,通过相关分析检测各因素之间的相关性。统计差异为P<0.05。
结 果
一、不同BMI组的精液分析
BMI的均值为25.47 kg/m2(SD=3.64 kg/m2),(范围:17.30~35.06 kg/m2),在3组不同BMI男性不育患者精液分析的比较中,正常体质量组精液量多于超质量组精液量,两者之间有统计学差异(P<0.05);正常体质量组精液量多于肥胖组精液量,两者之间有统计学差异(P<0.05);在精液畸形精子率的比较中正常体质量组低于肥胖组,两者之间有统计学差异(P<0.05)。正常体重组总精子数高于肥胖组,两者之间有统计学差异(P<0.05)。BMI与精液量在相关性分析中存在负相关关系(r=-0.34,P<0.01),BMI与总精子数存在负相关关系(r=-0.211,P<0.01)。BMI与精液分析中精液其他参数无相关性,包括精子密度、精子前向运动率和精子活动率,见表1。
二、不同BMI组的精浆FFA vs 精液分析
在3组不同体质量指数男性不育患者中,随着体质量指数的增加,各组精浆中FFA含量均增加,各组精浆中FFA有统计学差异(P<0.05)。BMI与精浆中FFA呈正相关(r=0.57,P<0.01)。精浆FFA与精液分析的各项指标之间的相关性比较中,仅与精液量呈负相关,(r=-0.30,P<0.01),与精液的其他各项指标无相关性,包括:精子密度、精子形态、精子活动率、精液中白细胞数等,见表1,表2。
三、不同BMI组的精浆INHB及与精液参数的关系
在不同BMI分组中,随着体重指数增加精浆中的INHB也逐渐增加,正常体质量组与超质量组INHB有明显的统计学差异(P<0.05),正常体质量组与肥胖组INHB也存在明显的统计学差异(P<0.05),而超质量组与肥胖组精浆INHB没有有统计学差异(P>0.05)。精浆INHB与BMI呈显著正相关(r=0.46,P<0.01)。精浆INHB的精液各项指标无相关性,包括:精液量、精子活动率、精子前向运动率、精子密度、精子畸形率、精液中白细胞数,见表1,表2。
四、不同BMI组精浆FFA 与INHB的相关性
在不同BMI的三组患者中,精浆中FFA随BMI增加而增加。精浆中INHB与FFA有明显正相关性(r=0.47,P<0.01),见表2。
讨 论
肥胖和男性不育在过去的几十年内均逐年增加,对于两者之间的可能的病因一直在探索,肥胖对于男性生育影响有直接和间接的,包括:睡眠呼吸暂停综合症;性激素的改变(INHB和睾酮分泌减少,雌激素水平增减),阴囊内温度升高,精子各项指标下降(总精子数、浓度、活动率均下降,精子DNA碎片指数增加等。MacDonald等[5]通过Meta分析研究认为BMI与精子浓度和总精子数无关,BMI的增加对精液各项参数没有影响。Chavarro等[6]研究结果:BMI与精子浓度、活动率、形态之间无关,但是随着BMI增加精液量减少,特别是BMI超过35kg/m2的男性由于精液量减少,则总精子数减少。Eisenberg等[7]的研究发现随着BMI及腹围增加,精液量逐渐减少,总精子数也随之降低,但是BMI与精子浓度、活动率、精子形态以及精子DNA碎片指数无关。在本次研究结果中3组不同BMI男性不育患者精液分析的比较中,正常体质量组精液量多于超质量组精液量,两者之间有统计学差异;正常体质量组精液量多于肥胖组精液量,两者之间有统计学差异;在精液畸形精子率的比较中正常体重组低于肥胖组,两者之间有统计学差异。由于精液量减少正常体质量组总精子数高于肥胖组,两者之间有统计学差异。BMI与精液量在相关性分析中存在负相关关系,BMI与总精子数存在负相关关系。BMI与精液分析中精液其他参数无相关性,包括精子密度,前向运动率,精子活动率。与前两者的研究结果相似。
表1 不同BMI男性不育患者中精液参数,精浆中FFA、INHB比较(±s)
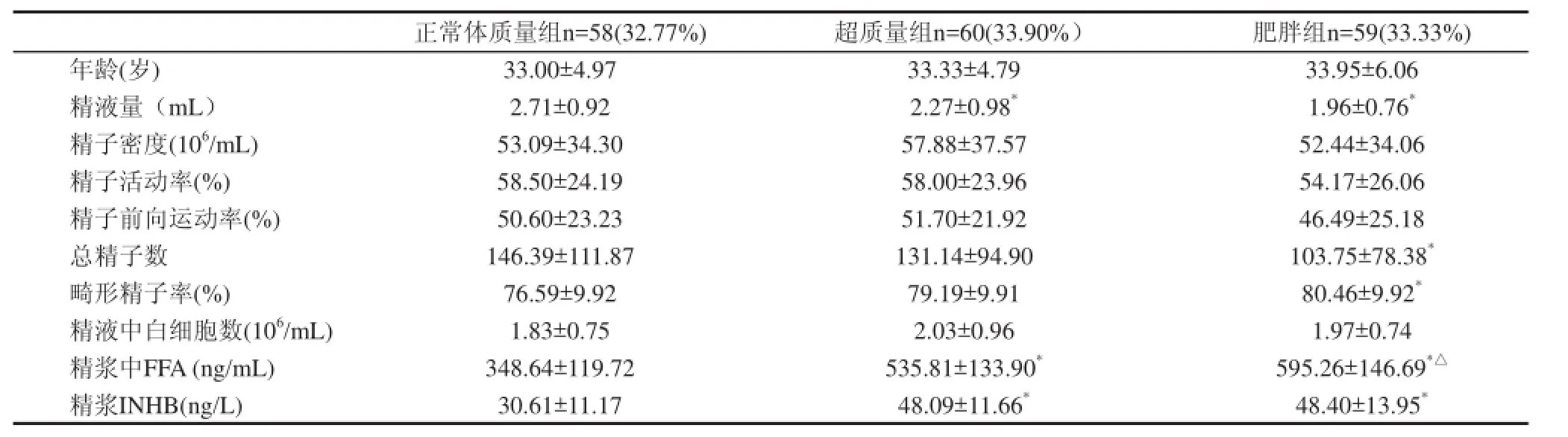
表1 不同BMI男性不育患者中精液参数,精浆中FFA、INHB比较(±s)
与正常组比较,*为P<0.05; 与超质量组比较,△为P<0.05
正常体质量组n=58(32.77%) 超质量组n=60(33.90%) 肥胖组n=59(33.33%)年龄(岁) 33.00±4.97 33.33±4.79 33.95±6.06精液量(mL) 2.71±0.92 2.27±0.98*1.96±0.76*精子密度(106/mL) 53.09±34.30 57.88±37.57 52.44±34.06精子活动率(%) 58.50±24.19 58.00±23.96 54.17±26.06精子前向运动率(%) 50.60±23.23 51.70±21.92 46.49±25.18总精子数 146.39±111.87 131.14±94.90 103.75±78.38*畸形精子率(%) 76.59±9.92 79.19±9.91 80.46±9.92*精液中白细胞数(106/mL) 1.83±0.75 2.03±0.96 1.97±0.74精浆中FFA (ng/mL) 348.64±119.72 535.81±133.90*595.26±146.69*△精浆INHB(ng/L) 30.61±11.17 48.09±11.66*48.40±13.95*
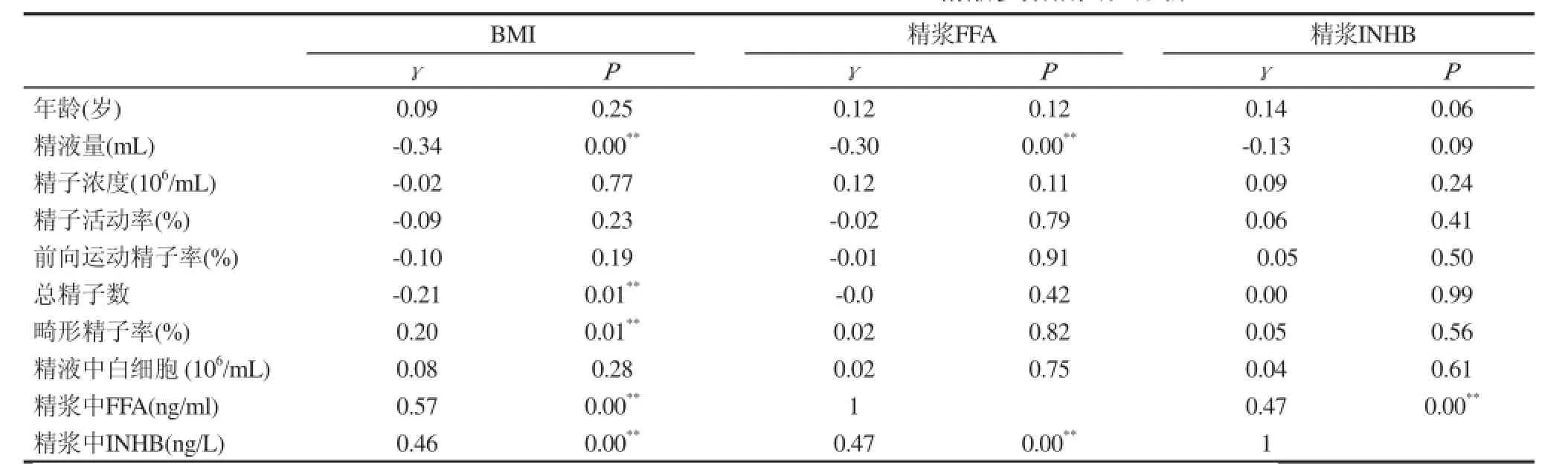
表2 男性不育患者精浆中INHB、FFA、BMI与精液参数相关性分析
肥胖导致血清中FFA增加的机制是:(1)促进脂肪组织释放更多的FFA;(2)FFA清除降低;(3)过量的FFA降低了胰岛素抑制脂肪分解作用,进而使得更多的FFA释放至血液中[8]。因而,直接曝露在过量的不饱和FFA的细胞内线粒体超氧化物生成增加,细胞活性下降,DNA的氧化损伤增加。在睾丸微环境中氧化应激的水平,直接减少精子生成和增加精子损害[9]。尽管氧化应激是导致该情况发生的主要病因,但是也有研究证明在有缺陷的精子中过量的非饱和脂肪酸也是损害精子功能的原因之一[10]。
INHB是有睾丸合成分泌的,主要是支持细胞和生精细胞合成,有两个亚基构成,其结构是由α、β亚基通过二硫键构成的异质二聚体。在男性中血INHB与FSH成明显的负相关,可以反馈抑制FSH的分泌。INHB与睾丸大小呈正相关性,抑制素主要来自生精小管,INHB的测定反映了生殖细胞的数量,所以INHB是反映生精能力的指标[11]。INHB分泌的调节具有个体发生与发育阶段的差异性,胚胎期和青春前期主要受FSH调节;青春后期和整个成年阶段INHB的分泌除FSH的调节外,还依赖于一定发育阶段的生殖细胞(粗线期精母细胞和圆形精子细胞)的存在。儿童期测量INHB 的水平可以用于诊断隐睾症或者性别分化不明的患者。成年男性测量INHB可以直接反映生精能力,可以对诊断不同原因所致的男性不育提供重要依据。在男性不育患者中,INHB分泌减少和FSH分泌增加常常同时出现,INHB与睾丸损害有明显相关性,在睾丸受损的早期就可以发现INHB水平下降[12]。有研究在肥胖男性不育患者中INHB的降低与肥胖程度相关,并不伴有代偿性的FSH升高[13]。肥胖男性中,INHB、游离睾酮减少,雌激素水平升高,主要是由于过多的脂肪组织可以将睾酮转化为雌激素。这种复杂生殖内分泌改变表明在肥胖男性患者中内分泌调节异常可能致使精子生成异常,增加了男性不育的危险性[13]。
在本次研究中,3组不同BMI的男性不育患者中,为避免精液本身差异度过大造成检测结果偏移,选择的精液标本在精子密度、总精子数、精子活动率3组没有差别。既往研究大家更为关注的血液中各类性激素的变化,本次研究着眼于睾丸生精微环境,所以检测精浆中FFA、INHB这两项对于肥胖与男性生育关键的指标,结果显示BMI增加与精液量有负相关性,肥胖组男性不育患者中精子畸形较正常BMI组高。随BMI增加,精浆中FFA含量增加,两者呈正相关关系。同时随BMI增加,精浆中INHB也增加,两者也呈正相关关系。精浆中INHB与精浆中FFA也呈正相关关系。分析本次研究结果与以往不同,是INHB在肥胖人群中没有降低,其中可能是由于在选择人群时正常BMI组、超质量组、肥胖组三组精液常规化验均处于正常范围内,目前超质量组、肥胖组精液尚正常,应该是处于代偿阶段,随着时间推移,INHB对于生精细胞的抑制作用持续,以及FFA带来的氧化应激反应,都会对生精能力造成影响,减少精子生成,导致男性生育力减低。在男性生精能力被破坏后,INHB分泌才会减少,所以INHB在肥胖不育男性早期阶段上升。它可以作为预测男性生精能力代偿的一个指标,为临床判定男性生精能力提供较早和重要参考指标。测试精浆INHB,可以初步分析肥胖男性精子的生育能力,精浆中FFA的检测可以对于肥胖影响睾丸生精微环境的影响提供支持,通过该两项的检验可以对于肥胖不育男性进行早期诊治,增加体育锻炼,减少饮食中脂肪酸的摄入,改善精子生成。
1 Swan SH, Elkin EP, Fenster L. The question of declining sperm density revisited: an analysis of 101 studies published 1934-1996.Environ Health Perspect2000; 108: 961-966
2 Kort HI, Massey JB, Elsner CW,et al. Impact of Body Mass Index Values on Sperm Quantity and Quality. JAndrol2006; 27(3): 450-452
3 Pierik FH, Burdorf A, de Jong FH,et al.Inhibin B: a novel marker of spermatogenesis.Ann Med2003; 35: 12-20
4 Du Plessis SS, Cabler S, McAlister DA,et al. The effect of obesity on sperm disorders and male infertility.Nature Reviews Urology2010; 7(3): 153-161
5 MacDonald AA, Herbison GP, Showell M,et al. The impact of body mass index on semen parameters and reproductive hormones in human males: a systematic review with meta-analysis.Hum Reprod Update2010; 16(3): 293-311
6 Chavarro JE, Toth TL, Wright DL,et al. Body mass index in relation to semen quality, sperm DNA integrity, and serum reproductive hormone levels among men attending an infertility clinic.Fertil Steril2010; 93(7): 2222-2231
7 Eisenberg ML, Kim S, Chen Z,et al. The relationship between male BMI and waist circumference on semen quality: data from the LIFE study.Hum Reprod2014; 29(2): 193-200
8 Boden G. Obesity, Insulin Resistance and Free Fatty Acids.Curr Opin Endocrinol Diabetes Obes2011; 18(2): 139-143
9 Koppers AJ, Garg ML, Aitken RJ. Stimulation of mitochondrial reactive oxygen species production by unesterif ed, unsaturated fatty acids in defective human spermatozoa.Free Radic Biol Med2010; 48(1): 112-119 10 Palmer NO, Bakos HW, Fullston T,et al. Impact of obesity on male fertility, sperm function and molecular composition.Spermatogenesis2012; 2(4): 253-263
11 Meachem SJ, Nieschlag E, Simoni M. Inhibin B in male reproduction: pathophysiology and clinical relevance.Eur J Endocrinol2001; 145(5): 561-571
12 Aitken RJ, Wingate JK, De Iuliis GN,et al. Cis-unsaturated fatty acids stimulate reactive oxygen species generation and lipid peroxidation in human spermatozoa.J Clin Endocrinol Metab2006; 91(10): 4154-4163
13 Michalakis K, Mintziori G, Kaprara A,et al.The complex interaction between obesity, metabolic syndrome and reproductive axis: a narrative review.Metabolism2013; 62(4): 457-478
(2014-03-18收稿)
Correlation of body mass index, free fatty acid and inhibin B in seminal plasma with seminal parameter of infertile male
Bai Shuangyong1, Wang Jiansong1*, Zhao Qinghua2
1. Department of Urology, the Second Aff liated Hospital, Kunming Medical University, Kunming 650000, China 2. Department of Gynaecology, the Second Aff liated Hospital, Kunming Medical University
Wang Jiansong, E-mail:jiansongwang@yahoo.com
ObjectiveTo better understand the effect of obesity on male fertility and analyze the correlation of body mass index, free fatty acid and inhibin B in the seminal plasma with seminal parameter.MethodsUsing simple cluster selection, 177 male infertile patients were enrolled and divided into three group such as normal weight group(58 patients), overweight group(60 patients) and obese group(59 patients). Semen samples were analyzed by conventional methods. The levels of FFA and INHB in seminal plasma were detected by ELISA.ResultsThe volume of semen in overweight group (2.27±0.98)mL was lower than that in normal weight group(2.71±0.92)mL, (P<0.05). The volume of semen of Obesity group(1.96±0.76)mL was lower than that of normal weight group,(P<0.05). There was no signif cant difference in the volume of semen betwen Obese group and overweight group (P> 0.05). Rate of deformity sperm in obese group(80.46±9.92)% waesignif cantly higher than that in normal weight group(76.59±9.92)%, (P<0.05). Total sperm amount in Obesity group(103.75 ±78.38)×106was lower than that in the normal weight group (146.39±111.87) ×106, there was a signif cant difference (P< 0.05). In addition,the seminal plasma concentration of FFA in Normal weight group, overweight, obesity group were (348.64 ±119.72) ng/mL, (535.81±133.90 )ng/mL and (595.26±146.69) ng/mL respectively, there was a signif cant between normal weight and overweight (P< 0.05), between normal weight and obese group (P<0.05), between overweight and obesity group (P< 0.05). FFA in the seminal plasma was positively correlated with BMI (r= 0.569,P<0.01). The concentration of INHB in seminal plasma of the normal weight group , overweight group obesity group were (30.61±11.17)ng/L (48.09±11.66)ng/ L, and (48.40±13.95)ng/L, respectively. There was a signif cant difference between normal weight group and overweight group(P<0.05), between normal weight group and obese group (P<0.05), but there was no signif cant difference between overweight and obesity group (P>0.05). INHB in the seminal plasma was positively correlated with BMI mass index (r= 0.46,P<0.01), and FFA in seminal plasma (r=0.47,P<0.01).ConclusionWith the increase of BMI, the levels of FFA and INHB in the seminal plasma and rate of deformity sperm also increased. To detect the level of FFA and INHB in seminal plasma will be helpful to explain obesity-caused male infertility, and provide certain theoretical basis and reference for clinical treatment.
body mass index; free fatty acid; inhibin B; obesity; infertility, male
10.3969/j.issn.1008-0848.2014.08.005
R 698+.2
*通讯作者, E-mail:jiansongwang@yahoo.com

