补充L-肉碱结合运动对肥胖小鼠骨骼肌FAT/CD36及CPT-1的影响
张 喆,张蕴琨,季 浏
(1.青少年健康评价与运动干预教育部重点实验室,上海 200241;2.南京体育学院,江苏 南京 210014; 3.华东师范大学体育与健康学院,上海 200241)
补充L-肉碱结合运动对肥胖小鼠骨骼肌FAT/CD36及CPT-1的影响
张 喆1,2,3,张蕴琨2,季 浏1,3
(1.青少年健康评价与运动干预教育部重点实验室,上海 200241;2.南京体育学院,江苏 南京 210014; 3.华东师范大学体育与健康学院,上海 200241)
目的:研究补充L-肉碱结合运动对营养型肥胖小鼠骨骼肌FAT/CD36以及CPT-1的影响。方法:49只C57BL/6雄性小鼠,随机选取9只喂养普通饲料(C组),另外40只建立肥胖模型(H组)。建模成功后将小鼠随机分为肥胖安静组(H)、肥胖肉碱组(HL)、肥胖运动组(HE)、肥胖肉碱结合运动组(HLE)。HE、HLE组进行为期5周的游泳训练,5天/周,1小时/天。HL、HLE组小鼠每天训练前1小时灌胃L-肉碱。实验期间监测小鼠体重变化,实验结束后取腓肠肌检测相关指标。结果:①HE、HLE组体重低于H组,且HLE组体重低于HL组;②HE、HL组和HLE组的FFA含量显著低于H组,而HE、HLE组的FFA含量也明显低于HL组;③HL、HE组和HLE组的CPT-1酶含量显著低于H组;④HE组的FAT/CD36表达量高于H组,HLE组则低于H组;⑤CPT-1酶含量和FAT/CD36表达量与体重均呈中度正相关。以上差异均具有统计学意义,P<0.05或P<0.01。结论:①与补充L-肉碱相比,运动和运动结合L-肉碱有更显著的控体重效果和促进脂肪酸氧化的作用。②单纯运动,补充L-肉碱以及运动结合L-肉碱均可降低骨骼肌内CPT-1酶的含量。③运动结合左旋肉碱可交互促进降低FAT/CD36的表达量。
L-肉碱;运动;CPT-1酶;FAT/CD36
左旋肉碱(L-肉碱)是游离脂肪酸进入线粒体氧化场所的唯一载体,其主要功能是携带、转运活化的脂肪酸,特别是长链脂肪酸(long chain fatty acid, LCFA)穿越线粒体膜,进入线粒体内进行β-氧化和三羧酸循环反应,为机体的各种代谢活动提供能量。左旋肉碱作为一种强有力的营养补剂,已广泛应用于运动减脂和运动抗疲劳中,但关于其作用机制方面的研究并不深入。
此外,FAT/CD36是新近发现并已确定存在于心肌,骨骼肌等的与长链脂肪酸转运密切相关的蛋白,且在运动、肥胖等情况下存在胞膜循环以及表达量的改变。
本研究将观察外源性补充L-肉碱结合运动对骨骼肌CPT-1酶,FAT/CD36含量等的影响,旨在进一步从分子水平探讨运动的作用以及左旋肉碱的作用机制。
1 材料与方法
1.1 实验动物与材料
实验对象为4周龄雄性C57BL/6小鼠49只(购于南京医科大学实验动物中心,许可证号为SCXK (苏)2008-0004),随机选取9只喂养普通饲料作为建模对照组(C组),另外40只建立营养性肥胖小鼠模型(H组),喂食高脂饲料,以H组小鼠的平均体重与C组相比显著增加(P<0.01)为建模成功标准,随后在高脂组中筛选出营养性肥胖模型小鼠[1]。实验期间小鼠自由摄食和饮水。高脂饲料于南京市江宁区青龙山动物繁殖场定制,配方为12%猪油、4%白糖、2%奶粉、1%胆固醇、0.2%胆盐、6%蛋黄、普通饲料74. 8%[1]。
经过4周的高脂饮食,与C组相比,H组的体质量差异具有显著性差异(P=0.002,P<0.01)。剔除C组,根据平均数±标准差(D)在高脂组中剔除体重过高或过低的小鼠(剔除1只)筛选出营养性肥胖模型,建模过程中死亡3只,最后保留36只小鼠进入正式实验,实验期间小鼠自由摄食和饮水。
表1 建模成功后小鼠体重(D)单位:g
注:**表示与C组相比,具有显著性差异(P<0.01)
C组H组体重23.04±0.94 25.52±2.14**
1.1.1 实验分组
将36只营养型肥胖模型小鼠随机分为4组,每组9只(表2):

表2 分组方案
分组后动物分笼饲养,每笼1只。
1.1.2 实验各组小鼠体重
表3 实验前各组小鼠体重(D)单位:g

表3 实验前各组小鼠体重(D)单位:g
H组HL组HE组HLE组26.28±2.9 25.54±2.63 24.53±2.57 23.8±1.2体重
1.2 研究方案
1.2.1 左旋肉碱的补充方法
HL组HLE组小鼠于每次游泳训练前1小时按500mg/kg的剂量灌胃L-肉碱(购于Sigma-Aldrich,纯度≥98%),随体重增加,每周补充左旋肉碱的量按500mg/kg相应增加。
1.2.2 小鼠游泳训练方案
采用小鼠无负重游泳训练方式,水深设定在30cm,为小鼠体长的1.5-2.5倍,水温控制在31℃± 1℃,泳池长、宽、高为120cm×60cm×100cm,每个泳池9只小鼠。H组小鼠不进行游泳训练,按照常规条件饲养。HE组和HLE组小鼠先进行游泳适应性训练,强度从无负重游泳20min开始,然后递增至40min, 60min。正式训练方案采用5周无负重游泳训练,5次/周,60min/次。于每周最后一次训练结束后称重并记录。
1.3 取材
经过5周的实验,各组小鼠于最后一次训练后48小时处死[2],于处死前一天禁食。使用20%乌拉坦腹腔麻醉,随后断头处死。
小鼠断头处死后迅速取出腓肠肌,在冰面上去除脂肪、筋膜等结缔组织,放入离心管中后用保鲜膜封住管口,迅速投入液氮罐中冻存,次日放入-80℃冰箱中保存备用。
1.4 测试指标与方法
1.4.1 小鼠骨骼肌FFA的检测
称取骨骼肌50±5mg/样,置于离心管中,每个离心管中加入500μL0.9%的生理盐水(浓度为10%),随后匀浆,4℃5000g离心5分钟后提取上清液,使用游离脂肪酸测试盒检测(购于南京建成生物工程),取500mg骨骼肌剪碎加入0.5mL0.9%生理盐水置于玻璃匀浆器中匀浆,离心后取上清保存,随后严格按照说明书流程操作,取200μl待测样本,制备空白管、标准管和测定管,使用分光光度计440nm波长比色。
1.4.2 小鼠骨骼肌CPT-1酶的含量的检测
称取骨骼肌100±10mg/样,置于离心管中,每个离心管中加入1mL的1×PBS溶液匀浆,制成匀浆液后置于-20℃冰箱过夜,经过反复冻融2次处理破坏细胞膜后,将组织匀浆液于4℃5000g离心5分钟取上清后置于-20℃保存,次日解冻后按上述方法再次离心提取上清进行检测。使用购于CUSABIO公司的CPT-1酶含量的ELISA试剂盒检测CPT-1酶的含量,严格按照说明书流程操作,使用全自动酶标仪450nm波长检测。
1.4.3 小鼠骨骼肌FAT/CD36的表达量的检测
采用免疫印迹(Western-Blot)的方法检测蛋白表达量。称取骨骼肌100±10mg/样,加入RIPA裂解液反应。电动匀浆机匀浆6次,10秒/次,每次间隔10秒。低温高速离心10min,取上清为股直肌匀浆液。
采用BCA法测定匀浆液中蛋白浓度,使用RIPA裂解液将各样品匀浆液蛋白浓度调至同一水平,分装后置于-80℃保存备用。采用8%SDS-凝胶电泳,分离蛋白质。湿法转印蛋白至NC膜(75min,90V恒压)。使用含3%牛血清蛋白(BSA)的TBST封闭液,室温封闭1h。
加入一抗稀释工作液(兔源FAT/CD36单克隆抗体,1∶600),内参使用β-actin抗体(兔源单克隆抗体,1:5000),4℃孵育12h。TBST洗膜后,加入二抗稀释工作液(含碱性磷酸酶抗兔IgG,1∶2000),室温孵育2h。TBST洗膜后,加入BCIP/NBT碱性磷酸酶显色试剂显色,显色结束后用双蒸水终止显色反应。
蛋白表达量自定义为每个样品的FAT/CD36灰度值与内参β-actin(Santa Cruz,USA)灰度值的比值。
1.4 数据处理
2 研究结果
2.1 肥胖小鼠体重的变化
表4 实验前后小鼠体重变化(D)单位:g

表4 实验前后小鼠体重变化(D)单位:g
注:*表示与H组相比,差异具有统计学意义(P<0.05);**表示与H组相比,具有显著差异(P<0.01);△表示与HLE相比差异具有统计学意义(P<0.05)
H组HL组HE组HLE组** 26.28±2.9 25.54±2.63 25.03±2.24 23.8±1.2运动1周后27.8±2.49 26.08±2.71 25.54±2.30*24.61±1.77*运动2周后28.02±2.82 26.16±1.34 26.43±2.38 26.09±1.69运动3周后28.13±3.32 26.88±1.89 26.8±2.74 25.37±1.96运动4周后29.4±3.28 28.01±2.92 27.69±2.93*25.6±1.84*运动5周后30.39±3.23 28.48±3.03△27.46±3.11**25.78±2.02运动前
表4和图1显示,实验前各组小鼠体重均无明显差异(P>0.05),经过实验,各组小鼠体重都呈现一定的增长趋势(如图1),其中H组的净增长率最高(15.64%);其次是HL组;HE组和HLE组的净增长率最低。运动4周后,HE组,HLE组小鼠的体重低于H组,差异具有统计学意义(P<0.05);运动5周后,HE和HLE组小鼠体重明显低于H组(P<0.01);且HLE组小鼠体重低于HL组(P<0.05)。
2.2 肥胖小鼠骨骼肌内FFA的变化
如表5所示,HE和HLE组的骨骼肌匀浆液内的FFA含量显著低于H组(P<0.01),HL组低于H组(P<0.05),HE、HLE组低于HL组(P≤0.01)。
2.3 肥胖小鼠骨骼肌CPT-1酶的变化

图1 实验前后小鼠体重变化趋势(单位:g)

表5 小鼠骨骼肌FFA的变化单位:μmol/gprot

表6 骨骼肌CPT-1酶的含量变化单位:pg/mL
如表6所示,HL组,HE组和HLE组的骨骼肌中CPT-1酶的含量显著低于H组(P<0.05)。通过X拟合Y分析发现,体重与CPT-1酶的含量之间中度正相关(相关性为0.5)。
2.4 肥胖小鼠骨骼肌FAT/CD36表达的变化

表7 小鼠骨骼肌FAT/CD36与β-actin的灰度值之比
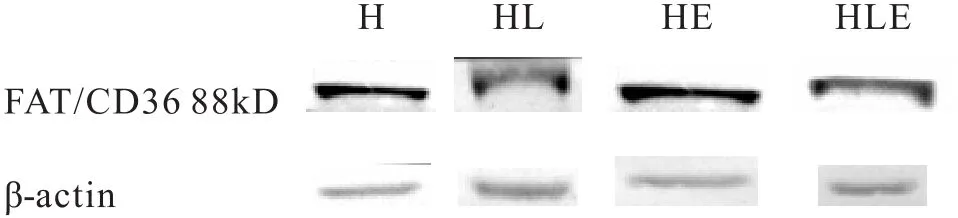
图2 各组小鼠骨骼肌FAT/CD36及内参β-actin的表达
如表7所示,5周的实验后,HE组高于H组(P= 0.05);但HLE组低于H组(P<0.05)。运动与左旋肉碱有交互促进作用。此外,FAT/CD36的表达量与体重呈中度正相关,相关性为0.3。
3 分析与讨论
3.1补充左旋肉碱结合运动对肥胖小鼠体重、骨骼肌FFA和CPT-1酶的影响
体重是反映肥胖小鼠变化最直观的指标,本研究通过动态观察小鼠体重变化,发现随着运动的进行,运动对于肥胖小鼠的控体重作用越来越明显,进一步证实合理的运动对于肥胖的控体重有明显作用。长期坚持一定时间的有氧运动可有效促进脂肪的消耗,脂肪酸的活化,从而达到控体重的目的,这也与Greenlee等人的研究结果一致[3-5]。在5周的实验过程中,HL组与H组相比,小鼠体重均未出现具有统计学意义的差异,但5周后HLE组低于HL组(P<0.05)。以上说明单纯补充L-肉碱可能不能对肥胖小鼠产生明显的控体重作用,这与许多国外的研究一致[6,7],提示:若以控体重为目的,外源性补充L-肉碱的同时,运动是必不可少的施加因素,单纯补充L-肉碱还不能有效地促进脂代谢的加强,可能与外源性补充左旋肉碱的吸收以及利用有关。
另外,本研究显示,对于营养型肥胖小鼠,长期游泳运动训练可降低骨骼肌内FFA的含量,单纯补充L -肉碱也可降低骨骼肌FFA含量,但作用没有运动及运动结合L-肉碱明显。因此,对于促进FFA转运代谢来说,外源性补充L-肉碱的同时,结合运动效果会更佳,这与控体重类似。有研究指出运动可促进FFA的利用[8],这与本研究结果一致,同时不难推测,补充L-肉碱也有利于FFA的转运代谢。
CPT-1酶是脂肪酸(尤其是长链脂肪酸)进入线粒体进行β-氧化的限速酶。本研究关于骨骼肌内FFA含量的变化趋势与骨骼肌内CPT-1酶含量的变化趋势基本一致,进一步证实运动和外源性补充L-肉碱均可影响脂代谢。结合Harper等人[9]的研究结果,正常大鼠在经历长期外源性补充L-肉碱及游泳训练后,实验组与安静组相比,CPT-1酶的活性显著增加,因此推测H组的CPT-1含量可能是因为酶活性较低而出现的含量代偿性增加,而其余各组可能因为酶活性的增加以及运动对肥胖小鼠一定的减脂作用,从而出现骨骼肌内FFA和CPT-1含量的相对减少。
3.2 补充左旋肉碱及运动对肥胖小鼠FAT/CD36表达量的影响
Roepstorff等人[10]的研究表明5天的高脂饮食即可增加FAT/CD36的表达量;Jain等人[11]发现中低强度的运动可增加LCFA氧化速率及骨骼肌FAT/CD36总蛋白表达;而Holloway等人[12]也发现在耐力运动过程中,线粒体FAT/CD36表达的增加与体内脂肪酸氧化的增加有密切联系。这与本实验关于HE组的研究结果基本一致,本实验施加的运动强度属于中、低强度,这是HE组出现骨骼肌FAT/CD36表达量增加的原因之一。
另外,国内学者张治宇等人[13]认为在糖尿病的早期阶段,LCFA的运输,氧化增加,FAT/CD36的表达量也增加。随着病程延长,FAT/CD36的含量反而无变化。Angela等人[14]在以高脂饮食诱导的Zucker糖尿病大鼠为实验对象的研究中发现,大鼠进行长期有氧运动后,其比目鱼肌FAT/CD36蛋白均较糖尿病对照组显著下降,但仍高于正常安静组。推测本研究HE组施加的运动时间可能还处于“早期”,在这个时期运动促进了脂肪酸的转运,故HE组FAT/CD36的蛋白含量出现暂时性升高,此时FAT/CD36的表达量还未能出现适应性降低;但由于运动和L-肉碱的交互促进作用,使得HLE组出现了FAT/CD36的适应性下降。
该工艺初期对铁锰的去除主要决定于高锰酸钾投加量,只要氧化剂的投加量满足,系统启动初期便能稳定控制铁锰。在系统运行前期(1个月),需按理论值投加高锰酸钾才能有效控制铁锰;系统运行一段时间后,砂滤层自身逐渐具备一定的除铁锰能力,可适当降低高锰酸钾投量,投加量维持在理论值的90%以上时便可有效控制出水铁锰。系统的启动需3~4个月的时间,投加高锰酸钾主要是根据水中有机物的污染程度确定,仅考虑对铁、锰的去除可不再继续投加高锰酸钾。
Bonen等人[15]和Cohen等人[16]均认为,FAT/ CD36并不是静态存在于细胞的某个位置,其会因为诸多原因出现胞膜循环,也就是说细胞内存在一定量的FAT/CD36,分布于细胞膜表面、胞浆内、以及线粒体膜表面,在不同情况下不同部位的FAT/CD36会出现转移。上述观点说明FAT/CD36的不同定位对于长链脂肪酸的有效转运至关重要,研究FAT/CD36的胞膜循环可能能更好地解释本课题的现象,包括运动结合L-肉碱的交互促进作用。
3.3 运动结合L-肉碱促进脂代谢的机理
本研究还发现,小鼠体重与CPT-1酶含量之间呈中度正相关(相关性0.5),结合3.2的分析,原因很可能与一磷酸激活蛋白激酶(adeninemonophosphate protein kinase,AMPK)通路有关。运动可激活AMPK通路,引起乙酰辅酶A羧化酶(acetyl CoA carboxylase, ACC)磷酸化,从而使其活性下降,同时丙二酰辅酶A脱羧酶(malonyl coenzyme Adecarboxylase,MCD)活性增强,进而丙二酰辅酶A合成速率减缓,并使CPT-1酶的抑制作用减轻,CPT-1酶的活性增强,引起脂肪酸的氧化增加[17]。因此运动很可能是通过AMPK通路的激活使得CPT-1酶活性增加,从而使得肥胖安静小鼠骨骼肌内的CPT-1酶出现因活性较低而引发的含量代偿性增高。CPT-1酶活性增加又促进脂肪酸的氧化,由此骨骼肌内FFA的含量降低,进而达到通过运动促进脂代谢控体重的目的。另外,鉴于外源性补充L-肉碱也可降低CPT-1酶的含量,并且骨骼肌内的FFA的含量也降低,其中的机制是否也与AMPK通路有关值得探讨。
研究还显示,FAT/CD36的表达量与体重亦呈中度正相关,进一步说明FAT/CD36与脂肪酸转运以及肥胖等脂代谢异常疾病密切相关,且FAT/CD36与CPT-1密切相关。袁海瑞等人[18]认为运动可能通过AMPK-CPT1途径对FAT/CD36进行调节。结合3.1和3.2综合分析,不难推测,运动激活AMPK通路,使得CPT-1酶活性增加,CPT-1酶含量出现适应性降低,FAT/CD36含量出现“暂时性”升高,脂肪酸氧化增加,骨骼肌内FFA含量降低,由此达到减脂控体重的目的。而外源性补充L-肉碱虽未能起到明显的控体重作用,效应有一定的滞后性,但还是降低了CPT-1酶的含量和FFA的含量。且可与运动交互促进FAT/ CD36的含量出现适应性降低,说明外源性补充L-肉碱已在分子水平引起改变,可能也是通过激活AMPK通路引起上述变化。但其与运动交互促进降低FAT/ CD36含量的机制有待进一步明确,可能还涉及其余物质或通路,如细胞外信号调节激酶2(extracellular signal-regulated kinase2,ERK2),过氧化物酶增殖物激活受体γ共化合物1α(peroxisome proliferator activated receptorγcoactivatorα,PGC-1α)等。
4 结论
(1)单纯补充L-肉碱未能对肥胖小鼠产生明显的控体重和促进脂肪酸氧化代谢的作用,而运动以及运动结合L-肉碱的干预出现显著的控体重效果,并且促进脂肪酸代谢。
(2)单纯运动可增加肥胖小鼠骨骼肌FAT/CD36的蛋白表达量,可能是因为脂肪酸转运利用增加使得FAT/CD36的蛋白表达量出现暂时性升高。
(3)单纯运动,补充L-肉碱以及运动结合L-肉碱均可降低骨骼肌内CPT-1酶的含量。运动结合L-肉碱可交互促进降低FAT/CD36的表达量。运动和补充L-肉碱可能均通过AMPK通路作用于CPT-1和FAT/ CD36。
[1]刘雪姬,陈庆森,闫亚丽.高脂饮食对小鼠肠道菌群的影响[J].食品科学,2011,32(23):306-311.
[2]Dean D,Daugaard JR,Young ME,et al.Exercise diminishes the activity of acetyl-CoA carboxylase in human muscle[J].Diabetes,2000,49(8):1295-1300.
[3]Greenlee HA,Crew KD,Mata JM,et al.A pilot randomized controlled trial of a commercial diet and exercise weight loss program in minority breast cancer survivors[J].Obesity(Silver Spring),2013,21(1):65-76.
[4]Lee JK,Lee JS,Park H,et al.Effect of L-carnitine supplementation and aerobic training on FABPc content and beta-HAD activity in human skeletalmuscle[J].Eur JAppl Physiol,2007,99 (2):193-199.
[5]Losel D,Rehfeldt C.Effects of l-carnitine supplementation to suckling piglets on carcass andmeatquality atmarketage[J].Animal,2013,7(7):1191-8.
[6]Bacurau RF,Navarro F,BassitRA,etal.Does exercise training interfere with the effects of L-carnitine supplementation[J]. Nutrition,2003,19(4):337-341.
[7]Rivero JL,Sporleder HP,Quiroz-Rothe E,et al.Oral L-carnitine combined with training promotes changes in skeletalmuscle[J].Equine Vet JSuppl,2002(34):269-274.
[8]Foster CV,Harris RC.Total carnitine content of the middle glutealmuscle of thoroughbred horses:normal values,variability and effect of acute exercise[J].Equine Vet J,1992,24(1):52-57.
[9]Harper P,Elwin CE,Cederblad G.Pharmacokinetics of intravenous and oral bolus doses of L-carnitine in healthy subjects.Eur JClin Pharmacol[J].1988,35(5):555-562.
[10]Roepstorff C,Helge JW,Vistisen B,etal.Studies of plasma membrane fatty acid-binding protein and other lipid-binding proteins in human skeletalmuscle[J].Proc Nutr Soc,2004,63(2): 239-244.
[11]Jain SS,Chabowski A,Snook LA,et al.Additive effects of insulin and muscle contraction on fatty acid transport and fatty acid transporters,FAT/CD36,FABPpm,FATP1,4 and 6[J].FEBS Lett,2009,583(13):2294-2300.
[12]Holloway GP,Bezaire V,Heigenhauser GJ,et al.Mitochondrial long chain fatty acid oxidation,fatty acid translocase/CD36 content and carnitine palmitoyltransferase Iactivity in human skeletalmuscle during aerobic exercise[J].J Physiol,2006,571(1): 201-210.
[13]张治宇,倪海莱,赵彤,等.2型糖尿病大鼠心肌脂肪酸转运体FAT/CD36的表达变化及其对脂肪酸代谢的影响[J].第二军医大学学报,2010(5):576-578.
[14]Angela C,Smith AC,Mullen KL,et al.Merformin and exercise reduce FAT/CD36 and lipid accumulation and blunt the progression of high-fat diet-induced hyper glycemia[J].Am JPhysiol Endorinol Metab,2007,293(1):E172-E181.
[15]Bonen A,Parolin ML,Steinberg GR,et al.Triacylglycerol accumulation in human obesity and type 2 diabetes is associated with increased rates of skeletalmuscle fatty acid transport and increased sarcolemmal FAT/CD36[J].FASEB J,2004,18(10): 1144-1146.
[16]Cohen AW,Hnasko R,SchubertW,et al.Role of caveolae and caveolins in health and disease[J].Physiol Rev,2004,84(4): 1341-1379.
[17]Bezaire V,Bruce CR,Heigenhauser GJ,et al.Identification of fatty acid translocase on human skeletal muscle mitochondrial membranes:essential role in fatty acid oxidation[J].Am JPhysiol Endocrinol Metab,2006,290(3):E509-E515.
[18]袁海瑞,牛燕媚,傅力.脂肪酸转位酶(FAT/CD36)在运动改善胰岛素抵抗中的作用[J].中国运动医学杂志,2011,29 (6):718-721.
The effect of L-carnitine and exercise on obesem ice FAT/CD36 and CPT-1 enzyme in skeletalmuscle
ZHANG Zhe,et al
(Key Laboratory of Adolescent Health Assessment and Exercise Intervention of the Ministry of Education,Shanghai,200241)
Objective:To study the effects of L-carnitine combined with exercise on FAT/CD36 and CPT-1 of obesemice.Methods:Male C57BL/6 mice were random ly assigned to group C(fed with normal diet)and group H (fed with high-fat diet).After group H wasmodeled successfully,they were randomly divided into group H(obesity quiet),group HL(obesity with L-carnitine),group HE(obesitywith exercise),group HLE(obesitywith L-carnitine combined exercise).Swimming training was adopted to them,1 hour/day,5 days/week,lasting for five weeks. Group HL,HLE were gavaged with L-carnitine an hour before training.During the experiment,changes of body weight ofmice were monitored.After the experiment,the gastrocnemius muscles were prepared to determine the content of FFA,CPT-1 and FAT/CD36.Results:①After 5 weeks of training,the body weight of group HE and HLE became lower than group H,and theweightof group HLEwas also lower than group HL;②the FFA of group HL,HE and HLE was significantly lower than in group H,and in group HE and HLE itwas also significantly lower than group HL;③the contents of CPT-1 of group HL,HE and HLE were significantly lower than in group H;④the expression of FAT/CD36 of group HE was higher than in group H,HLE group was lower than group H;⑤the content of CPT-1 and FAT/CD36 showed amoderate positive correlation with body weight.These differenceswere statistically significant,P<0.05 or P<0.01.Conclusion:①there is no apparent role of pure L-carnitine supplementation in controlling weight.However, there is significant effect of exercise and exercise combined with L-carnitine on controllingweight.②the effect of exer-cise and exercise combined with L-carnitine in promoting metabolism and oxidation of fatty acid ismore obvious than pure L-carnitine supplementation.③L-carnitine,exercise,and exercise combined with L-carnitine can reduce CPT-1 levels.④exercise combined with L-carnitine can interactively reduce the expression of FAT/CD36.The contents of CPT-1,FAT/CD36 aremoderately correlated with body weight.
L-carnitine;exercise;CPT-1;FAT/CD36
G804
:A
:1001-9154(2014)08-0077-06
G804
:A
:1001-9154(2014)08-0077-06
江苏省科技厅基础研究计划(自然科学基金)项目编号:BK2011863;青少年POWER工程协同创新中心项目,项目编号:44801400/012。
张喆(1986-),女,重庆人,博士研究生,硕士学位,研究方向:运动对健康作用的细胞分子机制研究。
2014-03-08

