基于DPPH-HPLC技术的马粪海胆抗氧化活性指纹图谱初步研究
赵恒强,陈军辉,耿岩玲,刘建华,王晓*
(1.山东省科学院中药过程控制研究中心,山东省大型精密分析仪器应用技术重点实验室,山东省分析测试中心,山东 济南 250014;2.国家海洋局第一海洋研究所,青岛市现代分析技术及中药标准化重点实验室,山东 青岛 266061)
中药是多成分多靶点的复杂体系,如何对中药进行有效的质量控制和真伪鉴别是中药现代化的重要内容[1]。海洋中药是中草药的重要组成部分,但其药效物质基础研究相对滞后,也缺乏进行质量控制和真伪鉴别的相关质量标准和科学、有效的鉴别手段。因此,开展海洋中药的质量控制和真伪鉴别研究,对加快开发海洋中药资源具有重要意义。
化学指纹图谱技术因能表征中药的整体性得到普遍应用[2-4],但是指纹图谱仅能表征中药多种化学成分的差异情况,而不能确切反映中药产品的药效。如果将指纹图谱与生物、化学活性结合起来,以反映中药活性的成分为指标用于中药的质量控制,将能更好地反映中药的质量。有关谱效结合指纹图谱的研究目前已经成为中药质量控制研究的热点[1,5]。
抗氧化活性是中药研究的热点之一[6],近年来,采用抗氧化活性指纹图谱对中药进行质量控制和真伪鉴别的探索性研究报道屡见不鲜[7-13]。然而,以往的研究多是以基于稳定自由基(如:DPPH、ABTS等)-HPLC联用技术的抗氧化成分在线筛选方法对中药提取物进行筛选,从而进一步建立其抗氧化活性指纹图谱用于其质量控制。但是,由于该技术筛选速度快,对缓慢抗氧化成分易造成假阴性结果,不能全面反应中药的活性成分信息。基于稳定自由基-HPLC联用技术的离线抗氧化成分筛选方法因反应时间充分,可以更好地避免假阴性结果,并且方法准确度、灵敏度较高,引起了研究者的广泛关注[14-16]。采用该筛选方法获得的抗氧化活性成分所对应的色谱峰作为指纹图谱特征峰能更加全面地反应中药的活性成分信息。目前,有关这方面的研究未见报道。
本研究以药食两用的海洋中药马粪海胆(Hemicentrotus pulcherrimus(A.Agassiz))为研究对象,发展了基于DPPH-HPLC技术的离线抗氧化活性指纹图谱方法,并初步用于对不同来源样品的鉴别。研究结果为海洋中药的质量控制和真伪鉴别提供了新思路、新技术。
1 实验部分
1.1 仪器与材料
Agilent 1260高效液相色谱仪,配有四元泵,DAD检测器,自动进样器等(美国 Agilent公司);KQ-400KDE型超声波仪(昆山市超声仪器有限公司);R201型旋转蒸发仪(上海申生科技有限公司);A J100型电子天平(瑞士 Mettler-Toledo公司)。AlltimaTMC18色谱柱(4.6×250mm,5 μm,美国Alltech公司)。
甲醇、乙腈为色谱纯,其余试剂均为分析纯,DPPH(95%,德国Sigma-Aldrich公司),芦丁(95%,德国Sigma-Aldrich公司),咖啡酸 (99%,德国Sigma-Aldrich公司),实验用水为超纯水(电阻率为18mΩ·cm,Milli-Q公司)。
本文采用的10个不同批次马粪海胆样品分别采自青岛、烟台和大连沿岸海域,采集时间为2012年8月~9月,经山东省科学院王晓研究员鉴定,均为马粪海胆,样品详细信息见表1。海胆样品经自来水冲洗干净后,置于烘箱中55℃鼓风干燥至干。干燥后的海胆样品避光、密闭、常温贮藏。

表1 马粪海胆样品来源Table 1 Origins of Hemicentrotus pulcherrimus samples
1.2 溶液的配制
1.2.1 DPPH 溶液的配制
准确称取DPPH标准品适量,用甲醇溶解并配成0.1 mol/L的DPPH甲醇溶液,锡纸包裹严密,置冰箱中于4℃保存,使用时以甲醇稀释至适当浓度。
1.2.2 马粪海胆样品溶液的制备
精密称取马粪海胆样品0.5 g,转入25 mL具塞三角烧瓶中,加入25 mL超纯水,超声辅助提取25 min,提取温度为室温,将提取液过滤,并在55℃条件下进行旋蒸至干,用水溶解并定容至2 mL,过0.45 μm微孔滤膜,待用。
1.3 色谱条件
AlltimaTMC18色谱柱。流动相:A 20mmol/L HCOONH4+0.1%HCOOH水溶液;B 甲醇。流速:0.8mL/min。检测波长:254 nm。温度:室温(20 ℃)。进样量 20 μL。洗脱程序:0~10min,0%B;10~20min,0~5%B;20~35 min,5% ~10%B;35~45 min,10% ~40%B;45 ~55 min,40% ~100%B;55 ~70min,100%B。
1.4 抗氧化成分的筛选
取马粪海胆水提液0.5 mL置于棕色瓶中,加入0.5 mL DPPH溶液迅速混合均匀,避光反应20min,经0.45 μm微孔滤膜过滤后采用HPLC进样测定,进样量为40 μL。以同体积的甲醇代替DPPH溶液作为空白对照,对比色谱峰面积变化情况,其中色谱峰面积明显减小的成分为潜在的抗氧化剂。
2 结果与讨论
2.1 色谱条件优化
初步研究表明,马粪海胆的水提物具有较好的自由基清除活性,考察了4根不同的反相色谱柱Agilent ZORBAX SB-C18(4.6 ×250mm,5 μm),Agilent Eclipse XDB-C18(4.6 × 250mm,5 μm),AlltimaTMC18色谱柱(4.6 × 250 mm,5 μm),WatersXBridgeTMC18(2.1 ×150mm,3.5 μm)对马粪海胆水提物的分离效果。发现采用AlltimaTMC18色谱柱时,马粪海胆水提物中各色谱峰分离度较高,因此选择AlltimaTMC18色谱柱用于马粪海胆水提物分离研究。对比了采用甲醇-水和乙腈-水作为流动相时的分离效果,表明采用甲醇-水作为流动相时马粪海胆水提物中各化合物具有良好的保留和分离效果。由于马粪海胆水提物成分复杂,因此本研究采用梯度洗脱用于其分离研究。改变流动相酸度可以减少拖尾现象,考察了不同类型弱酸及含量(0.1%HCOOH,0.2%HCOOH,0.1%CH3COOH,0.2%CH3COOH)的影响,发现采用流动相 A 中加入0.1%HCOOH时,各峰对称性较好。考察了流动相中添加不同类型缓冲盐及浓度的影响,表明流动相A中加入20mmol/L HCOONH4时,各峰形尖锐,对称性较好。因为在不同的检测波长下,其提取物各色谱峰数量、峰高及分布均有明显不同,所以考察了马粪海胆水提物在不同波长(190~900 nm)下的色谱图,结果发现在254 nm时,其HPLC色谱图色谱峰较多、且强度较高,因此本研究选择254 nm用于HPLC分析的检测波长见图1。

图1 马粪海胆水提物的HPLC图Fig.1 HPLC chromatogram of the water extract of Hemicentrotus pulcherrimus
2.2 抗氧化成分的DPPH-HPLC筛选
用1.2.2方法制备的马粪海胆样品溶液采用1.3色谱条件进行分析,按照1.4所述筛选条件对马粪海胆水提液中的抗氧化成分进行了筛选,结果如图2所示。从图中可以看出,采用本文的方法,在马粪海胆的水提物中筛选到了9种成分,且在反相柱上的出峰时间较短,证明其极性较大。
2.3 方法学考察
首先,对反应前后马粪海胆基质中添加的标准对照品咖啡酸、芦丁的峰面积变化进行了考查。反应后标准对照品咖啡酸、芦丁的峰面积分别减小为反应前的21.19%和 39.43%,3次测定 RSD 分别为 5.82%,7.43%,说明该筛选方法准确性较高。
其次,在优化的色谱条件下,以各抗氧化成分的色谱峰面积为考察指标,对HPLC分析方法学分别进行了考察。同一马粪海胆样品6次平行进样分析表明,各抗氧化成分峰面积的RSD值均低于3.35%,说明该方法具有较好的精密度;同一马粪海胆样品平行称取6份,并依次按本研究方法进行处理、分析,各抗氧化成分峰面积的RSD值在5.43%范围内,说明该方法具有较好的重复性;将同一样品分别在0、2、4、6、8、12 h进样分析,各抗氧化成分峰面积的RSD值在3.31% ~5.62%(n=6)范围内,说明样品在12 h内稳定性较好。
由此可以看出,采用基于各抗氧化成分的HPLC分析方法,具有较好的精密度、稳定性和重现性,为指纹图谱的建立提供了方法基础。

图2 马粪海胆水提物与DPPH反应前后的色谱图Fig.2 HPLC-DAD chromatograms ofwater extractof Hemicentrotus pulcherrimus before and after reaction with DPPH free radicals
2.4 抗氧化活性指纹图谱的建立
为进一步考察基于DPPH-HPLC技术的离线抗氧化活性成分对海洋中药进行真伪鉴别的可行性,本研究将指纹图谱与抗氧化活性结合起来形成基于抗氧化活性成分的指纹图谱方法对海洋中药进行真伪鉴别。
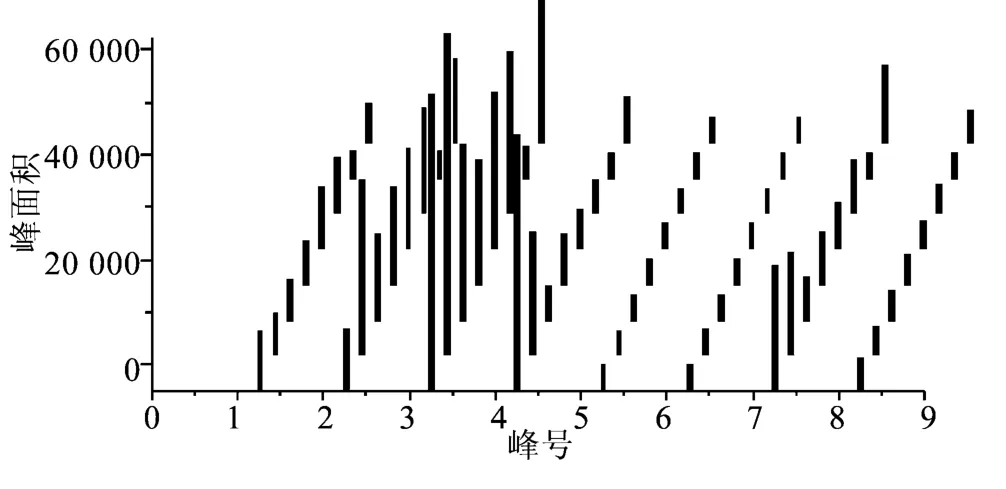
图3 马粪海胆抗氧化活性指纹图谱Fig.3 Antioxidant fingerprint of Hemicentrotus pulcherrimus
本研究以马粪海胆水提物中筛选到的9种抗氧化成分作为共有峰用于其指纹图谱研究。为提高样品间的可比性,降低色谱峰峰位变化的波动给保留值带来的偏移,我们将色谱图转化成稳定而易于比较的数据表,实现图谱的数据化,再以各抗氧化成分的峰号为横坐标,以相应峰的峰面积为纵坐标,做成柱状条形码图,更直观地表现海洋药用生物中各抗氧化成分的分布特征。本研究对在青岛沿岸采集的8批马粪海胆样品,以各抗氧化成分的EIC峰面积为指标,建立了基于其抗氧化活性成分的指纹图谱(见图3)。从图中可以看出,各批次马粪海胆样品水提物中抗氧化成分含量分布存在相似的特征,能够表现出马粪海胆样品的共有属性。
2.5 不同来源样品的相似度评价
本研究采用“中药色谱指纹图谱相似度评价系统”(2004A)计算青岛沿岸采集的8批马粪海胆和分别产自大连、烟台的马粪海胆样品的相似度,结果见表2。

表2 10批样品的相似度Table 2 Similarity analysis of 10 sets of samples
从表2可以看出,采用本文建立的基于DPPH-HPLC技术的离线抗氧化成分的指纹图谱对不同批次、不同来源的马粪海胆样品的相似度计算表明:8批采自青岛沿岸的马粪海胆样品具有较好的相似度,相似度均在0.90以上;而产自大连和烟台的两批马粪海胆样品的相似度较低,分别为0.78和0.84。说明本研究的基于DPPH-HPLC技术的离线抗氧化活性指纹图谱结合相似度分析,可以初步用于对不同来源的马粪海胆样品的正确区分。
3 结论
本研究初步探索了采用基于DPPH-HPLC技术的离线抗氧化活性指纹图谱对马粪海胆样品进行鉴别的可行性。结果表明,该方法结合相似度分析,可以实现对不同来源的马粪海胆样品的正确区分。本研究在一定程度上弥补了HPLC化学指纹图谱技术缺乏药效指标成分的不足,提高了指纹图谱的准确性和特征性,为海洋中药的质量控制和真伪鉴别研究提供了新方法、新思路。
[1]戚进,余伯阳.中药质量评价新模式——“谱效整合指纹谱”研究进展[J].中国天然药物,2010,8(3):171-176.
[2]蔡宝昌,潘扬,殷武.指纹图谱在中药研究中的应用[J].世界科学技术,2000,2(5):9-14.
[3]陶金华,狄留庆,文红梅,等.中药指纹图谱谱效相关性研究思路探讨[J].中国中药杂志,2009,34(18):2410-2413.
[4]韦娟.化学成分指纹图谱在中药材质量控制中的研究概况[J].中国现代药物应用,2009,3(13):194-195.
[5]李云飞,程翼宇,范骁辉.中药多维谱效关系研究思路探讨[J].中国天然药物,2010,8(3):167-170.
[6]李秋红,李廷利,黄莉莉,等.中药抗氧化的作用机理及评价方法研究进展[J].时珍国医国药,2008,l 9(5):1257-1258.
[7]傅博强.甘草中有效成分的分离纯化、结构鉴定、生物活性测定及活性指纹图谱研究[D].厦门:厦门大学,2005.
[8]DING X P,QI J,CHANG Y X,et al.Quality control of feavonoids in Ginkgo biloba leaves by high-performance liquid chromatography with diode array detection and on-line radical scavenging activity detection[J].Journal of Chromatography A,2009,1216(11):2204 -2210.
[9]DING X P,WANG X T,CHEN LL,et al.Quality and antioxidant activity detection of Crataegus leaves using on-line highperformance liquid chromatography with diode array detector coupled to chemiluminescence detection[J].Food Chemistry,2010,120(3),929–933.
[10]丁晓萍.基于抗氧化活性的生物活性和化学相关指纹的构建及其在中药质量评价研究中的应用[D].南京:中国药科大学,2009.
[11]CHANG Y X,DING X P,QI J,et al.Determination of phenolic acids in Danshen preparations by LC with chemiluminescence detection[J].Chromatographia,2009,69(3):319–323.
[12]CHANG YX,DING X P,QI J,et al.The antioxidant-activity-integrated fingerprint:an advantageous tool for the evaluation of quality of herbal medicines[J].Journal of Chromatography A,2008,1208(1):76 -82.
[13]CHANG Y X,YAN D M,CHEN L L,et al.Potency fingerprint of herbal products Danshen injection for their quality evaluation[J].Chemical and Pharmaceutical Bulletin,2009,57(6):586-590.
[14]SHUI G H,PENG L L.An improved method for the analysis of major antioxidants of Hibiscus esculentus Linn[J].Journal of Chromatography A,2004,1048(1):17-24.
[15]SHUI G H,LEONG L P,WONG S P.Rapid screening and characterization of antioxidants of Cosmos caudatus using liquid chromatography coupled with mass spectrometry[J].Journal of Chromatography B,2005,827(1):127 -138.
[16]TANG D,LI H J,CHEN J,et al.Rapid and simple method for screening of natural antioxidants from Chinese herb Flos Lonicerae Japonicae by DPPH-HPLC-DAD-TOF/MS[J].Journal of Separation Science,2008,31(20):3519 -3526.

