冬凌草甲素和survivin反义核苷酸对前列腺癌细胞作用的研究
李 进杨罗艳吴洪涛
1. 湘潭市中心医院泌尿外科(湖南湘潭 411100); 2. 中南大学湘雅二医院泌尿外科
冬凌草甲素和survivin反义核苷酸对前列腺癌细胞作用的研究
李 进1杨罗艳2吴洪涛2
1. 湘潭市中心医院泌尿外科(湖南湘潭 411100); 2. 中南大学湘雅二医院泌尿外科
目的探讨冬凌草甲素联合survivin反义核苷酸(反义链)对前列腺癌PC-3细胞株增殖和凋亡以及survivin mRNA和蛋白的影响。方法常规培养PC-3细胞,用四甲基偶氮唑盐法(MTT法)检测survivin反义链联合冬凌草甲素对PC-3细胞增殖的影响;流式细胞仪(FCM)检测PC-3细胞凋亡率;以CalcuSyn药效学软件计算联合指数(CI)评价survivin反义链联合凌草甲素对PC-3细胞的联合效应,并通过荧光定量PCR和Western blot方法检测PC-3细胞survivin基因和蛋白表达变化。结果survivin反义链转染PC-3细胞后,可以显著抑制PC-3细胞增殖,且能诱导PC-3细胞凋亡;冬凌草甲素联合survivin反义链对PC-3细胞增殖抑制率较两者单用组明显增强,显示出协同效应(Fa<0.8);冬凌草甲素和survivin反义链联用对PC-3细胞凋亡诱导作用更为显著(P<0.01);荧光定量PCR及Western blot显示反义链和冬凌草甲素均使survivin mRNA和蛋白表达下降,两者联合使survivin mRNA和蛋白表达下降更明显(P<0.01)。结论 survivin基因反义链和冬凌草甲素均能明显抑制PC-3增殖、诱导细胞凋亡和下调survivin基因和蛋白表达;两者联合作用有协同效应。
冬凌草素; 前列腺肿瘤; 细胞系, 肿瘤; 细胞增殖; 细胞凋亡
前列腺癌是一种严重影响老年人生活质量的恶性肿瘤,在西方发达国家其发病率及病死率分别位居男性恶性肿瘤的第2位及第6位[1]。随着我国人口老龄化、生活方式改变等因素,我国前列腺癌患病率呈逐年升高趋势。对激素、化疗和放疗不敏感是激素非依赖性前列腺癌治疗过程中面临的难题,因此,寻找新的治疗方法仍是当前研究的热点。冬凌草甲素(Oridonin)是从冬凌草等植物中提取出来的一种天然活性物质。近年来,冬凌草甲素在前列腺癌等多种肿瘤中显示出抗癌作用[2],我们先前的研究表明冬凌草甲素可诱导雄激素非依赖性前列腺癌PC-3细胞凋亡[3]。survivin(生存素)属于凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族中的新成员,在多种肿瘤组织中高表达,具有抗细胞凋亡的作用[4,5]。采用siRNA抑制survivin表达可减弱前列腺癌细胞恶性表型,可能为雄激素非依赖性前列腺癌的基因治疗提供了一种新方法[6]。我们研究脂质体LipofectamineTM Reagent介导survivin 反义链联合冬凌草甲素对PC-3细胞增殖、凋亡及survivin基因和蛋白表达的影响,为survivin 反义链联合冬凌草甲素治疗雄激素非依赖性前列腺癌提供一定的实验依据。
材料与方法
一、主要试剂和仪器
冬凌草甲素购自中国科学院昆明植物研究所,用二甲基亚砜(DMSO)(Sigma公司)配制成50mmol/L母液置-20℃,备用;MTT购自Sigma公司;survivin反义链、错配链(与反义寡核苷酸相同碱基组成、不同排列顺序)由上海生工生物工程公司合成,两端3个碱基经硫代修饰以对抗核酸酶的降解。反义链:5’-CCCAGCCTTCCAGCTCCTTG-3’;错配链:5’-GCCACTCCTCGA CTC TCG TC-3’。阳离子脂质体Lipofeetin购于Invitrogen公司。survivin上游引物5’-ACCGCATCTCTACATTCAAG-3’和下游引物5’-CTTTCTTCGCAGTTTCCTC-3’,β-actin上游引物5’- CTCCATCCTGGCCTCGCTGT -3’和下游引物5’- GCTGTCACCTTCACCGTTCC -3’由上海生工生物工程公司合成。兔抗人survivin抗体及HRP标记的二抗购于Santa Cruz公司,鼠抗人β-actin抗体购自Jackson-Immuno research公司。ECL试剂盒购自Amersham公司;Annexin V-FITC/PI凋亡试剂盒购自BECTON DICKINSON公司;MultiSkan Ascent酶标仪为芬兰Thermo公司产品;BD FACSCalibur型流式细胞仪为BECTON DICKINSON公司产品。Lamda Bio10型紫外分光光度计为美国Perkin Elmer公司产品;PAC200型电泳转膜系统及Mini-PROTEAN II 电泳槽为美国Bio-Rad公司产品。
二、细胞培养
PC-3细胞(南京凯基生物有限公司)养于含10%灭活新生牛血清的F12培养基(Gibco公司产品,加入L-谷氨酰胺、青霉素和链霉素)中,置于37℃,饱和湿度,5%CO2孵箱中常规培养。
三、分组和转染
取对数生长期的PC-3细胞,接种于25mL培养瓶,调整细胞浓度,使每瓶的细胞数为3×106,常规条件下培养24 h,显微镜下观察,约80 %融合时开始实验。设置空白对照组、脂质体转染对照组、错配链转染对照组和反义链转染组,每组设3 个复瓶。按Lipofectin 2000 转染试剂盒说明进行细胞转染,24后收集各组细胞并用于试验。
四、MTT法检测survivin反义链单独或联合冬凌草甲素对PC-3细胞增殖抑制率
取对数生长期的PC-3,加入96孔培养板中,分5组,每组6个平行孔。(1)空白对照组:只加PC-细胞作为对照;(2)错配链组:调整错配链的终浓度为0.4 pmol/L转染细胞;(3)反义链组:以相同浓度反义链转染细胞;(4)联合组(反义链+冬凌草甲素):反义链转染24h后的PC-3细胞中加入终浓度为10μmol/L冬凌草甲素;(5)冬凌草甲素组:终浓度为10μmol/L的冬凌草甲素。所有 PC-3细胞继续于37℃、5%CO2的培养箱中培养48h后,终止反应时加入10μL 5g/L MTT,37℃培养4 h中止,0.25%的胰酶消化收集细胞,每孔再加入200μL DMSO,震荡1 min。选择570nm波长,在酶联免疫检测仪上测定各孔吸光值(A)。按公式:抑制率(%)=(1-A实验/对照)×100%计算细胞生长抑制率
五、survivin反义核酸单独或联合冬凌草甲素对PC-3细胞株凋亡的影响
取对数生长期的PC-3,取2mL接种于6孔板,调整细胞浓度,使每孔的细胞数为3×105,分组同前,每组6个平行孔, 48h后用0.25%的胰酶消化收集细胞,加入Annexin V-FITC/PI,流式细胞仪上进行细胞凋亡检测(按试剂盒说明书进行操作)。
六、荧光定量PCR检测转染后PC-3细胞survivi的mRNA表达
取对数生长期的PC-3,接种于25mL培养瓶,调整细胞浓度,使每瓶的细胞数为3×106,分组同前,培养48h后收集细胞。取部分细胞用Trizol法提取总RNA,测RNA含量及纯度,采用逆转录试剂盒将mRNA逆转录为cDNA,合成的cDNA模板-20℃保存备用。使用SYBRGreen I荧光染料进行定量PCR反应。模板2μL,Survivin和β-actin上下游引物各1μL,与10μL混合染料混合,超纯水补足体积至20μL,混匀后放入PCR热循环仪中进行反应。软件自动进行数据分析,调整基线。计算出的Thresholdcycle(Ct值)以及各组survivin和β-actin Ct值的比值。
七、Western blot检测转染后PC-3细胞survivin蛋白表达
同时收集上述处理细胞,按蛋白质抽提、SDS聚丙烯酰胺凝胶电泳、抗体孵育和显色步骤进行Western印迹分析survivin蛋白表达。图像半定量灰度扫描仪计算出的survivin和β-actin的灰度值以及各组survivin和β-actin 灰度值的比值。
八、统计学方法
不同处理组Survivin的mRNA和蛋白、细胞生长抑制率、细胞凋亡率比较采用t检验统计法分析;各种统计图采用SPSS11.5 for windows及Microsoft Excel统计软件获得。以MTT法检测细胞抑制率并依据C1ou-Talalay中效原理以CalcuSyn药效学分析软件计算协同作用指数CI 值,评价联合作用效应,CI<l 时两药为协同作用,CI=1时为相加作用,CI>l 时为拮抗作用[7]。
结 果
一、MTT法检测PC-3细胞增殖
反义链组及冬凌草甲素组均可抑制PC-3细胞的增殖(P<0.05),而错配链组对PC-3细胞的增殖无抑制作用;反义链联合冬凌草甲素时对PC-3细胞的增殖抑制作用高于单用反义链组和冬凌草甲素组(P<0.01)(表1)。软件分析结果显示反义链联合冬凌草甲素的协同作用指数CI值<0.8,显示两者为协同效应。
二、流式细胞仪检测PC-3细胞凋亡
与对照组相比,反义链组、冬凌草甲素组和联合组均能诱导细胞凋亡(P<0.01),联合组较反义链组和冬凌草甲素组诱导细胞凋亡率增高,差异有统计学意义(P<0.01),(表1,图1)。
表1 各组细胞生长抑制率和凋亡率(±s)
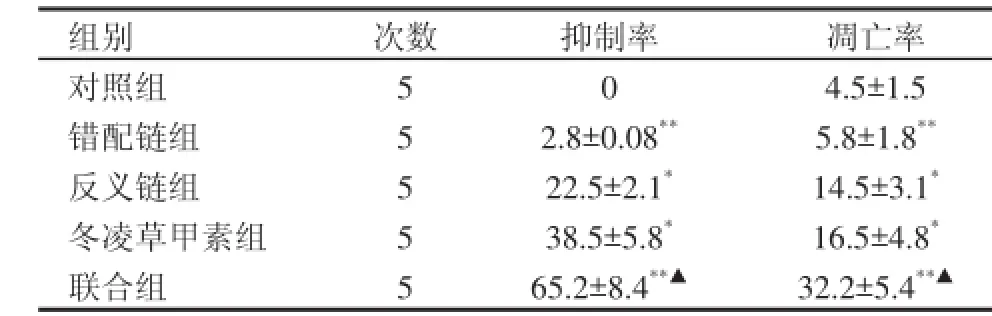
表1 各组细胞生长抑制率和凋亡率(±s)
注:与对照组比较,*为P<0.05;与反义链组比较,**为P<0.01;与冬凌草甲素组比较,▲为P<0.01
组别 次数 抑制率 凋亡率对照组 5 0 4.5±1.5错配链组 5 2.8±0.08**5.8±1.8**反义链组 5 22.5±2.1*14.5±3.1*冬凌草甲素组 5 38.5±5.8*16.5±4.8*联合组 5 65.2±8.4**▲32.2±5.4**▲
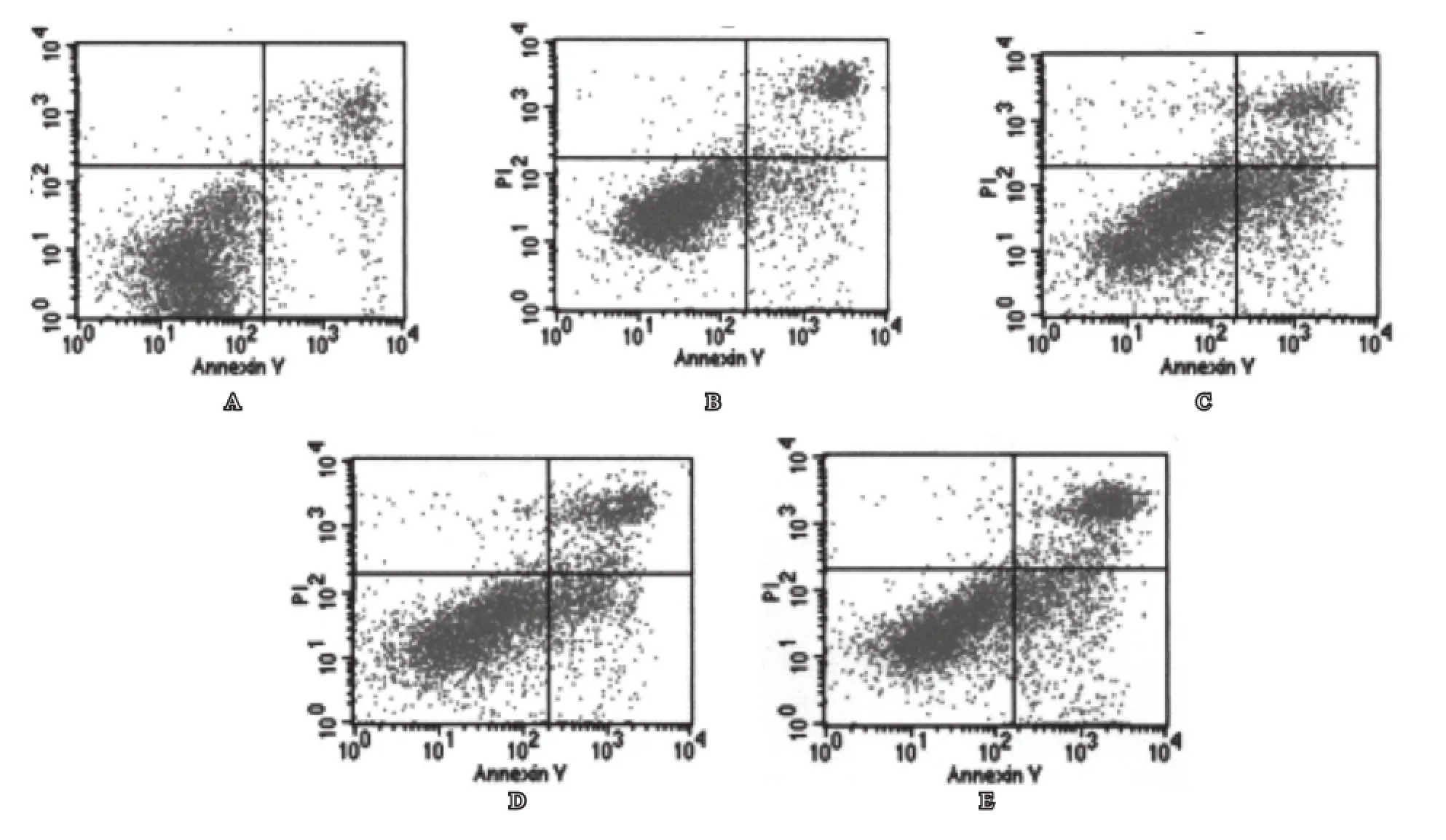
图1 Annexin V-FITC/PI 标记的PC-3细胞凋亡率检测(流式细胞仪)
三、荧光定量PCR检测survivin mRNA表达的影响
反义链组和冬凌草甲素组survivin mRNA水平较对照组及错配链组水平明显下降,差异有统计学意义(P<0.05),联合组较反义链组和冬凌草甲素组水平明显下降,差异有统计学意义(P<0.05)(图2)。
四、Survivin蛋白表达的影响
从Western blot印迹结果可以看出(图2、3),反义链组、冬凌草甲素组和联合组较对照组survivin蛋白水平明显下降,图像半定量扫描分析比较,差异有统计学意义(P<0.01)。联合组较反义链组和冬凌草甲素组水平也明显下降,差异有统计学意义(P<0.05)。
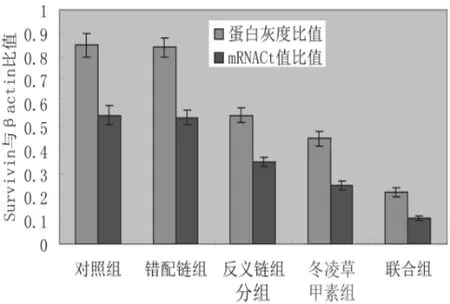
图2 各组PC-3细胞survivin mRNA和蛋白与β-actin比值结果
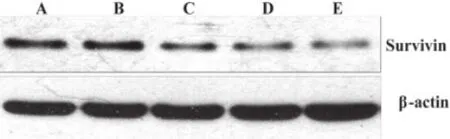
图3 各组PC-3细胞Survivin蛋白表达的Western blot印迹结果
讨 论
survivin是至今发现的作用最强的凋亡抑制因子,具有抑制凋亡和调节细胞分裂的双重功能,参与细胞增生、分裂、细胞周期及细胞凋亡的调控,与肿瘤的发生密切相关。survivin的高表达可以使肿瘤细胞免受各种凋亡信号的刺激而帮助细胞存活[8]。survivin表达水平下调可以直接调节肿瘤细胞自身凋亡,增加肿瘤细胞对化疗或放疗敏感性。研究发现p53蛋白和survivin形成一个复杂的信号网络,控制野生型p53-survivin的下游的途径,有助于控制肿瘤细胞增殖、存活和凋亡[9]。研究表明国人前列腺癌中均检测到survivin表达,且survivin高表达患者的生存率相对低表达患者明显降低,而复发率则升高,与前列腺癌患者预后密切相关[10]。Koike等[11]研究表明抑制survivin是治疗激素难治性前列腺癌的一种潜在治疗选择。临床试验表明冬凌草甲素对多种肿瘤细胞有明显的抑制或杀伤作用,有较强的抗菌消炎作用,毒副作用较小[12],Zhang等的研究显示冬凌草甲素纳米混悬剂在雄激素非依赖性前列腺癌的治疗中显示了巨大的潜力[13]。我们早期的研究也表明冬凌草甲素可诱导PC-3细胞凋亡[3]。
我们应用脂质体转染survivin反义核酸,作用于前列腺癌细胞系PC-3细胞,可诱导PC-3细胞凋亡、抑制细胞增殖,并使得survivin 的mRNA及蛋白表达明显下降,表明survivin 反义链能在转录和翻译水平上有效抑制survivin的表达。反义链组和冬凌草甲素联合组survivin蛋白和mRNA表达较反义链组和冬凌草甲素组水平明显下降,MTT法检测示反义链组、冬凌草甲素组PC-3细胞生长抑制率升高,反义链联合冬凌草甲素时表现出协同抑制PC-3细胞增殖作用。流式细胞仪检测示反义链组、冬凌草甲素组PC-3细胞凋亡率升高,反义链联合冬凌草甲素凋亡诱导作用增加,说明survivin反义链增加冬凌草甲素的诱导PC-细胞凋亡、抑制细胞增殖作用。
本实验survivin反义链联合冬凌草甲素作用PC-细胞对PC-3细胞诱导细胞凋亡、抑制细胞增殖具有协同作用,说明有效抑制PC-3细胞survivin基因的表达能增强冬凌草甲素对该细胞的增殖抑制和诱导凋亡作用。Pennati等[14]构建了表达靶向Survivin的核酶载体,转染前列腺癌细胞DU145、PC-3,稳定表达核酶的细胞较对照组survivin的表达量明显下降,并出现Caspase-9依赖的凋亡,survivin表达的下调还导致前列腺癌细胞对顺铂的增敏,抑制接种于裸鼠的前列腺癌细胞形成肿瘤。我们之前的研究显示冬凌草甲素可通过线粒体途径诱导PC-3细胞凋亡,因此,推测Survivin反义链和冬凌草甲素对前列腺癌细胞的协同作用可能是通过两个凋亡途径的共同通路实现。由于survivin在前列腺癌组织中表达,而在正常前列腺中未见表达,使得针对survivin的治疗具有良好的靶向性、特异性和安全性。反义技术治疗肿瘤从基因翻译和转录环节特异地阻断靶基因的表达。采用基因技术抑制survivin蛋白表达,可解除survivin对凋亡的抑制作用,诱导肿瘤细胞凋亡,达到治疗目的,而且由于其表达的特异性,survivin反义寡核苷酸不会诱导正常细胞凋亡。因此,以survivin为靶基因的前列腺癌治疗研究,为前列腺癌的基因治疗联合药物治疗开辟了新的途径。
1 Jemal A, Bray F, Center MM,et al. Global cancer statistics.CA Cancer J Clin2011; 61(2): 69-90
2 Chen JH, Wang SB, Chen DY,et al. The Inhibitory Effect of Oridoninon the Growth of Fifteen Human Cancer Cell Lines.Chin J Clin Oncol2007; 4(1): 16-20
3 李进, 杨罗艳, 吴洪涛. 冬凌草甲素诱导人雄激素非依赖性前列腺癌PC-3细胞凋亡及其机制. 中南大学学报·医学版 2011; 36 (8): 754-759
4 Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expression in cancer and lymphoma.Nat Med1997; 3(8): 917-921
5 Mesri M, Wall NR, Li J,et al. Cancer gene therapy using a survivin mutant adenovirus.J Clin Invest2001; 108(7): 981-990
6 Shen J, Liu J, Long Y,et al. Knockdown of survivin expression by siRNAs enhances chemosensitivity of prostate cancer cells and attenuates its tumorigenicity.Acta Biochim Biophys Sin (Shanghai)2009; 41(3): 223-230
7 Chou TC. Drug combination studies and their synergy quantification using the Chou-Talalay method.Cance Res2010; 70(2): 440-446
8 Mita AC, Mita MM, Nawrocki ST,et al.Survivin: key regulator of mitosis and apoptosis and novel target for cancer therapeutics.Clin Cancer Res2008; 14(16): 5000-5005
9 Shao Y, Liu Y, Shao C,et al. Enhanced tumor suppression in vitro and in vivo by co-expression of survivin-specif c siRNA and wild-type p53 protein.Cancer Gene Ther2010; 17(12): 844-854
10 刘陈黎, 刘春晓, 许凯, 等. Survivin蛋白在国人前列腺癌过表达临床意义的Meta分析. 医学临床研究 2012; 29(1): 15-18, 22
11 Koike H, Morikawa Y, Sekine Y,et al, Survivin is associated with cell proliferation and has a role in 1a 25-dihydroxyvitamin D3 induced cell growth inhibition in prostate cancer.J Urol2011; 185(4):1497-1503
12 刘淑云, 谭英姿, 范明松, 等. 冬凌草甲素研究进展. 中国当代医药 2012; 19(13): 17-18, 20
13 Zhang Z, Zhang X, Xue W,et al. Effects of oridonin nanosuspension on cell proliferation and apoptosis of human prostatic carcinoma PC-3 cell line.Int J Nanomedicine2010; 5: 735-742
14 Pennati M, Binda M, Colella G,et al. Ribozyme-mediated inhibition of survivin expression increases spontaneous and drug-induced apoptosis and decreases the tumorigenic potential of human prostate cancer cells.Oncogene2004 23(2): 386-394
(2014-04-18收稿)
Effects of survivin antisense oligodeoxynecleotides and Oridonin on PC-3 cells
Li Jin1, Yang Luoyan2, Wu Hongtao2
1. Department of Urology, the Central Hospital of Xiangtan, Xiangtan 411100, Hunan, China;
2. Department of Urology, the 2nd Xiangya Hospital, Central South University
Objective To explore the synergistic effects of survivin antisense oligonucleotides combined with Oridonin on growth, apoptosis, and the expression of survivin of PC-3 cells.MethodsHuman prostate carcinoma cells PC-3 on logarithmic growth phase were used in this study. The cell vitality was determined by MTT assay. The combination index (CI) was calculated using Pharmaconamics CalcuSynsoftware. The apoptotic rate was examined by f ow cytometer (FCM). The expression of survivin was detected by Western Blot and Real-time Fluorescent Quantitation-PCR.ResultsAfter transfection with antisense Survivin RNAi, the proliferation of PC-3 cells was inhibited markedly. An obvious apoptosis was found in the transfected PC-3 cells. The inhibitory effect of combined administration of survivin antisense and Oridonin on cell proliferation was much stronger than that of the single way (P<0.01). It showed that there was a synergistic effect (Fa<0.80). Western Blot and RT-PCR assays demonstrated that survivin antisense and Oridonin all inhibited the expression of survivin(P<0.01).ConclusionCombined survivin antisense and Oridonin significantly inhibits cell proliferation, induces cell apoptosis and down-regulates survivin expression in PC-3 cells, indicating that survivin antisense and Oridonin have a synergistic effect on PC-3 cells.
rubescensine; prostatic neoplasms; cell line,tumor; cell proliferation; apoptosis
10.3969/j.issn.1008-0848.2014.12.003
R 737.25

