不同疗效评价标准对结肠癌肝转移瘤疗效评价的一致性研究
石力夫,雷 振
辽宁医学院附属第一医院 放射科,辽宁锦州 121001
不同疗效评价标准对结肠癌肝转移瘤疗效评价的一致性研究
石力夫,雷 振
辽宁医学院附属第一医院 放射科,辽宁锦州 121001
目的探讨不同疗效评价标准对结肠癌肝脏转移瘤的疗效评价是否具有一致性。方法收集2010年12月- 2012年12月我院临床资料完整且手术病理证实的结肠癌肝脏转移瘤患者68例,治疗前2周内及治疗6周后分别行多层螺旋CT(multi-slice spiral computed tomography,MSCT)增强扫描,通过西门子软件半自动处理技术对病灶进行测量后用实体瘤疗效评价的WHO标准、RECIST1.0标准和RECIST1.1标准进行评估。结果通过Spearman相关性分析,WHO标准与RECIST1.0标准、WHO标准与RECIST1.1标准,RECIST1.0标准与RECIST1.1标准相关系数分别为0.834、0.827、0.843,P均<0.05。结论WHO标准、RECIST1.0标准和RECIST1.1标准具有较好的一致性,RECIST 1.1标准更适合对结肠癌肝脏转移瘤患者进行疗效评价。
实体瘤的疗效评价标准;多层螺旋CT;转移瘤
肝脏接受肝动脉和门静脉的双重血供,血流异常丰富,因此其他脏器的恶性肿瘤也易转移到肝脏[1]。尸检证实肝转移瘤中57%原发于胃肠道恶性肿瘤[2]。据相关资料统计,食管癌发生肝转移约占28%,胃癌发生肝转移占39.2%,结肠癌发生肝转移更为多见,晚期病人的肝转移率可达65%[3]。恶性肿瘤发生肝转移说明其病情已进展到晚期,大部分只能进行化疗和放疗,治疗效果的评价就成为临床治疗决策的总结与制定的重要前提[4]。针对恶性肿瘤的疗效评价问题,世界卫生组织及一些医疗机构和个人于1979年、2000年与2009年提出了WHO标准、RECIST1.0标准和RECIST1.1标准评价肿瘤疗效[5]。本研究采用回顾性研究方法,对结肠癌肝转移瘤的患者,用WHO标准、RECIST1.0标准与RECIST1.1标准进行疗效评价,分析它们是否具有一致性。
资料和方法
1 临床资料 收集2010年12月- 2012年12月在辽宁医学院附属第一医院的结肠癌肝脏转移瘤患者68例,其中男性42例,女性26例,年龄51 ~79(64±11.5)岁。纳入标准:结肠癌切除术经病理组织学或细胞学确诊的肝转移患者;从未接受过化疗或术后辅助化疗结束后复发或转移,距末次化疗超过6个月;位于接受过放射治疗区域的病灶不能作为可测量病灶[6];血液学、心脏、肝功能、肾基本正常;治疗前后的CT图像上至少有1个可测量病灶[7]。排除标准:仅有不可测量病灶如骨转移或胸腔积液、腹水为唯一观察指标者;试验期间对唯一的目标病灶进行放疗;脑、脑膜转移者;有严重未控制的内科疾病或急性感染者;对比剂及多种药物过敏者。
2 MSCT扫描方法 治疗前及治疗6周后对患者行Siemens definition AS+128 CT常规轴位平扫进行定位,高压注射器经静脉留置针连接左肘正中静脉注入碘对比剂行动态增强扫描。MSCT扫描范围自胸骨角上方1 cm至肛缘下方3 cm左右,保证全腹范围连续扫描。扫描参数:碘海醇(Inhexol 300 mgI/ml) 100 ml,团注法注射,流率3.0 ml/s,总剂量50 ml,动脉期延迟30 s,静脉期延迟70 s,平衡期延迟180 s,扫描层厚为5 mm,矩阵512×512,管电压120 kV,管电流250 mAs,螺距0.8 ~ 1,扫描视野12 ~ 16 cm。
3 病灶分类 1)可测量病灶:指病灶的最大径线CT测量≥10 mm[8]。2)非可测量病灶:指除可测量病灶外,所有其他病灶,包括小于可测量病灶所规定大小的病灶、骨病灶、脑膜病灶、腹水、胸腔积液等,影像学不能证实和评价的腹部肿块和囊性病灶。3)多发病灶:在RECIST1.0标准中其总量不能>10个,且每个脏器不能>5个[9];在RECIST1.1标准中其总量不能>5个,且每个脏器不能>2个[10]。4)非靶病灶:所有不可测量的病灶和未被选为靶病灶的可测量病灶[11]。
4 病灶测量 使用半自动测量软件Oncology测量治疗前后的两次图像数据,化疗前的原始图像数据在Siemens Syngo 2009B工作站进行储存,以备化疗后的病灶测量。
5 疗效评价 WHO标准依赖各个病灶长径与短径的乘积之和(面积之和)的变化率来计算[12],而RECIST1.0标准和RECIST1.1标准依赖各个病灶长径之和的变化率来计算[13]。并且要求肿瘤靶病灶变化的持续时间均大于4周。1)完全缓解(CR):即全部肿瘤靶病灶消失,RECIST1.1标准还要求任何病理性淋巴结(无论是否为目标病灶)的短轴值必须<10 mm。2)部分缓解(PR):WHO标准为肿瘤面积减少>50%,而RECIST1.0标准和RECIST1.1标准则分别为所有靶病灶长径总和及直径的总和减少≥30%。3)稳定(SD):WHO标准为肿瘤面积<50%或增加<25%,RECIST1.0标准为所有靶病灶长径总和减小<30%或增加<20%,RECIST1.1标准为肿瘤的变化既达不到缓减标准、也达不到恶化标准者。4)进展(PD):WHO标准为肿瘤面积增加>25%,或出现新的病灶。RECIS1.0标准为所有靶病灶长径总和增加>20%,或出现新的病灶,而RECIST1.1标准为所有靶病灶直径的总和增加≥20%,另外直径总和增加的绝对值还必须>5 mm,或出现新的病灶[14]。
6 统计学处理 采用SPSS17.0统计软件,进行Spearman等级相关分析,每组治疗前后比较采用两样本t检验,以P<0.05为差异有统计学意义。
结 果
1 可测量病灶数 68例共有208个可测量病灶,平均每例约3个;其中肝内转移灶182个,肿大淋巴结26个。
2 WHO标准与RECIST1.0标准比较 共62例(91.2%)疗效评价一致。通过Spearman相关性分析得出r = 0.834,P<0.05,两者具有较好的一致性。6例(8.8%)患者中的疗效评价不一致,RECSIT1.0标准对2例评价降低了等级,对4例提高了等级。见表1、表2。

表1 WHO标准、RECIST1.0标准、RECIST1.1标准疗效评价Tab. 1 Data according to WHO, RECIST1.0 and RECIST1.1 criteria
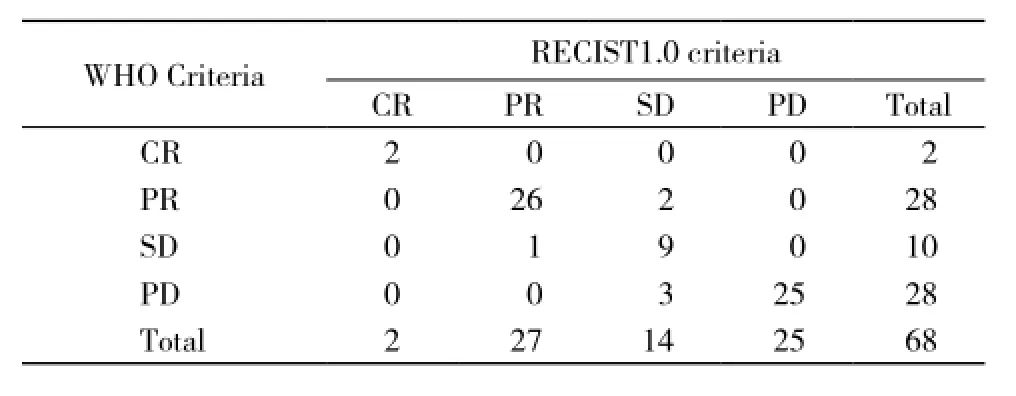
表2 WHO标准与RECIST1.0标准疗效评价比较Tab. 2 Curative effect assessment of tumor according to WHO and RECIST1.0 criteria
3 WHO标准与RECIST1.1标准比较 共60例(88.2%)疗效评价一致。通过Spearman相关性分析得出r = 0.827, P<0.05,两者具有较好的一致性。 8例(11.8%)疗效评价不一致,RECSIT1.1标准对2例评价降低了等级,对6例疗效评价提高了等级,见表3。
4 RECIST1.0标准与RECIST1.1标准比较 共66例(97.1%)疗效评价是一致的。通过Spearman相关性分析得出r = 0.843,P<0.05,两者具有较好的一致性。2例(2.9%)疗效评价不一致。RECIST1.1标准对2例疗效评价等级提高,见表4。
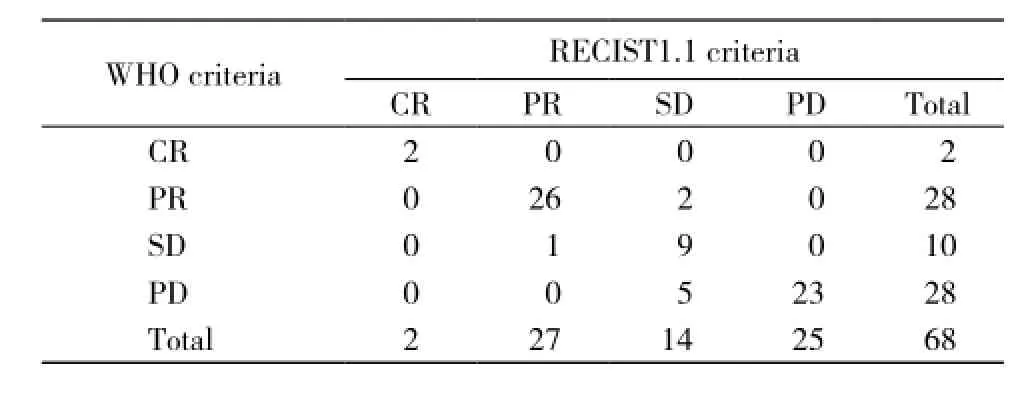
表3 WHO标准与RECIST1.1标准疗效评价比较Tab. 3 Curative effect assessment of tumor according to WHO and RECIST1.1 criteria
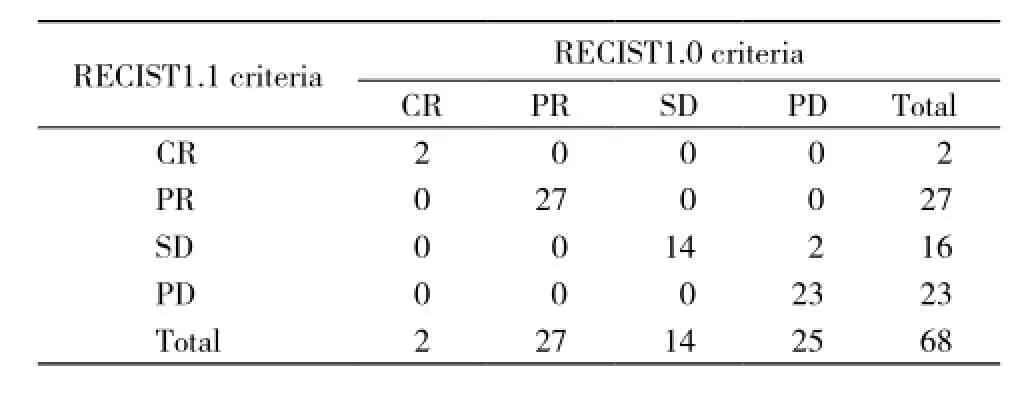
表4 RECIST1.0标准与RECIST1.1标准疗效评价比较Tab. 4 Curative effect assessment of tumor according to RECIST1.0 and RECIST1.1 criteria
讨 论
通过比较可以看出WHO标准、RECIST1.0标准与RECIST1.1标准有较好的一致性,但是这其中也有评定不一致的患者,特别是对PD的评定。有3例患者WHO标准评定为PD,而RECIST1.0标准与RECIST标准都评定为SD。这是因为在排除新病灶的情况下,WHO标准规定PD为病灶长短径的乘积增加25%以上,相当于病灶的体积增加了44%以上,而RECIST1.0标准与RECIST1.1标准都是规定PD为病灶的长径增加20%以上,相当于病灶的体积增加了73%以上。可见WHO标准容易对患者PD过高评价,即对患者的疗效评定为病情进展的机会较RECIST1.0标准与RECIST1.1标准大。欧洲癌症治疗与研究组织(EORTC)对13个二期或三期的肿瘤实验数据进行分析[14],分别用WHO标准与RECIST标准进行疗效评价,对于PD,在WHO评价标准中占31%,在RECIST评价标准中占29%,两者差异有统计学意义,说明RECIST评价标准对PD的判定更为严格。由于WHO标准比RECIST1.0标准和RECIST1.1标准容易对患者PD过高评价,会使一部分患者失去治疗机会,并且也影响临床新的抗肿瘤药的实验结果。由此可见RECIST1.0标准和RECIST1.1标准比WHO标准更适合对结肠癌肝转移瘤患者进行疗效评估。
RECIST1.1标准比RECIST1.0标准增加了对淋巴结的评价规定,在评定为CR病例中淋巴结小于1.0 cm即可,在评定为PR、SD、PD中,淋巴结跟其他靶病灶的规定一样,使临床医生能够更好地对患者的疗效做出评价。RECIST1.1标准还在评定为PD的患者中要求其病灶长径总和不仅要增加30%以上,而且病灶长径总和的绝对值要增加5 mm以上。这一规定是针对原病灶较小的患者,即使病灶轻微的增长,其长径增加的百分比也会增加很多,如果只规定其病灶长径增加30%以上就评定为PD,会使患者评定为病情进展的机会增大,使一部分患者失去治疗机会。
综上所述,WHO标准、RECIST1.0标准与RECIST1.1标准具有较好的一致性,RECIST1.1更适合对结肠癌肝脏转移瘤患者进行疗效评价。
1 Saad RS, Luckasevic TM, Noga CM, et al. Diagnostic value of HepPar1, pCEA, CD10, and CD34 expression in separating hepatocellular carcinoma from metastatic carcinoma in fine-needle aspiration cytology[J]. Diagn Cytopathol, 2004, 30(1): 1-6.
2 Kim YW, Ko YT, Kim NK, et al. A comparative study of protein expression in primary colorectal Cancer and synchronous hepatic metastases: the significance of matrix metalloproteinase-1 expression as a predictor of liver metastasis[J]. Scand J Gastroenterol, 2010,45(2): 217-225.
3 Wu Y, Brodt P, Sun H, et al. Insulin-like growth factor-I regulates the liver microenvironment in obese mice and promotes liver metastasis[J]. Cancer Res, 2010, 70(1): 57-67.
4 李自健,杨俊兰,焦顺昌,等.比较卡铂对乳腺癌细胞及血小板生成素作用下巨核细胞的影响[J].军医进修学院学报,2012,33(6):662-664.
5 Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline(version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
6 司海燕,王伟兰,戴广海.40 例消化系统神经内分泌癌的临床分析[J].军医进修学院学报,2013,34(3):214-216.
7 Dancey JE, Dodd LE, Ford R, et al. Recommendations for the assessment of progression in randomised Cancer treatment trials[J]. Eur J Cancer, 2009, 45(2): 281-289.
8 蒋朝霞,彭卫军,许玲辉,等. RECIST标准在乳腺癌转移治疗疗效评价中的应用与WHO标准比较[J]. 中国癌症杂志,2008,18(2):106-109.
9 Awad J, Owrangi A, Villemaire L, et al. Three-dimensional lung tumor segmentation from x-ray computed tomography using sparse field active models[J]. Med Phys, 2012, 39(2): 851-865.
10 朱学庆,张从军,钱勇,等.RECIST标准评价食管癌新辅助化疗疗效的可行性研究[J].安徽医药,2009,13(5):521-523.
11 冯晓波,刘玉林,陈宪,等.CT对原发性肝癌TACE疗效评价的mRECIST和RECIST对比研究[J].临床放射学杂志,2012,31(9):1334-1337.
12 Schwartz LH, Bogaerts J, Ford R, et al. Evaluation of lymph nodes with RECIST 1.1[J]. Eur J Cancer, 2009, 45(2): 261-267.
13 Bogaerts J, Ford R, Sargent D, et al. Individual patient data analysis to assess modifications to the RECIST criteria[J]. Eur J Cancer,2009, 45(2):248-260.
14 Gehan EA, Tefft MC. Will there be resistance to the RECIST(Response Evaluation Criteria in Solid Tumors)?[J]. J Natl Cancer Inst, 2000, 92(3):179-181.
Consistency between different curative effect assessment criteria for liver metastasis of colon cancer
SHI Li-fu, LEI Zhen
Department of Radiology, First Affliated Hospital of Liaoning Medical College, Jinzhou 121001, Liaoning Province, China
LEI Zhen. Email: Leizhen2004@163.com
ObjectiveTo study the consistency of different curative effect assessment criteria for liver metastasis of colon cancer.MethodsClinical data about 68 patients with surgery and biopsy-confirmed liver metastasis of colon cancer admitted to our hospital from 2010 to 2012 were retrospectively analyzed. The patients underwent enhanced multi-slice spiral CT scanning 2 weeks before and 6 weeks after treatment, respectively. The curative effect for solid tumor was assessed according to the WHO, RECIST1.0, and RECIST1.1 criteria using the Siemens software.ResultsSpearman correlation analysis showed that the coeffcient for the WHO and RECIST1.0 criteria, RECIST1.1 criteria, and RECIST1.1 criteria was 0.834, 0.827, and 0.843, respectively (P<0.05).Conclusion The consistency of WHO, RECIST1.0 and RECIST1.1 criteria is quite good. However, the RECIST1.1 criteria are more suitable for the curative effect assessment in patients with liver metastasis of colon cancer.
response evaluation criteria in solid tumor; multi-slice spiral computed tomography; metastases
R 445.3
A
2095-5227(2014)01-0025-03
10.3969/j.issn.2095-5227.2014.01.008
时间:2013-10-12 09:05
http://www.cnki.net/kcms/detail/11.3275.R.20131012.0905.001.html
2013-05-21
石力夫,男,本科,副主任医师。Email:jzslf@163.com
雷振,男,博士,教授,主任医师。Email: leizhen2004 @163.com

