柴贝止痫汤影响大鼠脑微血管内皮细胞乳腺癌耐药蛋白、核因子p65表达的研究
鄢泽然 张青 王潇慧 王越 聂莉媛 刘金民
难治性癫痫对多种抗癫痫药物交叉耐药,其可能的机制是血脑屏障上表达增加的多药转运体逆浓度梯度将抗癫痫药物分子泵出血脑屏障,降低病灶处的药物浓度,使药物疗效降低甚至失效,引起癫痫反复发作。长期使用抗癫痫药物和癫痫反复发作均可增加多药转运体的表达。抑制血脑屏障上多药转运体的表达可能提高难治性癫痫的疗效。
乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)属于三磷酸腺苷依赖性膜转运蛋白超家族成员,广泛分布在脑微血管、小肠、肝脏、胎盘等组织和器官中[1],与药物的吸收、分布和代谢有密切关系。脑微血管内皮细胞上过度表达的BCRP可降低透过血脑屏障的抗癫痫药物浓度。故在血脑屏障结构和功能完整的前提下,抑制BCRP 的表达可以增加抗癫痫药物在脑组织中的浓度,对难治性癫痫的治疗有重要意义。
柴贝止痫汤是刘金民教授在《医学心悟》“定痫丸”的基础上,继承、吸收王永炎院士临床经验化裁而成,全方由柴胡、浙贝母、法半夏、天麻、石菖蒲、牡蛎、地龙七味药物组成,主要功效是疏肝解郁,理气化痰,开窍定痫。临床应用发现,在抗癫痫药物治疗的基础上添加中药柴贝止痫汤可以抑制难治性癫痫患者的痫性发作,减少发作频次,减轻发作程度,其疗效优于单用抗癫痫药,因此推测其机制可能与二者协同增效有关。为探索柴贝止痫汤增敏抗癫痫药物的机制,本研究拟采用地塞米松孵育大鼠脑微血管内皮细胞建立BCRP 高表达模型,观察中药柴贝止痫汤对BCRP 及BCRP 可能的调节因子核因子κB(nuclear factor-kappa B,NF-κB)p65 表达的影响。
1 材料与方法
1.1 动物
每批原代脑微血管内皮细胞需要SPF 级雄性Wistar 大鼠5 只,体重60~80 g,购自军事医学科学院实验动物中心。动物许可证号:SCXK-(军)2012-0004;出笼单号:0000770、0001240。
1.2 主要试剂
DMEM 高糖培养基(Gibco,12100-038),胎牛血清(Gibco,10099-141),II 型胶原酶(Sigma,C6885),0.25%胰酶(含乙二胺四乙酸)(Sigma,T4049),L-谷氨酰胺(Sigma,G6392),噻唑蓝(methyl thiazolyl diphenyl-tetrazolium bromide,MTT)(Sigma,M5655),A 型明胶(Sigma,G2625),地塞米松(Sigma,D4902),肝素钠(北京索莱宝科技有限公司,H8060-1),胰岛素(Sigma,I5500),内皮细胞生长支持 物(Sigma,E2759);TRIzol 试剂(Invitrogen,15596-026);逆转录cDNA 试剂盒(Fermentas,K1622);Real-time PCR 预混荧光染料(TOYOBO,QPK-212)。
1.3 抗体及引物
兔抗VIII 因子抗体(Santa Cruz,sc-33584)、兔抗BCRP 抗体(Santa Cruz,sc-25822)、兔抗NF-κB p65 抗体(Santa Cruz,sc-372)、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)抗体(Santa Cruz,sc-25778)、辣根过氧化物酶(horseradish peroxidase,HRP)标记anti-Rabbit 抗体(Santa Cruz,sc-2004)。异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记anti-Rabbit 抗体(Sigma,F0382)。引物由生工生物工程(上海)股份有限公司合成。
1.4 受试药物
将地塞米松10 mg 溶于10 ml 无水乙醇,配制成1 mg/ml 浓储液,使用时按比例稀释成所需浓度。
柴贝止痫汤中药配方颗粒(柴胡12 g、天麻15 g、浙贝母9 g、法半夏9 g、石菖蒲9 g、牡蛎30 g、地龙6 g)购自北京康仁堂药业有限公司。称取10 g配方颗粒溶于100 ml D-Hank's 液中,煮沸后经定量滤纸过滤,烘干滤纸称重,扣除被滤过的药物质量,调节中药水溶液浓度为10 mg/ml,0.22 μm 滤器过滤后备用。
1.5 大鼠脑微血管内皮细胞的培养和鉴定
[2]所载方法,60~80 g Wistar 大鼠5 只,适应性饲养3 天后断头处死。75%的酒精浸泡头颅三次,超净台内取脑,D-Hanks 液清洗,在冲洗液(8%胎牛血清、100 U/ml 青霉素、100 U/ml 链霉素、0.2 U/ml 胰岛素、40 U/ml 肝素钠及DMEM高糖培养基组成)中去除肉眼可见的血管和软脑膜。分离大脑皮层灰质,在冲洗液中剪成1 mm3小块,研磨器研磨25 次(上下为1 次),研磨液用80 目(约178 μm)尼龙网筛过滤后再经200 目(约74 μm)网筛过滤。冲洗液冲洗200 目网筛上微血管段,洗液经1000 rpm 离心5 分钟后弃上清,加入0.2%II 型胶原酶4 ml,37℃消化25 分钟,1000 rpm离心5 分钟,弃上清;冲洗液清洗2 次后加入4 ml完全培养基(20% 胎牛血清、100 U/ml 青霉素、100 U/ml链霉素、0.2 U/ml 胰岛素、40 U/ml 肝素钠、75 μg/ml内皮细胞生长支持物、2 μmol/ml L-谷氨酰胺及DMEM 高糖培养基组成),滴管轻轻吹打均匀,接种于经2%明胶包被的25 cm2培养瓶中。静置3 天后第一次换液,以后每2 天换液1 次,7~10 天后细胞铺满培养瓶底的80%~90%,经0.125%胰酶-EDTA 消化30 秒后传代。传至第3 代时接种至12 孔板(预包被明胶)内爬片,接种密度为2 ×104/ml。待细胞铺满80%玻片后,80%冷丙酮固定10 分钟,0.3% Triton-X100 透膜20 分钟,2%山羊血清(Gibco,16210-064)室温封闭30 分钟,勿洗,滴加anti-VIII 因子一抗(1∶50 稀释)湿盒内4℃过夜,滴加FITC-anti-Rabbit 二抗(1∶30 稀释)37℃避光孵育30分钟,清洗后滴加10 μg/ml Hoechst33258(Sigma,B1155)避光室温孵育15 分钟,90%甘油封片,荧光显微镜(紫外光、蓝光)观察染色情况。经鉴定后的细胞用于实验,传代不超过第5 代。
1.6 地塞米松对脑微血管内皮细胞生长活力的影响
收集对数生长期的细胞,调整密度为4 ×104/ml接种至明胶包被的96 孔板,分设空白调零孔(无细胞)、地塞米松6 个浓度组(0 nmol/L、10 nmol/L、50 nmol/L、100 nmol/L、250 nmol/L、500 nmol/L),每组3 个复孔。待细胞爬满孔底80%时换用含相应浓度地塞米松的培养基培养24 小时。培养结束前4 小时加入MTT,培养结束后去除上清,加入二甲基亚砜,振荡10 分钟后酶标仪检测各孔490 nm 处的吸光值(OD)。比较各浓度组的OD490,选择对细胞生长活力影响较小的浓度进入下一步实验。
细胞存活率=[(OD浓度组-OD调零孔)/(OD0nmol/L-OD调零孔)]×100%
1.7 BCRP 高表达脑微血管内皮细胞模型的建立
按参考文献[3]所载方法和1.6 的结果,采用不同浓度的地塞米松作用脑微血管内皮细胞24 小时,观察各浓度作用下BCRP、NF-κB p65 的表达情况。选择诱导BCRP 高表达的浓度进入下一步实验。
1.8 Western blot 检测细胞BCRP 和NF-κB p65 的表达
调整细胞密度为1 ×105/ml 后接种至明胶包被的6 孔板,分设正常组、模型组及中药10 μg/ml、100 μg/ml、500 μg/ml、1 mg/ml 四个剂量组,每组3个复孔,经造模和药物干预后收集并裂解细胞,Bradford 法测定蛋白浓度,调节样本蛋白浓度为5 μg/μl,每孔上样12 μl 进行SDS-PAGE 电泳,转印蛋白至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶粉封闭,一抗4℃过夜(anti-BCRP 1∶50 稀释,anti-NF-κB p65 1∶50 稀释,anti-GAPDH 1∶1000 稀释),标记二抗(1∶5000 稀释),ECL 发光液显影。条带灰度值分析采用Image J软件。
1.9 Real time-PCR 检测细胞Bcrp mRNA 的表达
分组同前,总RNA 提取采用TRIzol 试剂,cDNA的合成采用Fermentas 公司逆转录试剂盒。PCR 反应体系(20 μl)配置:cDNA 模板1 μl,上、下游引物各1 μl,预混荧光染料10 μl,蒸馏水7 μl。BCRP 引物设计:Forward 5'-AGT CCG GAA AAC AGC TGA GA-3',Reverse 5'-CCC ATC ACA ACG TCA TCT TG-3';GAPDH 引物设计:Forward 5'-GTG CCA GCC TCG TCT CAT AG-3',Reverse 5'-CTT TGT CAC AAG AGA AGG CAG-3'。
1.10 观察柴贝止痫汤对细胞BCRP、NF-κB p65 表达的影响
比较中药各浓度组与模型组间BCRP、NF-κB p65 western blot 实验电泳条带灰度值的差异,说明柴贝止痫汤对BCRP、NF-κB p65 表达的影响;比较中药各浓度组与模型组间Bcrp mRNA 扩增的值,说明柴贝止痫汤对Bcrp mRNA 扩增的影响。
1.11 统计学方法
结果用SPSS 20.0 软件统计。平均值以(±s)表示,方差齐同各组间均数的比较采用One-Way ANOVA 分析,两两比较采用One-Way ANOVA-LSD分析;方差不齐时各组间均数比较采用非参数Kruskal-Wallis H 检验,两两比较采用One-Way ANOVA-Games-Howell 分析。设置双侧检验水准α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠脑微血管内皮细胞的培养和鉴定
传至第3 代时进行VIII 因子相关抗原免疫荧光鉴定,见图1。视野中90%以上的细胞质被染上黄绿色荧光,细胞核染上蓝色荧光(Hoechst 33258衬染),符合血管内皮细胞VIII 因子分布特点。阴性对照细胞胞质未见黄绿色光。

图1 第3 代大鼠脑微血管内皮细胞VIII 因子抗原免疫荧光鉴定
2.2 地塞米松对大鼠脑微血管内皮细胞活力的影响
地塞米松6 个浓度(0 nmol/L、10 nmol/L、50 nmol/L、100 nmol/L、250 nmol/L、500 nmol/L)作用细胞24 小时后的细胞活力测定结果见表1。经Kruskal-Wallis H 检验,组间比较具有显著性差异(χ2=33.115,P=0.000);经One-Way ANOVAGames-Howell 分析,10 nmol/L 以上浓度孵育大鼠脑微血管内皮细胞24 小时后,细胞的生长活力较0 nmol/L 组下降(P<0.05),其中10 nmol/L、100 nmol/L、250 nmol/L 三个浓度对细胞生长活力影响较小,存活率在70%以上。
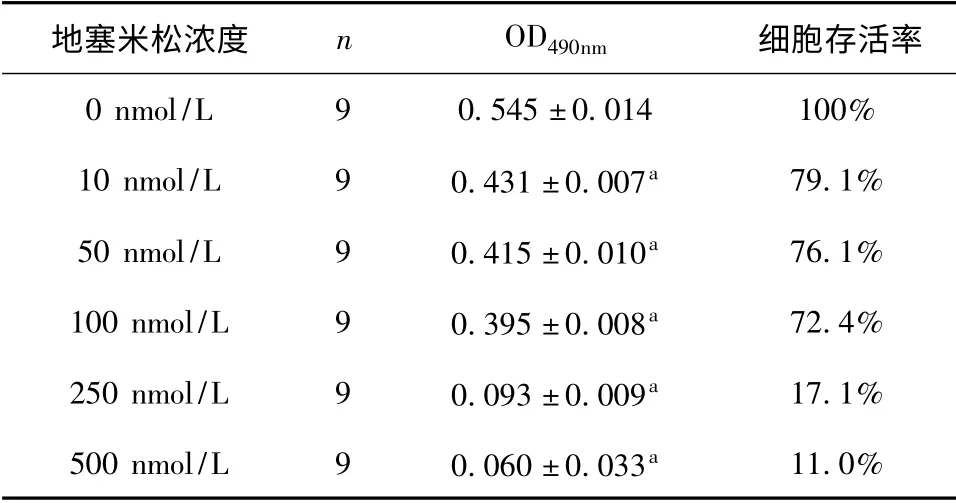
表1 地塞米松对细胞活力的影响(MTT 法)
2.3 地塞米松对大鼠脑微血管内皮细胞BCRP、NF-κB p65 表达的影响
选取地塞米松对细胞活力影响较小的三个浓度(10 nmol/L、50 nmol/L、100 nmol/L)孵育细胞24小时,比较地塞米松各浓度组BCRP、NF-κB p65 表达的情况(见图2)。经Kruskal-Wallis H 检验,各浓度组间BCRP 表达有差异(χ2=8.641,P=0.034),经One-Way ANOVA-Games-Howell 分析,50 nmol/L、100 nmol/L 浓度作用24 小时后BCRP 的表达较0 nmol/L组升高(P 值分别为0.043 和0.000)。经One-Way ANOVA-LSD 分析,NF-κB p65 的表达较0 nmol/L组降低(P 值分别为0.036 和0.039)。50 nmol/L与100 nmol/L 组间BCRP、NF-κB p65 的表达未见显著差异(见表2)。为方便配制,后续实验选用100 nmol/L 地塞米松作为干预浓度。
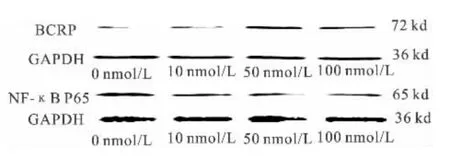
图2 不同浓度地塞米松孵育细胞24 小时后BCRP、NF-κB p65 表达的Western blot 电泳条带

表2 不同浓度地塞米松影响细胞BCRP、NF-κB p65 表达的情况
2.4 柴贝止痫汤对模型细胞BCRP、NF-κB p65 表达的影响
大鼠脑微血管内皮细胞经100 nmol/L 地塞米松孵育24 小时后,分别用柴贝止痫汤四个浓度梯度(10 μg/ml、100 μg/ml、500 μg/ml、1 mg/ml)干预24小时。组间方差齐同,经One-Way ANOVA-LSD 分析显示,10 μg/ml、100 μg/ml 组细胞BCRP 的表达较模型组降低(对应P 值分别为0.014 和0.043),1 mg/ml浓度组细胞NF-κB p65 的表达较模型组降低(P=0.021)。(见图3和表3)

图3 不同浓度柴贝止痫汤干预模型细胞24 小时后BCRP、NF-κB p65 表达的Western blot 电泳条带
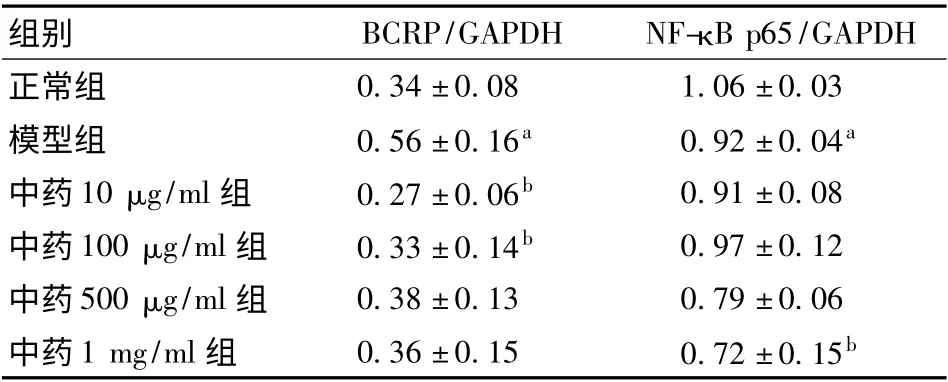
表3 不同浓度柴贝止痫汤影响模型细胞BCRP、NF-κB p65 表达的情况
2.5 柴贝止痫汤对模型细胞Bcrp mRNA 表达的调节作用
各组间方差齐同,经One-Way ANOVA-LSD 分析,模型组细胞Bcrp mRNA 的表达较正常组升高(P=0.000),正常组的表达仅为模型组的0.23 倍。柴贝止痫汤10 μg/ml、100 μg/ml 两个浓度组Bcrp mRNA 的表达均较模型组降低(P 值均为0.000),分别为模型组的0.36 倍和0.29 倍。(见表4)
3 讨论
BCRP 与癫痫、肿瘤、溃疡性结肠炎等多种疾病的药物转运有关[4-6],是继P 糖蛋白之后发现的又一经典多药转运体。血脑屏障上的BCRP 参与了动物颅内苯巴比妥、唑尼沙胺、加巴喷汀、噻加宾和左乙拉西坦的转运[7],抑制BCRP 的表达可能增加动物颅内抗癫痫药物浓度而提高难治性癫痫的疗效。本研究前期工作发现,柴贝止痫汤可以降低大鼠脑内P 糖蛋白的表达,离体实验亦观察到柴贝止痫汤可下调经谷氨酸诱导的大鼠脑微血管内皮细胞P糖蛋白表达。基于中药多靶点的疗效机制,本研究探索了柴贝止痫汤对大鼠脑微血管内皮细胞BCRP表达的影响,发现柴贝止痫汤可抑制地塞米松诱导的BCRP 及Bcrp mRNA 表达。
单一培养的脑微血管内皮细胞能够较好地保持在体特征,细胞间可以形成丰富的紧密连接、具有极少的胞饮囊泡和窗孔结构、拥有大量线粒体和丰富的跨膜转运蛋白[8],可以作为血脑屏障的单细胞体外模型。地塞米松作为孕烷X 受体的一种配体[9],可直接激活孕烷X 受体信号通路上调BCRP的表达[3]。因此,本研究在培养正常大鼠脑微血管内皮细胞的基础上,采用地塞米松孵育,模拟难治性癫痫血脑屏障上BCRP 的高表达,进而观察柴贝止痫汤对BCRP 表达的调节作用。
在某些肿瘤细胞中,促炎性细胞因子可以通过激活孕烷X 受体而上调BCRP 的表达,增加BCRP的转运活性,处于炎症因子信号通路下游的NF-κB表达和活性也相应增加,提示孕烷X 受体、BCRP、NFκB 三者间可能存在相关性[10-11],而NF-κB 等炎症因子的活化已被证实在难治性癫痫的病理过程中具有重要作用[12]。因此,本研究在观察中药柴贝止痫汤影响BCRP 表达的同时也探索了对炎症因子NF-κB p65 表达的影响,发现经中药柴贝止痫汤高剂量(1 mg/ml)干预后的细胞NF-κB p65 表达较模型组下调。

表4 Bcrp mRNA 的表达情况(相对定量法)
相关研究认为BCRP 和NF-κB 的活化可能是疾病预后不良的标志[13-14]。柴贝止痫汤可以通过下调BCRP 和NF-κB 的表达来改善难治性癫痫的预后。药物入胃,由胃运化为精微物质后随气、血、津、液的运行布散到全身。若先天肾气和/或后天脾气不足,气、血、津、液运行不畅,出现气郁、血瘀、痰凝,可阻碍药物运化及在脑内的正常敷布。癫痫久治不愈、反复发作,往往引起气、瘀、痰的相互搏结而不易根除,更加阻碍药物转运入脑。柴贝止痫汤中柴胡疏肝理气,浙贝母、半夏合用可化难治之痰,地龙活血化瘀,石菖蒲引药入脑,天麻、牡蛎平肝熄风定痫,全方与抗癫痫药物合用,可通过改善气滞、血瘀和痰凝来增进药物在脑内的分布,进而改善难治性癫痫的预后。
参 考 文 献
[1]Mao QC,Unadkat JD.Role of the breast cancer resistance protein (ABCG2)in drug transport[J].The AAPS Journal,2005,7(1):E118-133.
[2]李卫红,青雪梅,华茜,等.大鼠脑微血管内皮细胞条件培养液对皮层神经元活性的影响以及通络救脑注射液的干预作用[J].中华中医药杂志,2006,21(6):334-337.
[3]Narang VS,Fraga C,Kumar N,et al.Dexamethasone increases expression and activity of multidrug resistance transporters at the rat blood-brain barrier[J].Am J Physiol Cell Physiol,2008,295(2):C440-C450.
[4]Sukowati CHC,Rosso N,Pascut D,et al.Gene and functional up-regulation of the BCRP/ABCG2 transporter in hepatocellular carcinoma[J].BMC Gastroenterology,2012,12:160.
[5]Liu JYW,Thom M,Catarino CB,et al.Neuropathology of the blood-brain barrier and pharmaco-resistance in human epilepsy[J].Brain,2012,135(10):3115-3133.
[6]Englund G,Jacobson A,Rorsman F,et al.Efflux transporters in ulcerative colitis:decreased expression of BCRP(ABCG2)and Pgp(ABCB1)[J].Inflamm Bowel Dis,2007,13 (3):291-297.
[7]Nakanishi H,Yonezawa A,Matsubara K,et al.Impact of P-glycoprotein and breast cancer resistance protein on the brain distribution of antiepileptic drugs in knockout mouse models[J].European Journal of Pharmacology,2013,710(1-3):20-28.
[8]赵康峰,王翀,孔建,等.不同血脑屏障模型的建立及其功能特点[J].环境与健康杂志,2012,29(2):127-130.
[9]Bauer B,Hartz AMS,Fricker G,et al.Pregnane X receptor upregulation of P-glycoptrotein expression and transport function at the blood-brain barrier[J].Mol Pharmacol,2004,66(3):413-419.
[10]Malekshah OM,Lage H,Bahrami AR,et al.PXR and NF-κB correlate with the inducing effects of IL-1β and TNF-α on ABCG2 expression in breast cancer cell lines[J].European Journal of Pharmaceutical Sciences,2012,47(2):474-480.
[11]Mosaffa F,Kalalinia F,Lage H,et al.Pro-inflammatory cytokines interleukin-1β,interleukin6 and tumor necrosis factor-α alter the expression of ABCG2 in cervix and gastric cancer cells[J].Mol Cell Biochem,2012,363(1-2):385-393.
[12]Das A,Wallace IV GC,Holmes C,et al.Hippocampal tissue of patients with refractory temporal lobe epilepsy is associated with astrocyte activation,inflammation,and altered expression of channels and receptors[J].Neuroscience,2012,220:237-246.
[13]Lzzo JG,Wu X,Wu TT,et al.Therapy-induced expression of NF-kappa B portends poor prognosis in patients with localized esophageal cancer undergoing preoperative chemo-radiation[J].Dis Esophagus,2009,22(2):127-132.
[14]Lee SH,Kim H,Hwang JH,et al.Breast cancer resistance protein expression is associated with early recurrence and decreased survival in resectable pancreatic cancer patients[J].Pathology International,2012,62(3):167-175.

