电解金属锰渣中重金属的固化新技术
李昌新,钟 宏,王 帅,薛建荣,张振宇
(中南大学 化学化工学院,湖南 长沙 410083)
0 前 言
电解金属锰(以下简称:电解锰)渣是碳酸锰矿粉或者氧化锰矿粉经酸浸或还原浸出后产生的浸出渣。目前,我国电解锰产量占世界电解锰产量的98%以上,已成为世界上最大的电解锰生产、消费和出口大国[1-2]。每生产1 t电解锰粉所排放的电解锰渣量约为5~8 t,随着电解锰行业的快速发展和矿石品位的降低,导致产生锰渣的量逐渐增大[3-4]。国内电解锰企业一般是把锰渣筑坝堆存,但是锰渣中大多含有大量的Mn、Cu、Zn、Cr、Pb、As和Co等有害重金属[5-7]。如果不能有效的将锰渣中的重金属固定,在长期风化淋溶作用下,锰渣中重金属对周边的土壤、地表水、地下水体系有巨大的潜在危害[8-9]。课题组的前期研究也表明,电解锰渣中的重金属含量较高,对环境存在着潜在风险,因此有必要研究电解锰渣中重金属的固化新技术[10]。
对于重金属的固定,国内外学者已经做了很多相关研究,固化方法主要包括水泥固化、石灰固化、塑性材料包容固化、熔融固化、自胶结固化和药剂稳定化等[11]。但这些方法都存在其固有的缺点与局限性,如在水泥固化中,废渣里存在的某些抑制盐会阻止其水化过程,造成固化体破裂,影响固定效果[12]。另外,当固化体在环境中破裂后,废物中的有毒物质会重新进入环境。而药剂稳定化中,化学药剂的成本和运行费用均较高,不利于大规模的应用。
本文以湖南湘西某电解锰厂生产电解锰过程中产生的废渣为原料,在分析其浸出特性的基础上,采用硫酸钙为原料,通过热解还原制备硫化钙焙砂,将硫化钙焙砂用于固化锰渣中的重金属。该工艺实现了重金属废渣无害化和资源化的双重目的,有望发展出经济实用的重金属固化技术。
1 实验部分
1.1 实验原料
实验中所用电解锰渣产自湖南湘西某电解锰厂,外观偏黑,将锰渣烘干后粉碎并混合均匀,过0.297 mm(50目)筛备用。煤炭产自甘肃,其主要的理化性质如表1所示。无水硫酸钙购自阿拉丁试剂有限公司,为分析纯试剂。固化剂硫化钙焙砂的制备采用高温热分解的方法,将硫酸钙与煤粉按碳硫摩尔比3∶1混合后,置于马弗炉中,于900℃下反应2.0 h后,所得固体产物即为硫化钙焙砂,且硫化钙纯度高达94.93%。

表1 煤炭的理化性质(质量分数)/%
1.2 电解锰渣固化实验方法
将一定量的锰渣置于250 mL三口烧瓶中,加水调浆后,加入相应量的硫化钙,在搅拌条件下于室温下反应一段时间后,过滤,分别得到滤液和滤渣,滤液中重金属含量以ICP-AES测定,滤渣即为固化后的电解锰渣(以下简称:固化渣)。固化渣在烘干后,参照《固体废物浸出毒性浸出方法——水平振荡法》(HJ 557-2010)的方法进行浸出毒性测定,浸出液采用电感耦合等离子体发射光谱仪(ICP-AES)分析。
2 结果与讨论
2.1 电解锰渣中重金属含量与矿物组成
电解锰渣参照《土壤质量铅、铬的测定》(GB/T 17141-1997)消解后,消解液以ICP-AES测定重金属含量。电解锰渣中锰、钴、铅、铬、砷、铜、锌的总量见表2。

表2 电解锰渣中重金属总量分析 mg/kg
电解锰渣矿物组成由XRD测定,结果如图1所示。
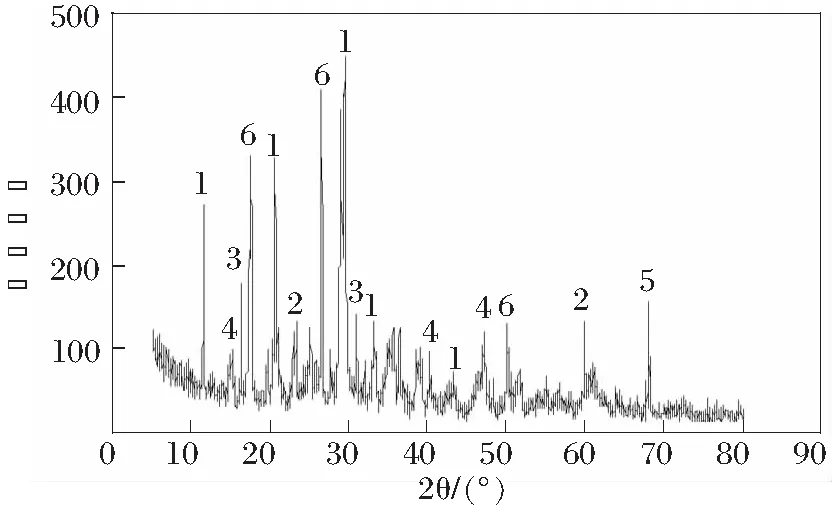
1 CaSO4·2H2O;2 SiO2;3 NaAl3(PO4)2(OH)4;4 BaAl3(PO4)(PO3(OH))(OH)6;5 (Mn.Al)3(Si.Al)2O5(OH)4;6 MnSO4·4H2O
由图1可知,锰渣的物相构成非常的复杂,主要物相为石英(SiO2)和石膏(CaSO4·2H2O);重金属除Mn外,都是以非晶态形式存在。
2.2 电解锰渣的浸出毒性
固体废物的浸出毒性是判别废物是否有害的重要判据,按照HJ 557-2010的浸出方法,测出锰渣的浸出毒性,结果如表3所列。

表3 电解锰渣中重金属浸出毒性结果 mg/L
注:a危险废物鉴别标准——浸出毒性鉴别(GB 5085.3-2007);b地表水环境质量标准(GB 3838-2002);NS表示未限制;ND表示未检出(检测限:1 ug/L)。
从表3中可以看出,由于《危险废物鉴别标准——浸出毒性鉴别》(GB 5085.3-2007)中未对浸出液中Mn、Co、Fe浓度限制,所以参照《危险废物鉴别标准——浸出毒性鉴别》(GB 5085.3-2007)中的相关限值,可以判定电解锰渣不具有浸出毒性,不属于危险废物。但浸出液中Mn、Pb、As、Zn浓度均大于《地表水环境质量标准》(GB 3838-2002)中的相关法定阈值,其中Mn浸出浓度是限值的3 596倍,远远超标,因此电解锰渣对生态环境潜在危害风险大,一旦锰渣堆场管理不善,锰渣中的重金属将会对周围水体及土壤造成严重污染。所以本文中,以更为严苛的《地表水环境质量标准》(GB 3838-2002)中的相关法定阈值为指标,来评判固化效果。
2.3 电解锰渣的固化工艺研究
2.3.1 固化剂用量的影响
固化剂硫化钙焙砂的用量(mCaS:m电锰渣)是影响重金属固化的重要指标[13]。本研究考察了在固化时间3.0 h,固化温度30℃时,硫化钙用量在5%~25%范围内对重金属的固定效果,固化过程滤液的性质见图2和表4。
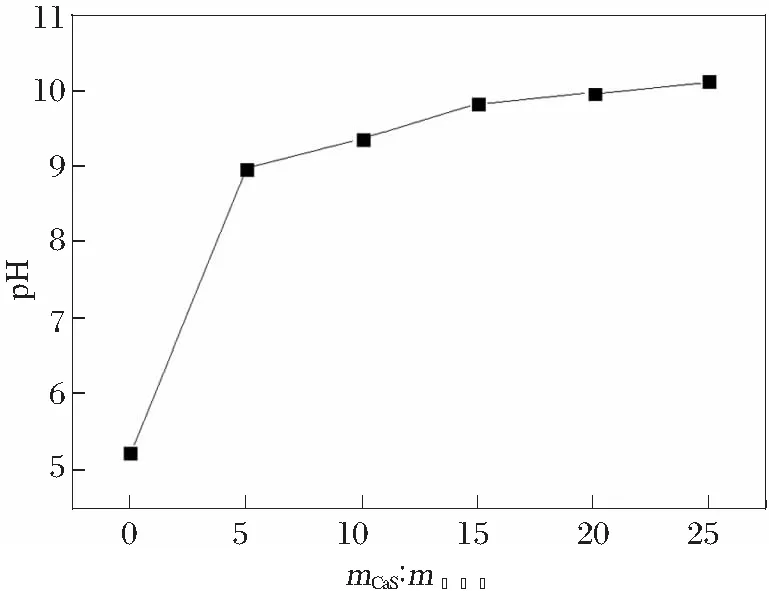
图2 硫化钙用量对滤液pH的影响
从图2中可以看出,随着硫化钙用量加大,滤液的pH不断升高,而大部分金属氢氧化物在pH值7.5~11之间有最小的溶解度,有利于电解锰渣中重金属固化[14-15]。

表4 硫化钙用量对滤液中重金属含量的影响
从表4中也可以看出,随着硫化钙的加入,滤液中重金属含量急剧降低,当硫化钙用量为15%时,滤液中除了Zn、Fe外,其他重金属均未检出,滤液中重金属浓度远低于《地表水环境质量标准》(GB3838-2002)中相关重金属浓度限值。因此,在固化过程中产生的回水可以返回重复利用,以实现固化过程的水平衡。
表5为在不同硫化钙用量条件下,固化渣的浸出毒性数据。

表5 硫化钙用量对固化渣浸出毒性的影响
由表5中可以看出,硫化钙能够有效的将电解锰渣中的重金属固定,随着硫化钙在用量从5%增至15%时,浸出液中的重金属浓度明显降低,当硫化钙用量为15%时,浸出液中重金属浓度远低于《地表水环境质量标准》(GB3838-2002)中相关重金属浓度限值。但是在硫化钙用量在15%以上时,继续增大用量,浸出液中重金属浓度变化不大,这是因为电解锰渣中的重金属总量是一定的。因此综合考虑处理成本和浸出毒性,选用硫化钙的用量为15%。
2.3.2 固化时间的影响
在硫化钙用量为15%,固化温度30℃的条件下,考察了固化时间对固定效果的影响。不同固化时间下,固化过程中的滤液性质见图3和表6。
从图3可知,随着固化时间的延长,滤液的碱性逐渐增强,固化时间在4.0 h时,滤液的pH值仍然不超过10.0,符合堆场要求。

图3 固化时间对滤液pH的影响
同时,从表6中可以看出,在较短的时间下就能达到很好的固定效果,当固化时间由0.5 h增至1.0 h时,滤液中各个重金属的浓度便大幅下降,Mn浓度由199.9 mg/L下降为0.40 mg/L,Fe浓度则由1.268 mg/L下降为0.04 mg/L。继续增加固化时间,对滤液中重金属离子浓度影响不大。
不同固化时间下,固化渣的浸出毒性如表7所示。
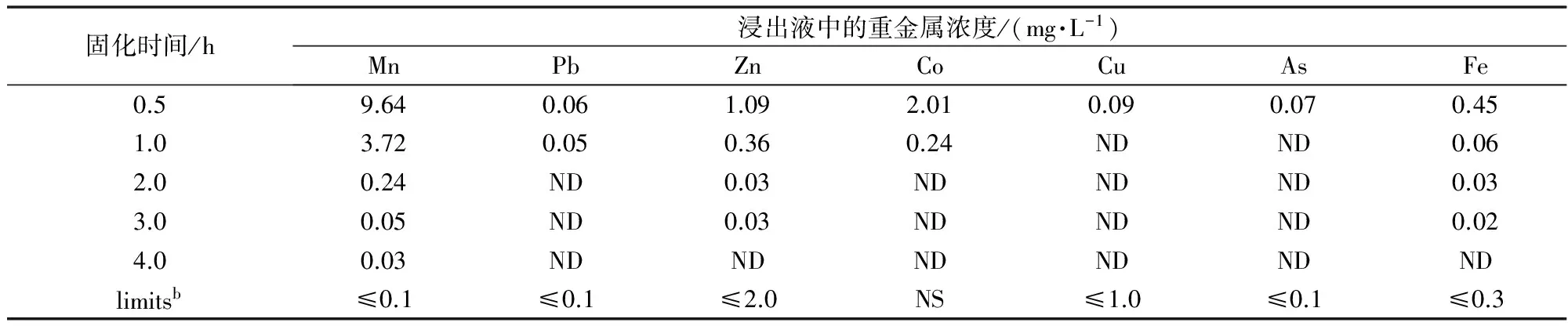
表7 固化时间对固化渣浸出毒性的影响
由表7可知,硫化钙焙砂固化锰渣中重金属需要一定的反应时间。当固化时间从0.5 h增至3.0 h时,固化渣浸出毒性大大降低,且浸出液中重金属浓度低于《地表水环境质量标准》(GB3838-2002)中的相关阈值,此后随着固化时间增加,固化效果有所加强,但是幅度非常小。因此,从固化处理过程效率的角度出发,选择固化时间为3.0 h。
3 结 论
通过对电解锰渣的理化特性、浸出行为及固化工艺的系统研究,可以得到以下结论。
1) 电解锰渣中重金属含量很高,物相组成复杂,主要物相为石英(SiO2)和石膏(CaSO4·2H2O);重金属除Mn外,都是以非晶态形式存在。
2) 参照《危险废物鉴别标准——浸出毒性鉴别》(GB 5085.3-2007)中的相关限值,可以判定电解锰渣不具有浸出毒性,不属于危险废物。但浸出液中Mn、Pb、As、Zn浓度均大于《地表水环境质量标准》(GB 3838-2002)中的相关法定阈值,因此电解锰渣对堆场周边环境存在潜在生态危害。
3) 当硫化钙焙砂用量为电解锰渣质量的15%,固化反应时间为3.0 h时,固化后电解锰渣的浸出毒性符合相关国家标准,其中Mn浓度0.05 mg/L,Fe浓度0.02 mg/L,其他重金属未被检出。
参考文献:
[1] 刘唐猛, 钟宏, 尹兴荣, 等. 电解金属锰渣的资源化利用研究进展[J]. 中国锰业, 2012, 30(1): 1-6.
[2] 李坦平, 周学忠, 曾利群, 等. 电解锰渣的理化特征及其开发应用的研究[J]. 中国锰业, 2006, 24(2): 13-16.
[3] Hagelstein K. Globally sustainable manganese metal production and use[J]. Journal of Environmental Management, 2009, 90(12): 3736-3740.
[4] Duan N, Dan Z, Wang F, et al. Electrolytic manganese metal industry experience based China’s new model for cleaner production promotion[J]. Journal of Cleaner Production, 2011, 19(17): 2082-2087.
[5] Hu N, Zheng J F, Ding D X, et al. Metal pollution in Huayuan river in Hunan province in China by manganese sulphate waste residue[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 83(4): 583-590.
[6] Duan N, Fan W, Changbo Z, et al. Analysis of pollution materials generated from electrolyticmanganese industries in China[J]. Resources, Conservation and Recycling, 2010, 54(8): 506-511.
[7] Canuto F A B, Garcia C A B, Alves J P H, et al. Mobility and ecological risk assessment of trace metals in polluted estuarine sediments using a sequential extraction scheme[J]. Environmental Monitoring and Assessment, 2013, 185(7): 6173-6185.
[8] Sundaray S K, Nayak B B, Lin S, et al. Geochemical speciation and risk assessment of heavy metals in the river estuarine
sediments—a case study: Mahanadi basin, India[J]. Journal of Hazardous Materials, 2011, 186(2): 1837-1846.
[9] Horng C J, Horng P H, Lin S C, et al. Determination of urinary beryllium, arsenic, and selenium in steel production workers[J]. Biological Trace Element Research, 2002, 88(3): 235-246.
[10] Li C X, Zhong H, Wang S, et al. Leaching behavior and risk assessment of heavy metals in a landfill of electrolytic manganese residue in western Hunan, China[J]. Human and Ecological Risk Assessment, 2014, 20(5): 1249-1263.
[11] 蒋建国.固体废物处理处置工程[M].北京:化学工业出版社,2005:110-127.
[12] 汪莉, 柴立元, 闵小波, 等. 重金属废渣的硫固定稳定化[J]. 中国有色金属学报, 2008, 18(11): 2105-2110.
[13] 杨少辉, 闵小波, 柴立元, 等. 硫固定法处理重金属废渣制作硫磺建材的研究[J]. 中南大学学报(自然科学版), 2011, 42(11): 3262-3269.
[14] Mihara N, Soya K, Kuchar D, et al. Utilization of calcium sulfide derived from waste gypsum board for metal-containing wastewater treatment[J]. Global NEST Journal, 2008, 10(1):101-107.
[15] Liang Z, Peng X, Luan Z. Immobilization of Cd, Zn and Pb in sewage sludge using red mud[J]. Environmental Earth Sciences, 2012, 66(5): 1321-1328.

