仙台病毒核酸快速检测方法的建立和应用
熊 炜,林颖峥,魏晓锋,郭雨燕,张 强,刘俊平,李 健,胡建华,黄忠荣
(1.上海出入境检验检疫局,上海 200135;2.上海实验动物研究中心,上海 201203)
·研究论文·
仙台病毒核酸快速检测方法的建立和应用
熊 炜1,林颖峥1,魏晓锋2,郭雨燕1,张 强1,刘俊平1,李 健1,胡建华2,黄忠荣1
(1.上海出入境检验检疫局,上海 200135;2.上海实验动物研究中心,上海 201203)
仙台病毒(Sendai virus,SeV)是一种常见的可引起啮齿类动物呼吸道疾病的病原,感染迅速,并且隐性感染率高,一旦感染较难从鼠群中清除,从而影响动物健康。为满足对入境噬齿类实验动物和野生动物仙台病毒快速检测的需要,本研究针对SeV编码基质蛋白和融合糖蛋白基因的保守序列设计引物和荧光探针,建立了仙台病毒RT-PCR和Real-time RT-PCR检测方法。将建立的方法应用于仙台病毒感染鼠不同临床样品和组织培养物的检测,证实两种核酸检测方法具有良好的特异性、灵敏性和稳定性,适合应用于出入境口岸实验和野生噬齿类动物仙台病毒疫情的快速检测。
仙台病毒;RT-PCR;Real-time RT-PCR;TaqMan探针
仙台病毒(Sendai virus,SeV)属副粘病毒科、副粘病毒属,是一种具有细胞融合活性的病毒,它可引起啮齿类动物呼吸道疾病。1952年首先在日本分离到仙台病毒,继而世界各地都有报道[1]。仙台病毒感染一年四季都可发生,但以春季多发,环境因素的突变可加重发病和流行。空气传播和直接接触传播是该病毒播散的主要方式。SeV在鼠群中多呈隐性感染,实验用鼠一旦感染常会改变体内细胞免疫反应,干扰试验结果,而且难以从鼠群中清除该病毒,影响幼鼠发育成长和降低成年母鼠的繁殖率。在自然条件下仙台病毒可感染小鼠、大鼠、仓鼠和豚鼠,不同品系小鼠对仙台病毒的易感性明显不同。雪貂可鼻内感染,引起发热、肺炎和死亡。该病毒对人类有一定的致病性,特别是幼儿易感,日本和中国均有相关报道[2,3]。仙台病毒为单股负链RNA病毒,其基因组大小为15 kb,编码核壳蛋(Nucleoprotein,N)、磷蛋白(Phosphoprotein,P)、基质蛋白(Matrix protein,M)、融合蛋白(Fusion protein,F)、血凝素-神经氨酸酶(Hemagglutinin neuraminidase,HN)和大蛋白(L protein,L)等结构和非结构蛋白[4-6],已有研究将其作为基因治疗和免疫的载体[7,8]。除病原分离、血清中和和ELISA等传统血清学检测方法,RTPCR是最常用的核酸检测方法[9-14]。由于仙台病毒隐性感染率高、危害大,为了加强出入境口岸对入境噬齿类实验动物和野生动物仙台病毒疫病监测和流行病学调查,本研究建立了RT-PCR和Real-time RT-PCR检测SeV的方法,并将其应用于不同组织和体液样本的检测,以测试核酸快速检测方法的特异性、敏感性和稳定性。
1 材料与方法
1.1 主要试剂TRIzol购自Invitrogen公司;Taq酶、AMV逆转录酶、RNA酶抑制剂、dNTP、随机引物、DNA Marker(DL2000)购自TaKaRa公司。
1.2 病毒样品来源及处理SeV阳性组织和细胞培养物来自上海实验动物研究中心,采集病鼠口鼻液、血液、粪便,以及肝脏、脾脏、肺脏、肾脏等组织器官。粪便、组织样品加等体积生理盐水研磨匀浆,3000×g离心15 min,收集上清液待检。本研究使用的其他病毒,如小鼠肺炎病毒(Pneumonia virus of mice,MPV)、鼠肝炎病毒(Mouse hepatitis virus,MHV)、淋巴细胞脉络丛脑膜炎病毒(Lymphocytic choriomeningitis virus,LCMV)、呼肠孤病毒3型(Reovirus type 3,Reo-3)、小鼠细小病毒(Parvovirus minute virus of mice,MVM)来自上海实验动物研究中心。上述病毒样品经核酸分离提取制备成cDNA备用。
1.3 动物攻毒试验将SeV细胞培养物0.5 mL滴鼻感染
6周龄Swiss裸鼠,正常喂饲2~3 d,待其出现临床症状后采集鼠的口鼻液、血液、粪便,并处死,采集肝脏、脾脏、肺脏、肾脏等组织样本。
1.4 RNA抽提及cDNA模板制备取100 μL待检上清液或血清,加1 mL TRIzol试剂,按常规方法进行RNA抽提,RNA沉淀用20 μL DEPC水溶解。取11 μL RNA溶液,加5×逆转录酶浓缩缓冲液4 μL、dNTP 1 μL、随机引物1 μL、RNA酶抑制剂1 μL、AMV逆转录酶2 μL,置PCR仪上42℃反应60 min,即得cDNA模板。
1.5 RT-PCR检测针对SeV的融合糖蛋白(fusion glycoprotein)基因设计RT-PCR引物,扩增片段大小为507 bp。上游引物:5'-CCACATTGG TCTCGTGTCAGATTCC-3',下游引物:5'-CATC ATTCACGAAATCCTGGAGTGTC-3'。反应体系:cDNA模板2 μL、10×Taq酶浓缩缓冲液2.5 μL、dNTP 0.5 μL、上下游引物各0.25 μL、Taq酶0.25 μL,加水补足总体积至25 μL。扩增程序:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸40 s,35个循环;最后72℃延伸3 min。PCR产物经1.0%琼脂糖凝胶电泳后,用凝胶成像系统拍摄。
1.6 Real-time RT-PCR引物和TaqMan探针使用Vector NTI Suite软件分析不同国家和地区分离的SeV基质蛋白(M)基因的保守序列,用Primer Express软件设计引物和TaqMan探针,上游引物(TSVF):5'-GTGATTTGGGCGGC ATCT-3',下游引物(TSVR):5'-GATGGCCGG TTGGAACAC-3',TaqMan探针:5'-TAGAAATC ACAGGCGTCG-3',其中TaqMan探针的5'端标记FAM,3'端标记TAMRA。引物和探针由上海辉睿生物科技有限公司合成,引物和探针的浓度均为25 μmol/L。
1.7 Real-time RT-PCR检测采用ABI公司ViiA7荧光PCR仪。反应体系:10×Taq酶浓缩缓冲液2.5 μL、dNTP 0.5 μL、Taq酶0.25 μL、模板1 μL、上下游引物(TSVF、TSVR)各0.25 μL、TaqMan探针0.25 μL,加水补足总体积至25 μL。反应条件:95℃预变性3 min;然后95℃ 15 s,58℃ 45 s,40个循环,每个循环第二步收集荧光信号。
2 结果
2.1 RT-PCR和Real-time RT-PCR检测SeV的特异性试验针对SeV保守基因序列,设计引物和探针,分别建立RT-PCR和Real-time RT-PCR检测方法,并使用不同鼠病毒(MHV、MPV、LCMV、Reo-3和MVM)作为对照,测试这两种检测方法的特异性。结果显示,经RT-PCR检测,仅有SeV阳性样品出现条带单一的特异性基因扩增,其他对照病毒样品均呈阴性(图1);经Real-time RT-PCR检测,SeV阳性样品在18~20个循环处出现显著扩增,对照病毒样品未见扩增(图2)。

图1 RT-PCR方法检测仙台病毒的特异性Fig.1 The Specifi city of RT-PCR for detecting Sendai virus (SeV)M: DNA分子质量标准(DL2000); 1: SeV; 2: MHV; 3: MPV; 4: LCMV; 5: Reo-3; 6: MVM; 7: 空白对照M: DNA Marker (DL2000); 1: SeV; 2: MHV; 3: MPV; 4: LCMV; 5: Reo-3; 6: MVM; 7: Blank control

图2 Real-time RT-PCR方法检测仙台病毒的特异性Fig.2 The specifi cty of Real-time RT-PCR for detecting Sendai virus (SeV)
2.2 RT-PCR和Real-time RT-PCR检测SeV的敏感性试验将SeV阳性样品cDNA进行定量并梯度稀释,制备浓度分别为10 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL的模板,再分别用建立的两种方法进行检测。结果显示,常规RT-PCR检测样品SeV阳性样品cDNA模板的下限量为100~10 pg(图3),而Real-time RT-PCR检测SeV cDNA模板的下限量为100~10 fg(图4)。

图3 RT-PCR检测仙台病毒的敏感性试验Fig.3 Sensitivity test of RT-PCR for detecting Sendai virus (SeV)
M: DNA分子质量标准(DL2000); 1: 10 ng模板; 2: 1 ng模板; 3: 100 pg模板; 4: 10 pg模板; 5: 1 pg模板; 6: 100 fg模板; 7: 10 fg 模板; 8: 1 fg模板
M: DNA Marker(DL2000); 1: 10 ng template; 2: 1 ng template; 3: 100 pg template; 4: 10 pg template; 5: 1 pg template; 6: 100 fg template; 7: 10 fg template; 8: 1 fg template

图4 Real-time RT-PCR方法检测仙台病毒的特敏感性试验Fig.4 Sensitivity test of Real-time RT-PCR for detecting Sendai virus (SeV)
2.3 RT-PCR和Real-time RT-PCR检测SeV阳性鼠不同临床样本为进一步验证建立的RT-PCR和Realtime RT-PCR方法的可靠性和稳定性,将SeV细胞培养物接种6周龄Swiss裸鼠,待动物出现明显临床症状后,采集动物的口鼻液、血液、粪便及肝脏、脾脏、肺脏、肾脏等组织器官,再分别使用建立的RT-PCR和Real-time RT-PCR方法检测。结果显示,经RT-PCR检测,除粪便样品外,SeV攻毒鼠的口鼻液、血液、肝脏、脾脏、肺脏、肾脏等组织器官均检出了SeV的特异性基因条带(图5);而经Real-time RT-PCR检测,除粪便样品外,其余样本的荧光信号曲线均呈显著扩增,其Ct值在22~32个循环(图6)。

图5 RT-PCR检测仙台病毒感染鼠不同临床样本Fig.5 Detcetion of Sendai virus (Sev) in different clinical samples of mice by RT-PCRM: DNA分子质量标准(DL2000); 1: 肝脏; 2: 脾脏; 3: 肺脏; 4: 肾脏; 5: 血液; 6: 口鼻液; 7: 粪便M: DNA Marker(DL2000); 1: Liver; 2: Spleen; 3: Lung; 4: Kidney; 5: Blood; 6: Oronasal liquid; 7: Feces
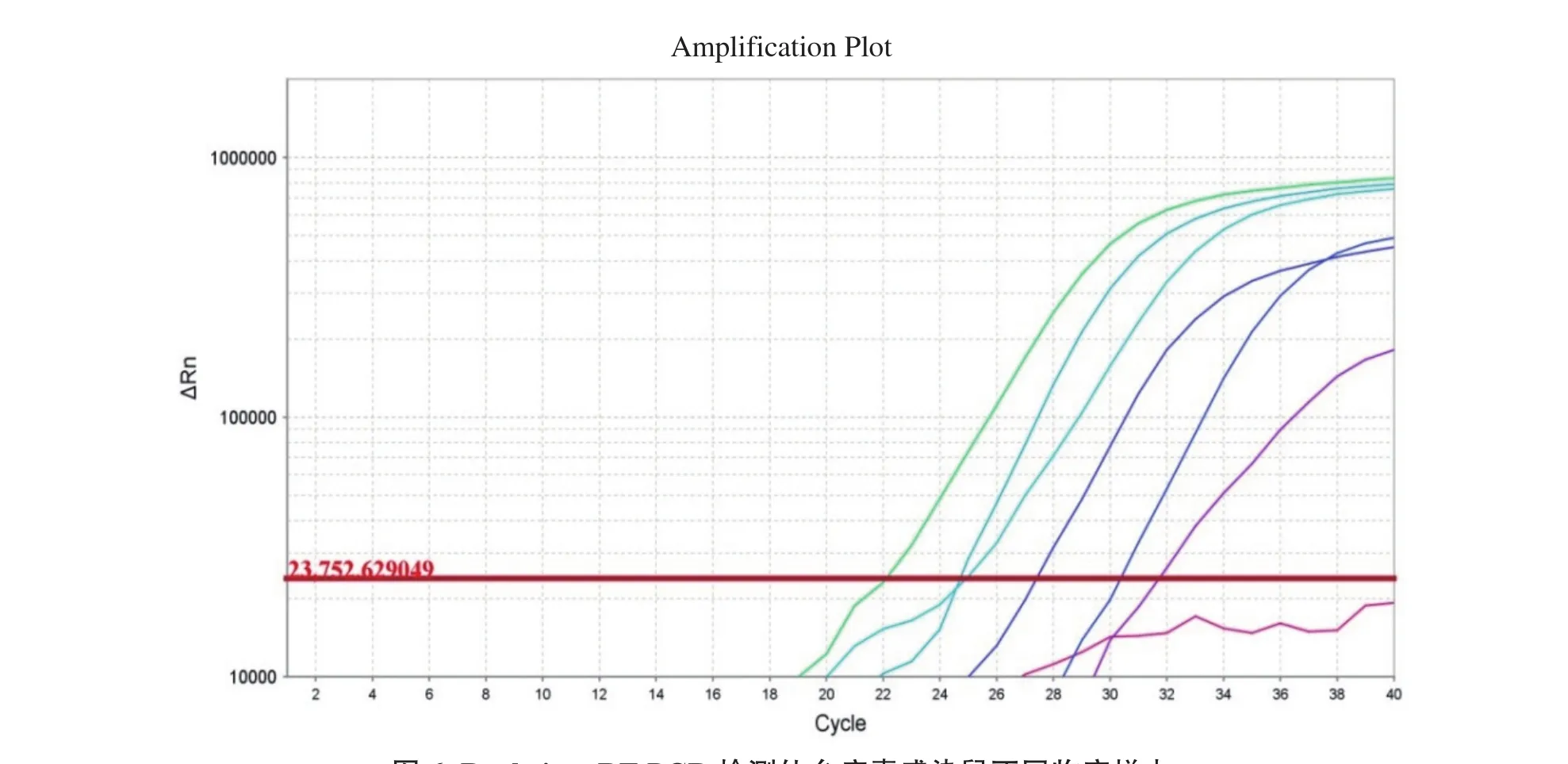
图6 Real-time RT-PCR检测仙台病毒感染鼠不同临床样本Fig. 6 Detcetion of Sendai virus (SeV) in different clinical samples of mice by Real-time RT-PCR
3 讨论
SeV是感染实验动物的主要病原之一,危害严重,一旦感染较难从鼠群中清除,影响实验动物质量,干扰实验结果,是实验动物养殖和使用中重点防范的疫病。数十年来,学者们对SeV的病原学特性和诊断方法进行了深入研究。将SeV感染动物病料接种BHK-21或Vero细胞或9日龄SPF鸡胚绒毛尿囊腔进行病毒分离,是诊断SeV最传统、最经典的方法,但该方法比较耗时、繁琐。血凝抑制试验是检测SeV传统方法之一,该方法简便易操作,但要选择敏感性的红细胞,且对试剂的稳定性要求较高。补体结合试验是检测SeV经典方法之一,但补体滴度直接影响检测质量且结果判定的主观性较强。免疫荧光法也是检测SeV的方法之一,其敏感性高,但需要配置荧光显微镜。ELISA方法是检测SeV常用的血清学方法,敏感性高、操作简便[1,6]。上述血清学诊断方法,通常仅能检测血液样本,无法直接检测动物组织样本和体液,无法在SeV感染早期进行诊断。鉴于血清学检测方法的局限性,同时为了满足口岸对大量啮齿类动物(含实验动物)入境快速检疫的需要,本研究针对SeV基因的保守序列,建立了RT-PCR和Real-time RT-PCR快速核酸检测方法。通过将这两种检测方法应用于SeV感染鼠不同临床样本和细胞培养物的检测,证实RTPCR方法能有效扩增SeV的特异性基因片段,未发现阳性样品漏检和阴性样品误检,Real-time RTPCR检测阳性和阴性样品荧光信号区分显著。将两种检测方法的敏感性进行对比,证实Real-time RTPCR的检测下限比普通RT-PCR提高了3个数量级,由于SeV隐性感染率较高,采用灵敏度高的检测方法有助于提高隐性感染的检出率,做到早发现、早隔离,从而尽可能降低损失,并控制SeV的传播风险。此外,与RT-PCR方法相比,Real-time RTPCR方法检测周期更短、操作更简便,适合用于SeV疫情的快速高通量筛检。本研究重新设计了SeV特异性的引物和荧光探针,并创新性的将RT-PCR和Real-time RT-PCR两种核酸检测方法互补应用于SeV的检测,这有助于缩短检疫周期、提高阳性检出率,降低SeV随噬齿类动物进入我国的风险。
[1] Faísca P, Desmecht D. Sendai virus, the mouse parainfluenza type 1: a long standing pathogen that remains up-to-date [J]. Res Vet Sci, 2007, 82(1): 115-125.
[2] 刘春燕, 张媛媛, 姚薇, 等. 仙台病毒在儿童急性呼吸道感染中的血清学调查[J]. 天津医科大学学报, 2004, 10(3): 378-379.
[3] 石立莹, 李晓眠, 李梅, 等. 副粘病毒Tianjin株F基因克隆及序列分析[J]. 中华微生物学和免疫学杂志, 2007, 27(8): 751-757.
[4] Kolakofsky D, Le Mercier P, Iseni F, et al. Viral DNA polymerase scanning and the gymnastics of Sendai virus RNA synthesis[J]. Virology, 2004, 318(2): 463-473.
[5] 杨宇, 任鲁风, 张辉, 等. 仙台病毒BB1株基因组cDNA序列测定及比较分析[J]. 病毒学报, 2006, 22(2): 96-100.
[6] 袁立军, 李晓眠, 李梅. 仙台病毒基因结构与功能的研究进展[J]. 中国病原生物学杂志, 2006, 1(6): 462-464.
[7] Nakanishi M, Otsu M. Development of Sendai virus vectors and their potential applications in gene therapy and regenerative medicine[J]. Curr Gene Ther, 2012, 12(5): 410-416.
[8] Griesenbach U, Inoue M, Hasegawa M, et al. Sendai virus for gene therapy and vaccination [J]. Curr Opin Mol Ther, 2005, 7(4): 346-352.
[9] 李晶哲, 李晓眠, 李越. 仙台病毒高滴度病毒制备方法的建立[J]. 天津医科大学学报, 2009, 15(1): 23-26.
[10] 侯丽波, 谢军芳, 佟巍, 等. 小鼠仙台病毒标准化血清的制备及鉴定[J]. 中国比较医学杂志, 2009, 15(1): 57-59.
[11] 魏巍, 刘霄磊, 刘家森, 等. 大小鼠主要病毒血清抗体检测结果与分析[J]. 实验动物科学, 2011, 28(6): 23-25.
[12] 王宗耀, 王胜昌, 胡建华, 等. 仙台病毒抗体间接ELISA检测方法的建立及应用[J]. 上海交通大学学报(农业科学版), 2008, 26(2): 114-118.
[13] 李晓波, 付瑞, 王吉, 等. 仙台病毒RT-PCR检测方法的建立及灰仓鼠中流行情况调查[J]. 中国比较医学杂志, 2012, 22(12): 18-22.
[14] Wagner A M, Loganbill J K, Besselsen D G. Detection of sendai virus and pneumonia virus of mice by use of fluorogenic nuclease reverse transcriptase polymerase chain reaction analysis[J]. Comp Med, 2003, 53(2): 173-177.
DEVELOPMENT AND APPLICATION OF RAPID NUCLEIC ACID DETECTION METHODS FOR SENDAI VIRUS
XIONG Wei1, LIN Ying-zheng1, WEI Xiao-feng2, GUO Yu-yan1, ZHANG Qiang1, LIU Jun-ping1, LI Jian1, HU Jian-hua2, HUANG Zhong-rong1
(1.Shanghai Entry-Exit Inspection and Quarantine Bureau, Shanghai 200135, China; 2.Shanghai Laboratory Animal Research Center, Shanghai 201203, China)
Sendai virus (SeV) is one of common pathogens causing respiratory disease among rodent animals, which is characterized by rapid infection and high recessive infection rates. Therefore, SeV infection is diffi cult to eliminate from affected animals and might interfere with animal experiments. In order to meet requirements for rapid quarantine for rodent animals, RT-PCR and Real-time RTPCR methods were developed using TaqMan probe to detect SeV. Both methods were applied to test clinical samples collected from SeV infected mice and cell cultures. The results showed that RT-PCR and Real-time RT-PCR methods were specifi c, sensitive and reproducible thus both methods were suitable for diagnosis of SeV infection in rodent animals.
Sendai virus; RT-PCR; Real-time RT-PCR; TaqMan probe
S852.659.5
:A
:1674-6422(2014)04-0023-06
2013-12-27
上海市科委科研项目(13DZ0502500)
熊炜,男,博士,高级兽医师,主要从事动物病原检测工作
林颖峥,E-mail:linyz@shciq.gov.cn

