H1N1亚型猪流感病毒HA和NA基因双重RT-PCR定型检测方法的建立与应用
温肖会,蔡春梅,魏文康,翟少伦,吕殿红,贾春玲,袁 洁,黄 忠,周秀蓉
(广东省农业科学院动物卫生研究所,广州 510640)
·研究论文·
H1N1亚型猪流感病毒HA和NA基因双重RT-PCR定型检测方法的建立与应用
温肖会,蔡春梅,魏文康,翟少伦,吕殿红,贾春玲,袁 洁,黄 忠,周秀蓉
(广东省农业科学院动物卫生研究所,广州 510640)
为了建立适用于临床诊断的H1N1亚型猪流感病毒快速检测方法,本研究根据GenBank已登录的H1N1亚型猪流感病毒HA和NA基因序列设计RT-PCR扩增引物,以H1N1亚型猪流感病毒、H3N2亚型猪流感病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒为试验对照,通过优化RT-PCR反应条件和反应体系,建立了H1N1亚型猪流感病毒HA和NA基因双重RT-PCR定型检测方法。同时,运用H1N1亚型猪流感病毒血凝和血凝抑制试验方法和本研究建立的方法对165份猪病料样品进行了对比验证。结果表明,本研究建立的H1N1亚型猪流感病毒双重RT-PCR具有良好的特异性、敏感性、重复性,所扩增的目的基因片段大小分别为428 bp和678 bp左右,可检出最小基因组RNA浓度为2.9×10-5μg/μL。本研究建立的方法和H1N1亚型猪流感病毒血凝和血凝抑制试验方法均从同一份猪肺脏样品中检测出H1N1亚型猪流感病毒,其余样品中均未检出H1N1亚型猪流感病毒,两种方法符合率为100%。本研究建立的方法适用于H1N1亚型猪流感病毒双基因定型检测,可在H1N1亚型猪流感病毒流行病学调查和临床诊断中应用。
H1N1亚型猪流感;双重RT-PCR方法;HA基因;NA基因
流感病毒(Influenza virus,IV)属于正粘病毒科(Orthomyxoviridae)、流感病毒属,根据核衣壳蛋白(Nucleotide protein,NP)和基质蛋白(Martrix proteins,M)不同,分为甲(A)、乙(B)、丙(C)3型[1]。2009年一种新型甲型HlNl流感病毒在墨西哥暴发流行,随后传播至全球大多数国家,包括美国、加拿大、澳大利亚、阿根廷、巴西、中国等国家[2-6]。该病毒属正粘病毒科甲型猪源性流感病毒属,为单股负链分节段的RNA病毒,其基因组的神经氨酸酶(neuraminidase,NA)、M节段为欧亚谱系,与已知的三重配甲型猪源性流感病毒(NA、M节段为北美谱系)不同[7]。血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)决定着甲型流感病毒的亚型,通过HA和NA的不同组合,有16种HA亚型(Hl~H16)和9种NA亚型(N1~N9)[8]。HA可被宿主细胞表面含唾液酸的蛋白质识别并介导病毒入侵,内吞后触发病毒与宿主细胞膜融合,病毒RNA进入细胞质;NA通过裂解宿主和病毒蛋白上的唾液酸,以便于病毒脱离细胞[9,10]。HA基因和NA基因在流感病毒入侵与脱离细胞中起着重要的作用,选用HA和NA作为被检抗原来检测H1N1猪流感病毒较为及时、可靠,因此双基因定型检测方法尤为重要。本研究针对H1N1猪流感病毒HA和NA基因建立了双重RT-PCR定型性检测方法,以便能更好地为H1N1猪流感流行病学调查和防控工作提供可靠的检测手段。
1 材料与方法
1.1 材料
1.1.1 毒株与待检样品 H1N1亚型猪流感病毒、H3N2亚型猪流感病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒由广东省农业科学院动物卫生研究所动物疫病诊断中心保存;待检样品:2009年6月至2012年6月,分别从广州市、东莞市、增城市、惠州市、中山市、博罗县、江门市等10个市(县)的80个病死猪中采集到的165份猪病料样品,包括肺脏80份、淋巴结30份、脾脏30份以及肾脏25份,由广东省农业科学院动物卫生研究所动物疫病诊断中心保存。
1.1.2 主要试剂和工具酶 一步法反转录RT-PCR试剂盒、DNA Marker (DL2000)、AMV反转录酶、RNase -Inibitor、rTaq DNA 聚合酶、dNTPs等均购自大连宝生物工程有限公司;病毒基因组RNA提取试剂盒购自北京天根生化科技有限公司。
1.1.3 主要仪器设备 美国伯乐公司的S1000梯度PCR仪;上海天能科技有限公司的1600凝胶成像系统和EPS-300电泳仪;美国贝克曼公司的DU730核酸分析仪;瑞士梅特勒-托力多仪器有限公司的AC204电子天平;德国 Eppendorf公司的移液器;德国贺利氏公司的PIC017离心机。
1.2 方法
1.2.1 引物设计 根据 GenBank 已公布的H1N1亚型猪流感病毒HA基因和NA基因的序列(登录号:JN375137.1、JX963605.1、JQ319648.1、CY085886.1、KF142495.2、FJ536762.1、HQ541672.1、JN375195.1、JN809186.1、JX963606.1、CY085952.1、FJ536812.1、HM754650.1、JN375193.1),用 Primer Premier5.0软件设计两对H1N1亚型猪流感病毒HA基因和NA基因特异性引物,用于H1N1亚型猪流感病毒HA基因和NA基因扩增。预期扩增产物片段长度约为428 bp和678 bp。HA基因扩增引物:H1N1HAP1: 5'-CAAAGTGCCAAACTCCTC-3';H1N1HAP2: 5'-CCATACATCCAAAAATCC-3'。NA 基因扩增引物:H1N1NAP1: 5'-TAAGGAC AGAAGCCCATA-3';H1N1NAP2: 5'-CAAATCATC TCAAAACCC-3'。以上引物由上海英骏生物技术有限公司合成。
1.2.2 模板制备 按照天根生化科技有限公司病毒基因组RNA提取试剂盒操作说明书,提取病毒基因组RNA,-20℃保存备用。
1.2.3 H1N1亚型猪流感病毒HA和NA基因RTPCR扩增体系 在 PCR 反应管中分别加入灭菌水7.5 μL,2×1 step buffer 12.5 μL、HA基因上下游引物(20 pmol/μL)各0.5 μL、NA基因上下游引物(20 pmol/μL)各0.5 μL、primescript 1 step enzyme mix 1 μL、模板 2 μL,PCR扩增体系共25 μL 。
1.2.4 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增反应条件的优化 运用正交法梯度性地改变变性温度和时间,退火温度和时间、延伸时间以及循环数等条件,确定引物的最佳循环扩增条件。
1.2.5 H1N1亚型猪流感病毒HA和NA基因序列测定取H1N1亚型猪流感病毒HA和NA基因PCR 产物 50 μL 于1.2% 琼脂糖凝胶上电泳,切下目的条带,按凝胶回收试剂盒操作说明纯化回收 PCR 产物。将纯化的PCR产物送上海博尚生物技术有限公司进行测序,并将测序结果分别与GenBank 网站公布的H1N1亚型猪流感病毒HA和NA基因参考序列进行比对。
1.2.6 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增特异性试验 以H1N1亚型猪流感病毒、H3N2亚型猪流感病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒提取的基因组RNA为模板,并以灭菌水为阴性对照,验证该RT-PCR方法的特异性。
1.2.7 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增敏感性试验 将 200μL H1N1亚型猪流感病毒提取基因组RNA,用核酸分析仪确定其浓度,然后将其按 10倍递减稀释至 10-8,用引物对其进行 PCR扩增,验证该RT-PCR方法的敏感性。
1.2.8 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增重复性试验 将H1N1亚型猪流感病毒在相同条件下,重复进行 8次基因组RNA提取和RT-PCR检测,以验证该RT-PCR方法的重复性。
1.2.9 临床应用检测 将165份猪病料样品无菌研磨处理后,过滤,接种鸡胚分离培养,盲传3代,用H1N1亚型猪流感标准血清对3批鸡胚尿囊液进行血凝试验和血凝抑制试验鉴定。通过运用H1N1亚型猪流感病毒鸡胚分离鉴定、血凝试验和血凝抑制试验与本研究建立的H1N1亚型猪流感病毒HA和NA基因RT-PCR定型检测方法对165份猪病料样品进行对比验证,了解165份猪病料样品中H1N1亚型猪流感病毒的阳性率,并比较H1N1亚型猪流感病毒HA和NA基因RT-PCR定型检测方法和病毒分离鉴定方法的符合率,以验证H1N1亚型猪流感病毒HA和NA基因RT-PCR定型检测方法的实用性与准确性。
2 结果
2.1 H1N1亚型猪流感病毒HA和NA基因RT-PCR反应条件及扩增最佳循环扩增条件为:首先50℃ 45 min;95℃预变性 5 min;然后95℃变性50 s,52℃退火50 s,72℃延伸90 s,共进行35个循环;最后72℃延伸10 min,4℃保存。PCR产物经 1.2% 琼脂糖凝胶电泳显示,单纯HA基因引物、NA基因引物扩增的PCR产物分别在428 bp和678 bp左右各出现了1条片段,HA和NA 基因双重引物扩增的PCR产物出现了2条带,分别在428 bp和678 bp左右,与预期大小相符(图1)。
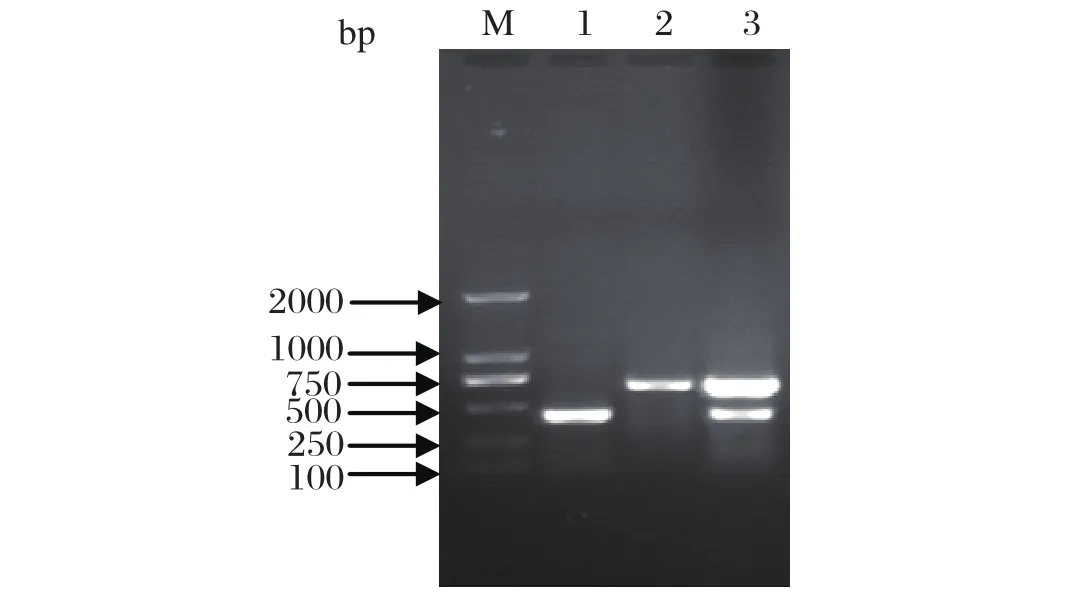
图1 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增Fig.1 RT-PCR result of HA gene and NA gene of H1N1 subtype Swine infl uenza virusM: DNA 分子量标准(DL2000);1: HA基因; 2: NA基因;3: HA基因和NA 基因M: DNA Marker(DL2000); 1: HA gene; 2: NA gene; 3: HA and NA gene
2.2 H1N1亚型猪流感病毒HA和NA基因测序将HA基因和NA基因引物扩增到的基因片段测序,序列测定结果提交NCBI BLAST进行比对检索,鉴定为H1N1亚型猪流感病毒HA基因和NA基因,结果表明,HA基因和NA基因引物能分别准确扩增到H1N1亚型猪流感病毒HA基因和NA基因序列。
2.3 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增特异性试验经 1.2% 琼脂糖凝胶电泳显示,发现只有H1N1亚型猪流感病毒PCR产物在428 bp和678 bp左右各出现了一条目的片段,与预期大小相符,而灭菌水对照、H3N2亚型猪流感病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒都没有出现条带(图2)。

图2 RT-PCR检测H1N1亚型猪流感病毒特异性试验Fig.2 Specifi city test of RT-PCR for H1N1 subtype Swine infl uenza virus
M: DNA 分子量标准(DL2000); 1: H1N1亚型猪流感病毒; 2:阴性对照; 3: H3N2亚型猪流感病毒; 4: 猪瘟病毒; 5: 猪繁殖与呼吸综合征病毒
M: DNA Marker (DL2000); 1: H1N1 subtype Swine infl uenza virus; 2: Negative control; 3: H3N2 subtype Swine infl uenza virus; 4: Classical Swine fever virus; 5: Porcine reproductive and respiratory syndrome virus
2.4 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增敏感性试验用核酸测定仪测定H1N1亚型猪流感病毒基因组RNA的浓度为2896 μg/mL,OD260与OD280的比值为2.08,按10倍递减稀释至2.9×10-8μg/mL,PCR扩增体系为 25 μL,模板为2 μL。能检出的最小基因组RNA浓度为2.9×10-5μg/μL(图3)。
2.5 H1N1亚型猪流感病毒HA和NA基因RT-PCR扩增重复性试验经 1.2% 琼脂糖凝胶电泳显示,8次提取的H1N1亚型猪流感病毒基因组RNA的RT-PCR扩增结果均出现了清晰明亮的目的条带(图4)。结果表明,建立的H1N1亚型猪流感病毒HA和NA基因RTPCR定型检测方法具有良好的重复性。
2.6 临床应用检测165份猪病料样品鸡胚分离鉴定结果显示,1份肺脏样品在48 h内导致鸡胚全身出血死亡,尿囊液浑浊,血凝价为9 log2,H1N1亚型猪流感标准血清血凝抑制价为8 log2,鉴定为H1N1亚型猪流感病毒;其余164份样品鸡胚在72 h时血管清晰、尿囊液澄清,生长良好,无死亡鸡胚,均无血凝性。鸡胚分离鉴定结果表明,从165份猪病料样品中分离到一株H1N1亚型猪流感病毒。RT-PCR定型检测结果显示,鸡胚分离鉴定H1N1亚型猪流感病毒阳性肺脏样品在428 bp和678 bp左右各出现了一条特异性的目的片段,其余肺脏、淋巴结、脾脏和肾脏等164份样品均没有出现条带,表明165份猪病料样品中检出1份H1N1猪流感病毒核酸阳性样品。两种方法对比验证结果表明,鸡胚分离鉴定方法和本研究建立的H1N1亚型猪流感病毒HA和NA基因RTPCR定型检测方法符合率为100%,验证了本研究建立的H1N1亚型猪流感病毒HA和NA基因RT-PCR定型检测方法的准确性。
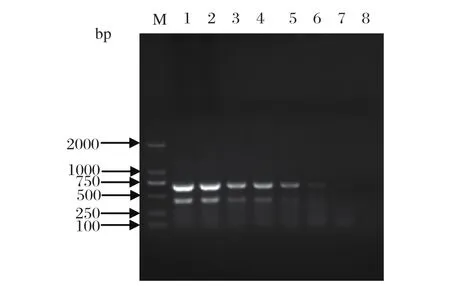
图3 RT-PCR检测H1N1亚型猪流感病毒敏感性试验Fig.3 Sensitivity test of RT-PCR for H1N1 subtype Swine infl uenza virus
M: DNA 分子量标准(DL2000); 1: 2.9×10-1μg/μL; 2: 2.9×10-2μg/μL; 3: 2.9×10-3μg/μL; 4: 2.9×10-4μg/μL; 5: 2.9×10-5μg/μL; 6: 2.9×10-6μg/μL; 7: 2.9×10-7μg/μL; 8: 2.9×10-8μg/μL
M: DNA Marker (DL2000); 1: 2.9×10-1μg/μL; 2: 2.9×10-2μg/μL; 3: 2.9×10-3μg/μL; 4: 2.9×10-4μg/μL; 5: 2.9×10-5μg/μL; 6: 2.9×10-6μg/μL; 7: 2.9×10-7μg/μL; 8: 2.9×10-8μg/μL

图4 RT-PCR检测H1N1亚型猪流感病毒重复性试验Fig.4 Repeatability test of RT-PCR for H1N1 subtype Swine infl uenza virusM: DNA 分子量标准(DL2000); 1~8: 依次是第1到8次提取的H1N1亚型猪流感病毒基因组RNAM: DNA Marker (DL2000); 1-8: RNA extraction from H1N1 subtype Swine infl uenza virus
3 讨论
猪在流感病毒种属间互相传播中占有重要的地位,被认为是人、禽、猪流感病毒通过基因重排产生新型流感病毒的“混合器”。人呼吸道上皮细胞主要以唾液酸α-2,6半乳糖苷(SA-α-2,6Gal)受体为主,而禽呼吸道上皮细胞主要以唾液酸α-2,3半乳糖苷(SA-α-2,3Gal)受体为主。因此,禽流感病毒主要与SA-α-2,3Gal受体结合,而人流感病毒主要与SA-α-2,6Gal受体结合。猪呼吸道上皮细胞表面既有SA-α-2,3Gal受体又有A-α-2,6Ga1受体,因此猪作为中间宿主能同时被禽流感病毒、人流感病毒和猪流感病毒共同感染,三者既可能发生基因重配,也可能使禽流感病毒获得哺乳动物病毒细胞受体识别的分子,可能出现能够适应人和哺乳动物的新型重组流感病毒毒株[11]。猪流感与人流感密切相关,引起人类历史上3次流感大暴发的病原H1N1、H2N2和H3N2亚型流感病毒,均由当时存在于禽类的流感病毒和人的流感病毒在猪体内重组和突变而来[12]。一直以来,作为养猪大国,我国猪流感病毒是影响养殖业健康发展的一种重要病原,尤其是H1N1亚型猪流感在我国猪群中普遍存在并不断发病,不仅给养猪业带来了极大的危害,还严重危害人类健康,有重要的公共卫生意义。因此,基于猪在流感病毒传播链中的作用以及我国流感病毒生态学的复杂性,必须加强检测工作,寻求猪流感的快速、可靠、适用于临床检测的检测方法,才能充分了解猪群中流感病毒的流行毒株和分布情况。
近几年来,猪流感的检测工作受到高度重视,促使猪流感的检测方法得到较好的发展。欧阳振宇等[13]建立了A型猪流感病毒实时荧光定量PCR检测方法,使用含有选定检测序列的重组质粒标准品绘制标准曲线,该方法的敏感性可达100拷贝/25 μL,显示出良好的敏感性和重复性,临床上已用于实验室鼻拭子样品的检测。杨焕良等[14]建立了猪流感H1Nl、H1N2和H3N2亚型病毒多重RT-PCR诊断方法,最少可检测到102ElD50的病毒量核酸。对40份阳性临床样品的检测结果和鸡胚分离病毒结果100%一致。2009年北美暴发的甲型H1N1流感感染人的事件再次提醒我们要密切关注猪流感对社会公共卫生的威胁。张红娜等[15]从山东省9个地市40个养猪场采集有流感症状猪的血液样品(263份)和鼻咽拭子(235份),分别用HI试验来检测血清抗体滴度和荧光定量PCR术检测鼻咽拭子中的流感病毒的含量,对猪源新型甲型流感病毒的感染情况进行了调查。结果表明,血清总阳性率为41.6%,荧光定量PCR检测鼻咽拭子总阳性率为30.36%。表明山东省H1N1猪流感分布广泛,在各个地市都有严重的H1N1亚型猪流感感染和流行。白昀等[16]于2011年2月~5月间从江苏省南京市某屠宰场的健康猪群中采集鼻拭子和肺脏组织共690份,通过 RT-PCR 检测有 18 份样品为H1N1亚型猪流感阳性,阳性率为2.61%,表明南京市健康猪群中存在H1N1亚型猪流感带毒情况。禹思宇等[17]于2010年6月采用间接ELISA和实时荧光RT-PCR对湖南省规模化猪场采集的1065份猪血清、16 796份猪棉拭子和360份肺脏样品进行检测,结果表明H1NI猪流感在湖南省呈普遍感染态势。
建立简便、快速、准确、适合临床应用的H1N1亚型猪流感检测方法对H1N1亚型猪流感进行监测和调查十分必要,快速简便的检测方法是及时发现、控制和扑灭H1N1亚型猪流感疫情的重要前提和手段。本研究根据GenBank已登录的H1N1亚型猪流感病毒HA和NA基因序列设计RT-PCR扩增引物,成功建立了H1N1亚型猪流感病毒HA和NA基因双基因定型检测方法。试验证实,该方法具有良好的特异性、重复性、敏感性,H1N1亚型猪流感病毒血凝和血凝抑制试验方法和本研究建立的方法均从同一份肺脏样品中检测出H1N1亚型猪流感病毒,其余样品中均未检出H1N1亚型猪流感病毒,两种方法符合率为100%,验证了本研究建立的H1N1亚型猪流感病毒HA和NA基因RT-PCR定型检测方法的准确性。该方法适用于H1N1亚型猪流感病毒一次性定型检测,可在H1N1亚型猪流感病毒流行病学调查和临床诊断中应用。
参考文献
[1] 崔尚金, 鄢明华. 猪流感及其防治[M]. 北京: 金盾出版社, 2009.
[2] Peiris J S, Poon L L, Guan Y. Emergence of a novel swine-origin influenza A virus(S-OIV) H1N1 virus in humans[J]. J Clin Virol, 2009, 45(3): 169-173.
[3] Jamieson D J, Honein M A, Rasmussen S A, et al. H1N1 2009 influenza virus infection during pregnancy in the USA[J] . Lancet, 2009, 374(9688): 451-458.
[4] Partridge J, Kieny M P. World Health Organization H1N1 influenza vaccine Task Force..Global production of seasonal and pandemic (H1N1) influenza vaccines in 2009-2010 and comparison with previous estimates and global action plan targets[J]. Vaccine, 2010, 28(30): 4709-4712.
[5] Orellano P W, Reynoso J I, Carlino O, et al. Protection of trivalent inactivated influenza vaccine against hospitalizations among pandemic influenza A (H1N1) cases in Argentina[J]. Vaccine, 2010, 28 (32): 5288-5291.
[6] Yu H, Zhou Y J, Li G X, et al. Further evidence for infection of pigs with human-like H1N1 influenza viruses in China [J]. Virus Res, 2009, 140(1-2): 85-90.
[7] Novel Swine-Origin Influenza A (H1N1) Virus Investigation Team, Dawood F S, Jain S, et al. Emergence of a Novel Swine-origin influenza A (HlNl) virus in humans[J]. N Engl J Med, 2009, 360(25): 2605-2615.
[8] Fouchier R A, Munster V, Wallansten A, et al. Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls [J]. J Virol, 2005, 79(5): 2814 -2822.
[9] 徐百万, 田克恭. 猪流感[M]. 北京: 中国农业出版社, 2009.
[10] 李广波, 潘欣. 2009 H1N1猪流感病毒新进展[J]. 医学研究生学报, 2010, 23(1): 90-93.
[11] Chao L, Lianfen L, Bo W, et al. A review on 2009 influenza a virus[J]. Agri Sci &Technol, 2012, 13(2): 424-427.
[12] 杨帅, 朱闻斐, 舒跃龙. 猪流感病毒概述[J]. 病毒学报, 2013, 29(3): 330-336.
[13] 欧阳振宇, 唐连飞, 朱中武, 等. A型猪流感病毒实时荧光定量PCR检测方法的建立及应用[J]. 中国畜牧兽医, 2010, 37(9): 75-77.
[14] 杨焕良, 乔传玲, 陈艳, 等. 猪流感病毒H1N1、H1N2和H3N2亚型多重RT-PCR诊断方法的建立[J]. 中国预防兽医学报, 2007, 29(9): 714-718.
[15] 张红娜, 柴同杰, 李欣, 等. 2010-2011年猪场中猪源新型甲型流感病毒流行情况调查[J]. 中国畜牧兽医, 2013, 40(3): 189-192.
[16] 白昀, 冯志新, 甘源, 等. 一株H1N1亚型猪流感病毒的分离鉴定及生物学特性分析[J]. 中国预防兽医学报, 2013, 35(7): 521-525.
[17] 禹思宇, 易征璇, 孟芳, 等. 湖南省规模化猪场H1N1猪流感流行病学调查[J]. 湖南农业科学, 2011(5): 126-128.
DOUBLE RT-PCR METHODS FOR DETECTION OF HA AND NA GENES OF H1N1 SUBTYPE SWINE INFLUENZA VIRUS
WEN Xiao-hui, CAI Chun-mei, WEI Wen-kang, ZHAI Shao-lun, LV Dian-hong, JIA Chun-ling, YUAN Jie, HUANG Zhong, ZHOU Xiu-rong
(Institute of Animal Health, Guangdong Academy of Agricultural Sciences, Guangdong 510640, China)
To develop a reliable diagnostic method for H1N1 subtype Swine infl uenza virus, double RT-PCR methods were developed using primers designed according to the sequences of HA and NA genes of H1N1 Subtype swine influenza virus in GenBank. The amplifi ed gene fragments were 428 bp for HA and 678 bp for NA. The reaction conditions were optimized and minimal detectable RNA concentration was 2.9×10-5μg/μL. Meanwhile, the method had no reaction with H3N2 subtype Swine infl uenza virus, classical Swine fever virus and Porcine reproductive and respiratory syndrome virus. This method developed here is suitable for double gene typing detection and also for early diagnosis and epidemiological investigation of H1N1 subtype Swine infl uenza virus.
H1N1 subtype Swine infl uenza virus; double RT-PCR; HA gene; NA gene
S852.659.5
:A
:1674-6422(2014)04-0029-06
2013-12-20
广东省科技计划社会发展项目(2010B080701024);广东省科技计划特定任务项目(2011B060700075);广州市科技计划项目(2012224-26)
温肖会,女,硕士,助理研究员,主要从事动物疫病诊断和动物传染病学研究
魏文康,E-mail:wwk188@tom.com

