胃癌组织中水通道蛋白1、微血管密度与细胞胀亡的关系及临床意义
卢明东 李丕宏 孙维建 黄和 俞耀军 郑志强
胃癌组织中水通道蛋白1、微血管密度与细胞胀亡的关系及临床意义
卢明东 李丕宏 孙维建 黄和 俞耀军 郑志强
目的 探讨胃癌组织中水通道蛋白1(AQP1)、微血管密度(MVD)与细胞胀亡的关系及临床意义。方法采用免疫组化法、蛋白印迹法检测55例胃癌、22例胃正常组织中AQP1的表达,Ⅷ因子相关抗原多克隆抗体标记血管内皮细胞法计数MVD,透射电镜观测细胞胀亡情况。随访并分析AQP1与胃癌患者预后的关系。结果胃癌组织中存在细胞胀亡;Ⅲ+Ⅳ临床分期胃癌组织中的胀亡指数(OI)高于Ⅰ+Ⅱ临床分期(P<0.01);淋巴结转移组OI明显高于无淋巴结转移组(P<0.05)。AQP1表达强度与MVD呈显著正相关(P<0.05)。在胃癌组织标本中,AQP1阳性表达率为58.2%,明显高于正常胃组织(P<0.01)。胃癌伴淋巴结转移组AQP1表达水平明显高于无淋巴结转移组(P<0.05)。多因素生存分析显示AQP1表达、有无淋巴结转移是预后的独立危险因素(P<0.05)。结论细胞胀亡和AQP1表达与胃癌的血管生成、生物学行为密切相关;AQP1可以作为判断胃癌预后的临床指标。
胃癌 水通道蛋白1 微血管密度 细胞胀亡
肿瘤产生的根本原因是细胞的不可控制生长和细胞死亡调控受限。肿瘤细胞的死亡包括细胞凋亡和细胞胀亡[1-2],两者均广泛存在于肿瘤组织和正常组织中。细胞胀亡是近年来肿瘤研究方面的一大热点,目前关于细胞胀亡在胃癌发生、发展中的作用国内外报道较少。有研究表明,水通道蛋白1(AQP1)在肿瘤细胞死亡、细胞迁移和血管新生的发生中起了重要作用[3]。本研究采用透射电镜检测胃癌细胞发生胀亡的情况,免疫组化法、蛋白印迹法检测胃癌和胃正常组织中AQP1的表达、微血管密度(MVD),分析细胞胀亡与AQP1、MVD的关系,并探讨其临床意义,现报道如下。
1 资料和方法
1.1 一般资料 选取2009-01—12我院经胃癌根治术切除的原发性胃癌组织标本55例,患者男26例,女29例;年龄30~77岁,平均(58.0±13.5)岁。有淋巴结转移者38例,无淋巴结转移者17例。胃癌TNM分期:Ⅰ期5例,Ⅱ期18例,Ⅲ期27例,Ⅳ期5例。所有患者术前均未行放疗、化疗及其他抗癌治疗。同时选择来源于胃溃疡边缘或胃良性肿瘤患者的正常胃组织22例,患者男13例,女9例,年龄29~70岁,平均(52.0±12.6)岁。标本采集后置-80℃冰箱保存。
1.2 方法
1.2.1 AQP1检测 (1)AQP1定位:采用免疫组化法(SP染色),AQP1鼠抗(克隆号H0503,美国Santa Cruz公司产品),工作浓度为1∶80,实验步骤严格按照试剂盒说明书进行。以细胞膜或细胞质出现棕黄色颗粒为阳性细胞,无着色为阴性细胞。(2)AQP1半定量:采用蛋白印迹(western blot)法,取组织1g加入预冷的蛋白裂解液5ml,提取总蛋白。取50μg蛋白样品进行十二烷基硫酸钠-15%聚丙烯酰胺凝胶电泳(100V,1.5h)。待溴酚蓝进入凝胶底部后,将蛋白质印迹到硝酸纤维素膜上,用AQP1鼠抗人一抗1∶400和抗β-actin抗体孵育,过夜,TBST漂洗3次后加入辣根过氧化物酶标记的羊抗鼠二抗(1∶5 000),室温摇床孵育2h,一抗和二抗均为美国Santa Cruz公司产品。增强化学发光显色系统显色,暗室内X线底片感光成像,凝胶成像仪分析。
1.2.2 MVD检测 采用兔抗人第Ⅷ因子相关抗原(FⅧ-RA)多克隆抗体(北京中山生物技术有限公司)进行SP法染色。先在低倍镜下全面观察切片以确定肿瘤内血管密度最高处,高密度血管多位于肿瘤边缘,再在高倍镜下,以与周围肿瘤细胞、微血管和结缔组织成分及其他连接组织成分明显区别的任意1个棕色染色的内皮细胞或细胞丛作为1个血管,只要结构不相连,其分支结构也作为1个血管计数。管腔>8个红细胞、血管环形肌超过3层、硬化区域的血管、肿瘤坏死区、肿瘤细胞稀少区以及良性病变区的微血管不计数。计数10个染色最多的视野中微血管数,取其中最多的3个视野下的平均数作为单位面积血管数,即MVD。
1.2.3 胀亡细胞检测 倒置光学显微镜观察:将细胞按1.0×105个/孔浓度接种于6孔板,培养24h,光镜下观察。设立对照组。以PBS洗涤3次,1 500r/min离心5min,弃上清液,4℃2%戊二醛固定72h,1%俄酸固定,1%醋酸铀块染,丙酮梯度脱水,浸透包埋聚合,超薄切片,铀及铅双重染色后透射电镜下观察。透射电镜(日立1-7500型)下随机计数1 000个肿瘤细胞中的胀亡细胞数,即为该组织的胀亡指数(oncosis index,OI)。
1.2.4 随访 所有患者出院后每6个月随访1次,电话随访与门诊随访相结合(个别患者采用信件随访);随访时间1~60个月,最后随访时间为2013年5月。
1.3 统计学处理 使用SPSS13.0统计软件及凝胶图像分析系统进行灰度分析。计量资料以表示,两组间比较采用t检验,多组间比较采用方差分析。计数资料组间比较采用χ2检验。AQP1表达与MVD的相关性采用Spearman等级相关检验。采用Kaplan-Meier法绘制生存曲线,生存曲线的比较采用log-rank检验,预后影响因素的多因素分析采用Cox回归。
2 结果
2.1 胀亡细胞形态学特征 在透射电镜下观察癌细胞,表现为细胞肿胀,体积增大,胞质空泡化,胞质内出现致密颗粒,内质网肿胀,线粒体早期可出现致密化,后期肿胀,絮状改变或出现高致密颗粒,嵴破坏;细胞肿胀波及核,核内染色质分散,凝集在核膜、核仁周围,有时聚集成团块;胞膜起泡是胀亡早期事件,随之胞膜通透性增加,胞膜崩解,详见图1。

图1 胃癌细胞发生胀亡(A:细胞肿胀,胞质空泡化,胞质内出现致密颗粒;B:细胞肿胀波及核,核内染色质分散,凝集在核膜、核仁周围;透射电镜,×6 000)
2.2 胀亡与临床病理指标关系 临床分期Ⅲ+Ⅳ胃癌组织中OI高于Ⅰ+Ⅱ临床分期(t=8.620,P<0.01);淋巴结转移组OI明显高于无淋巴结转移组(t=2.789,P<0.05)。不同TNM分期、病理类型、分化程度、肿瘤位置、肿瘤大小者OI的差异均无统计学意义(均P>0.05),详见表1。
2.3 AQP1表达与MVD、临床病理特征的关系 AQP1主要表达于癌细胞及毛细血管和小血管内皮细胞的细胞膜上(图2)。55例胃癌组织中32例表达阳性(58.2%),22例胃正常组织中仅有2例(9.1%)表达阳性,两者比较差异有统计学意义(χ2=15.358,P<0.01)。胃癌组织中的AQP1表达水平明显高于胃正常组织,差异有统计学意义(t=2.691,P<0.05)。同时在淋巴结转移阳性和阴性的胃癌组织中,AQP1表达水平的差异有统计学意义(t=2.927,P<0.05)。不同TNM分期、病理类型、分化程度、肿瘤位置、肿瘤大小者AQPI水平的差异无统计学意义(均P>0.05),详见图3、表1、2。有淋巴结转移患者的MVD为24.11±10.73,明显高于无淋巴结转移患者的MVD 9.19±6.45,差异有统计学意义(t=3.273,P<0.05)。经Spearman相关分析,55例淋巴结阳性的胃癌组织标本中AQP1阳性表达水平与MVD呈显著正相关(r=0.734,P<0.05)。
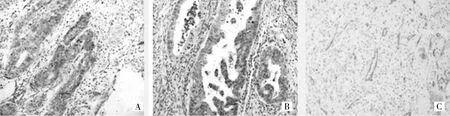
图2 AQP1和MVD在胃癌中的表达(A:管状腺,SP染色,×400;B:乳头状腺癌,SP染色,×200;C:MVD在胃癌中的表达,SP染色,×400)

表1 胃癌组织中临床病理特征与AQP1、OI值的关系

表2 各组胃组织中AQP1表达水平的比较
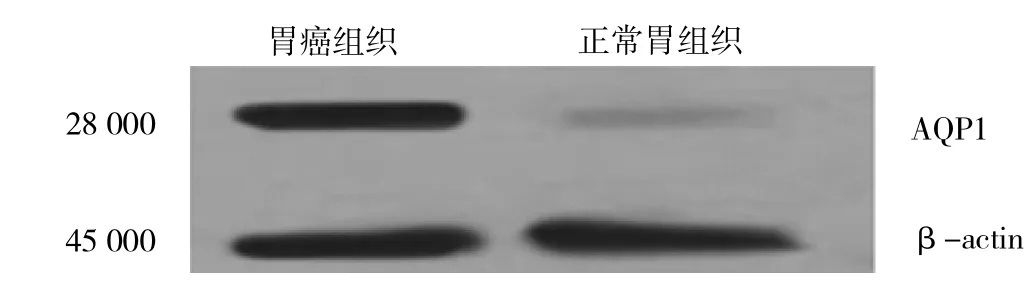
图3 各组胃组织中AQP1蛋白表达水平的比较
2.4 MVD、AQP1与细胞胀亡的关系 透射电镜观察胃癌组织,发现胀亡细胞集聚部分的MVD较疏,血供丰富处的胀亡细胞数量明显减少。AQP1阳性表达者OI(0.73±0.39)低于阴性表达者(1.15±0.56),差异有统计学意义(t=4.112,P<0.01)。
2.5 AQP1与预后 研究结束共收到53例随访资料,其中2例患者死于其他疾病。53例胃癌组织中,AQP1表达阳性30例,其半数生存期为23个月,表达阴性23例,其半数生存期为54个月,两组患者的生存期差异有统计学意义(χ2=5.869,P<0.05,图4),提示AQP1的表达与胃癌患者的生存有关。浸润深度、有无淋巴结转移、临床分期、AQP1表达与胃癌根治术患者的预后显著相关。对53例胃癌患者的生存资料进行Cox回归分析,结果显示AQP1表达、有无淋巴结转移是胃癌根治术患者预后的独立危险因素(P<0.05),详见表3。

图4 AQP1表达阳性和阴性胃癌患者的生存曲线

表3 53例胃癌患者预后危险因素的Cox分析结果
3 讨论
细胞死亡方式包括:细胞凋亡和细胞胀亡[1]。细胞胀亡和肿瘤的发生、恶性化或者消退密切相关[2]。细胞胀亡与维持机体平衡、控制细胞数量、对抗异常细胞增殖等关系密切[2,4]。如果与此有关的生理机制出现异常或者障碍,就有可能发生肿瘤。应用透射电镜观察胃癌组织时,我们发现胃癌细胞存在细胞胀亡,说明细胞胀亡在胃癌的发生、发展起一定的作用。
AQP是一类存在于细胞膜上的水通透性蛋白,在哺乳动物各种组织细胞中广泛分布,共13个成员(AQP0-12),AQP1为其中一员[5-6]。大量研究表明,AQP1在肿瘤细胞死亡、细胞迁移和血管新生中发挥重要作用[3,7-8]。我们前期的研究已经发现[9],AQP1高表达的癌组织内细胞具有较强的转移能力。在本研究中检测55例胃癌组织中AQP1的表达情况,AQP1阳性表达者OI低于阴性表达者,可能通过AQP1对于细胞胀亡的抑制从而使细胞主动性死亡能力丧失。细胞胀亡率的下降使得肿瘤细胞净生长率提高,从而导致肿瘤细胞增殖失控和恶性加剧,故认为AQP1可以作胃癌预后的指标。
肿瘤血管新生是一个复杂的过程,并受多种活性因子调控。MVD被认为是判断恶性肿瘤进展和转移潜力的指标。本研究发现,胃癌标本中AQP1阳性表达强度与MVD表达强度呈正相关,提示AQP1高表达可能与胃癌组织中血管生成有关。同时,细胞胀亡的发生与血液供应不足有关[10]。对MVD和AQP1的表达情况与胃癌临床病理学特征的关系进行分析,发现两者的过表达与较差生物学行为的胃癌相关,与细胞的胀亡存在一定的联系。
综上所述,本课题采用免疫组化法、蛋白印迹法检测AQP1的表达,采用透射电镜观测细胞胀亡情况,并通过分析AQP1表达、MVD与胀亡、临床病理特征的关系,初步证实细胞胀亡和AQP1表达与胃癌的血管生成、生物学行为有一定关系。但是限于随访时间及病例数有限,AQP1对于预后的指示意义有待进一步扩大样本和深入研究才能得到确切的依据。
[1]Vejux A,Lizard G.Cytotoxic effects of oxysterols associated with human diseases:Induction of cell death(apoptosis and/or oncosis),oxidative and inflammatory activities,and phospholipidosis [J].Mol Aspects Med,2009,30(3):153-170.
[2]Loo D,Pryer N,Young P,et al.The glycotope-specific RAV12 monoclonal antibody induces oncosis in vitro and has antitumor activity against gastrointestinal adenocarcinoma tumor xenografts in vivo[J].Mol Cancer Ther,2007,6(3):856-865.
[3]Hu J,Verkman A S.Increased migration and metastatic potential of tumor cells expressing aquaporin water channels[J].Faseb J, 2006,20(11):1892-1894.
[4]Du J H,Zhang H D,Ma Z J,et al.Artesunate induces oncosis-like cell death in vitro and has antitumor activity against pancreatic cancer xenografts in vivo[J].Cancer Chemother Pharmacol,2010,65(5):895-902.
[5]Saadoun S,Papadopoulos M C,Hara-Chikuma M,et al.Impairment of angiogenesis and cell migration by targeted aquaporin-1 gene disruption[J].Nature,2005,434(7034):786-792.
[6]Verkman A S,Hara-Chikuma M,Papadopoulos M C,et al.Aquaporins-new players in cancer biology[J].J Mol Med,2008,86(5):523-529.
[7]Agre P,Kozono D.Aquaporin water channels:molecularmechanisms for human diseases[J].FEBS Lett,2003,555(1):72-78.
[8]冯学超,高洪文,何成彦,等.水通道AQP1敲除小鼠肿瘤血管生成障碍及肿瘤生长减缓[J].生物化学与生物物理进展,2005,32(4):310-313.
[9] 孙维建,李丕宏,卢明东,等.胃癌组织中水通道1蛋白和mRNA的表达及其临床意义[J].中华普通外科杂志,2010,25(5):428-429.
[10]Lecoeur H,de Oliveira-Pinto L M,Gougeon M L.Multiparametric flow cytometric analysis of biochemical and functional events associated with apoptosis and oncosis using the 7-aminoactinomycin D assay[J].J Immunol Methods,2002,265 (1-2):81-96.
Relationship between AQP-1/MVD and oncosis in gastric carcinoma and its clinical significance
Objective To investigate the relationship of aquaporin-1(AQP1)and microvessel density(MVD)with the oncosis in gastric carcinoma and its clinical significance.MethodsExpression of AQP1 in 55 cases of gastric cancer and 22 cases of normal gastric tissue was examined by immunohistochemical method and Western blot.MVD was examined by immunohistochemical method.Oncosis was observed by transmission electron microscope.Both the expression of AQP1 and MVD were measured by the image analysis.All 55 patients were followed up and the relationship of AQP1 and MVD with patients'survival was analyzed.ResultsOncosis was observed by transmission electron microscopy in tissue specimens of gastric carcinoma. The oncosis index(OI)was decreased with decreasing of clinical staging(P<0.01)and it was higher in cases with lymph node metastasis than those without(P<0.05).The expression of AQP1 was positively correlated with MVD(P<0.05).In gastric cancer tissue,the positive expression rate of AQP1 was 58.2%,significantly higher than that in the normal gastric tissue(P<0.01).AQP1 was significantly correlated with lymphatic metastasis.Multivariate analysis revealed that AQP1 expression and lymph node metastasis were independent prognostic factors of poor survival(P<0.05).ConclusionAQP1 may contribute to the progression of gastric cancer by inhabiting oncosis and leading to angiogenesis,and it can be used as an independent prognostic factor for gastric carcinoma.
Gastric cancer AQP-1 Microvesseldensity Oncosis


2013-06-07)
(本文编辑:严玮雯)
温州市科技局对外合作重大课题(H20080056);温州医科大学附属第二医院课题(2013A003)
325027 温州医科大学附属第二医院胃肠外科
郑志强,E-mail:fame198288@126.com

