肝素对劳力型热射病大鼠模型早期干预的作用
陈洁坤,宋 青,李瑞生,张 婷,苗利辉,吴振华
1解放军总医院 重症医学科,北京 100853;2解放军第302医院 动物实验中心,北京 100039
热射病(heat stroke,HS)是以核心体温升高为特征的严重威胁生命的一类急症,内皮细胞损伤和弥散性微血管血栓形成是热射病的一个突出特点[1],其病理机制涉及到体温调节、内毒素、炎性细胞因子、内皮细胞损伤与凝血功能障碍、热休克等多个方面[2-4]。热射病分为两类:劳力型热射病(exertional heat stroke,EHS)与经典型热射病(classic heat stroke,CHS)[5]。在临床救治中,EHS更易出现凝血功能异常[6],表现为血小板减少、凝血时间延长、纤维蛋白降解产物(FDP)和D-二聚体的升高等,病情发展也更加迅猛,死亡率高达30% ~ 80%[7-8]。本实验通过复制EHS大鼠模型并预注射肝素,观察生存率,对血液学指标PLT、APTT及早期炎症因子TNF-α进行测定,以探讨肝素对EHS大鼠早期干预的影响,为临床治疗提供实验依据。
材料和方法
1 实验动物 雄性SPF级Sprague-Dawley大鼠60只,8周鼠龄,体重245 ~ 265 g,由解放军总医院医学实验动物中心提供。大鼠分笼饲养,室温为(26±1)℃,相对湿度60%±5%,每日采用灯光照明,12 h昼夜节律变化。实验过程中动物饲养及取材均遵守实验动物管理和保护的有关规定。
2 实验试剂与设备 环境训练实验室(由国家体育总局体育科学研究所提供),实验动物运动跑台(由国家体育总局体育科学研究所提供),普通肝素钠注射液(上海第一生化药业公司,国药准字H31022051),肿瘤坏死因子-α(TNF-α)ELISA试剂(上海西唐生物科技有限公司),Powlab28sp生理记录仪,直肠测温探头,定时秒表,促凝血清生化管,离心机,EP管,动物解剖实验台及解剖器材。
3 EHS模型制备 将60只大鼠适应性喂养3 d后,均进行6 d适应性递增负荷跑台训练。跑台起始速度为10 m/min,训练时间为30 min,每天依次递增1 m/min,训练时间保持在30 min,直至跑台速度为15 m/min。训练过程中无大鼠死亡。将训练后大鼠随机编号,由计算机软件分析,按完全随机分组方法将其分为3组:空白对照组(A组,n=8)、劳力型热射病组(B组,n=26)、劳力型热射病+肝素组(C组,n=26)。将环境训练实验室温度设置为35℃,湿度设置为70%,数控跑台速度设置为15 m/min,连续运行模式。治疗及最终运动前不限制动物的进食和饮水。
4 动物分组及处理 A组不采取任何处理,于室温为(26±1)℃,相对湿度60%±5%的环境下静置1 h。B组在尾静脉注射0.9%的Nacl(1.0 ml/kg)。C组在尾静脉注射肝素钠注射液(稀释为250 U/ml,1.0 ml/kg)。治疗后0.5 h将B组及C组置入数控跑台进行运动。每10 min用生命体征检测仪肛温检测探头快速测定大鼠肛温并做记录,直至上升至42.5℃视为EHS造模成功取出置于室温(温度(26±1)℃,相对湿度60%±5%)[9]。
5 观察指标 对各组大鼠进行一般状态、体温、血压等记录完成后,实验分两部分。第一部分:B1组及C1组各10只大鼠进行生存率比较,每小时观察生存情况,共观察8 h。第二部分:A组静置1 h后(n=8)、造模后(B2和C2组,n=8)及造模后2 h(B3和C3组,n=8),在各时间点将各组大鼠采用10%的水合氯醛1 ml腹腔内注射麻醉,止血钳夹尾无反应后将大鼠取仰位固定于动物手术架上,从左侧颈外静脉采取血液标本并放血处死大鼠。
6 血液学标志物测定 在各时间点(A组静置1 h后、B2C2组造模后、B3C3组造模后2 h)采血5 ml,送临检科待测PLT、APTT。另留取3 ml抗凝血经离心(1 500 r/min,15 min),取上层血清ELISA法测定TNF-α含量,按试剂盒说明书进行操作。
7 实验数据处理 应用SPSS17.0统计软件进行统计学处理,计量资料一律以±s表示。对多组间样本均数采用完全随机设计资料的方差分析。两组均数比较采用LSD-t检验。组间生存率比较采用Log-Rank检验,做Kaplan-Meier生存曲线。P<0.05为差异有统计学意义。
结 果
1 一般状态观察 A组大鼠行为正常,反应灵敏,有明显逃避行为。B组及C组大鼠在热环境下跑台运动后肛温均上升至42.5℃,认为EHS造模成功。造模后B组及C组大鼠精神萎靡,表情淡漠,呼吸深大,口鼻处湿润,口唇紫绀,腹部紧贴跑道,无逃避行为。
2 两组生存率比较 10只B1组大鼠均在EHS发病后8 h内死亡。同一时段内,10只C1组大鼠5只死亡(P=0.021),提示肝素预处理可提高大鼠的生存率。详见图1。

图1 两组大鼠8h生存率比较Fig. 1 Eight-hour survival rates of two groups
3 各组大鼠PLT、APTT、TNF-α的水平 与A组相比,B2B3组、C2C3组PLT显著降低,APTT显著延长(P<0.01);但与同时间点B组相比,血小板数量升高(P<0.01), APTT短于B组(P<0.01),差异有统计学意义。B2组、B3组与C3组TNF-α含量均高于A组(P<0.01),C2组TNF-α含量与A组相比无统计学意义(P>0.05),但C组两个亚组大鼠TNF-α含量明显低于同时间点B组(P<0.01)。见表1。
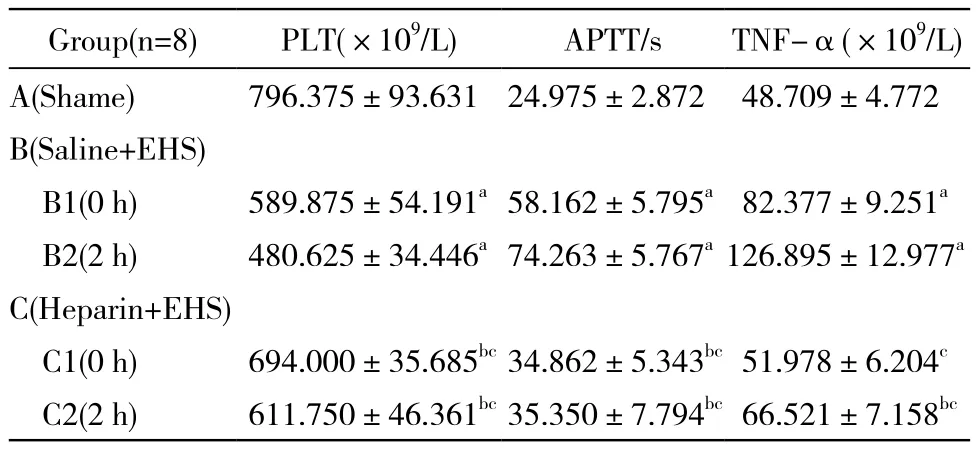
表1 各组凝血功能指标及TNF-α测定结果Tab. 1 Coagulation function and serum TNF-αlevel in different groups
讨 论
目前开展较多的是针对经典型热射病的动物实验研究,我课题组探索利用热应激合并运动进行劳力型热射病大鼠造模。本研究在温度35℃、湿度70%的环境室中,动物数控跑台速度设置为15 m/min、连续运行模式下大鼠进行跑步。同时参照动物热射病诊断标准与国外相关文献:当高温应激动物体核心温度达到42.5℃或动脉收缩压上升到达峰值后的下降点为标志发生中度热射病[10]。本实验以大鼠直肠温度达到42.5℃作为复制EHS大鼠模型标准。既往研究观察热射病模型大鼠存活时间为21 min ~ 480 min不等,因此我们选择480 min作为生存情况观察时间[11]。从生存曲线可观察到肝素预处理组在发病2 h内无大鼠死亡,2 h后两组大鼠生存率均呈不同程度地阶梯状下降,C1组生存率高于B1组。为了初步探讨肝素对EHS大鼠早期干预的作用,我们将发病后及发病后2 h作为观察时间点。
凝血功能紊乱是EHS常见的并发症,由于高温对血管内皮的直接损伤导致,也被认为是EHS发病率和病死率重要的影响机制之一[12]。近年来,炎症和凝血交互作用在热射病相关研究中受到了越来越多的重视[13]。有动物和人体实验表明热应激下宿主发生的炎症反应会导致多组织和脏器损伤,同时使早期细胞因子如TNF-α、IL-1β等升高[14-15]。炎性细胞因子的瀑布样释放引起的全身炎症反应引起了凝血系统的激活和抗凝血机制的抑制。内毒素和细胞因子被认为能激活白细胞和内皮细胞,可以扩大凝血级联反应并加速DIC的发生。同时,凝血活性成分可以刺激各种促炎的级联反应,包括促炎细胞因子如TNF-α、IL-1β、IL-6的产生,这些炎性介质反过来进一步刺激了凝血系统。有研究显示高温(43℃~ 44℃)可直接激活血小板凝集反应[16],使血液处于高凝状态,易导致微循环障碍,促进弥散性血管内凝血的发生,增加了机体多器官功能衰竭综合症(MODS)及死亡。在我们的实验中,显示热应激合并剧烈运动可使血小板降低,APTT延长,如TNF-α的细胞因子升高,增加大鼠凝血功能障碍及全身性炎症反应,加速了大鼠的死亡。
肝素作为一种天然酸性黏多糖,能够影响血小板聚集,从而产生强大的抗凝血作用,可以预防或减轻血管内弥散性凝血(DIC)的发生,是需要迅速达到抗凝作用的首选药物。此外,已有报道称肝素类抗凝血剂能发挥抗炎作用[17-18],抑制缺血再灌注引起的炎症因子激活,并且通过增加一氧化氮和前列环素的产生预防和减轻缺血后内皮细胞功能障碍[19]。一些脂多糖刺激的体外细胞实验证实肝素可下调促炎因子的表达,干扰TNF-α诱导的炎症选择性粘附分子的表达或功能性活动来降低白细胞募集反应和相关性炎性损伤[20]。同时发现,经过化学修饰不具有抗凝作用的肝素样物质仍然具有抗炎作用,这说明肝素的抗炎效用不完全依赖其抗凝特性[21]。在大鼠实验中,最大抑制炎症反应的普通肝素用量(500 U/kg)不会明显延长APTT[22]。微血管内皮损伤、血栓形成、SIRS与HS组织器官损伤密切相关,阻断炎症反应,抑制血栓可降低炎症程度、改善预后[23]。本实验结果表明,肝素可以在一定程度上改善EHS所引起的凝血功能紊乱,抑制炎性介质TNF-α的释放,改善微循环,从而提高生存率。本实验也表明肝素的抗炎活性是区别于抗凝功能的,肝素的某个量对炎症因子TNF-a有抑制能力,并未显著延长APTT。临床实际中,可考虑将某一剂量的肝素用于抗炎而不增加患者的出血风险,为小剂量肝素在EHS中的早期使用提供了一定的实验依据。
1 Bouchama A. Heatstroke: a new look at an ancient disease[J]. Intensive Care Med, 1995, 21(8):623-625.
2 Roberts GT, Ghebeh H, Chishti MA, et al. Microvascular injury,thrombosis, inflammation, and apoptosis in the pathogenesis of heatstroke: a study in baboon model[J]. Arterioscler Thromb Vasc Biol, 2008, 28(6):1130-1136.
3 Lu KC, Wang JY, Lin SH, et al. Role of circulating cytokines and chemokines in exertional heatstroke[J]. Crit Care Med, 2004, 32(2):399-403.
4 Leon LR, Helwig BG. Heat stroke: role of the systemic inflammatory response[J]. J Appl Physiol (1985), 2010, 109(6):1980-1988.
5 宋青. 热射病,致命的中暑[J]. 军医进修学院学报, 2008, 29(6): 453-454.
6 Bouchama A, Bridey F, Hammami MM, et al. Activation of coagulation and fibrinolysis in heatstroke[J]. Thromb Haemost,1996, 76(6):909-915.
7 Bouchama A, Dehbi M, Mohamed G, et al. Prognostic factors in heat wave related deaths: a meta-analysis[J]. Arch Intern Med, 2007,167(20):2170-2176.
8 Jilma B, Derhaschnig U. Disseminated intravascular coagulation in heat stroke: a hot topic[J]. Crit Care Med, 2012, 40(4):1370-1372.
9 张婷,宋青,周飞虎,等. 经典型与劳力型热射病动物模型之比较[J]. 解放军医学院学报, 2013, 34(12):1209-1212.
10 Shen KH, Chang CK, Lin MT, et al. Interleukin-1 receptor antagonist restores homeostatic function and limits multiorgan damage in heatstroke[J]. Eur J Appl Physiol, 2008, 103(5):561-568.
11 Lam KK, Cheng PY, Lee YM, et al. The role of heat shock protein
70 in the protective effect of YC-1 on heat stroke rats[J]. Eur J Pharmacol, 2013, 699(1-3):67-73.
12 Adams T, Stacey E, Stacey S, et al. Exertional heat stroke[J]. Br J Hosp Med(Lond), 2012, 73(2):72-78.
13 Leon LR, Helwig BG. Role of endotoxin and cytokines in the systemic inflammatory response to heat injury[J]. Front Biosci(Schol Ed),2010, 2:916-938.
14 Bouchama A, Ollivier V, Roberts G, et al. Experimental heatstroke in baboon: analysis of the systemic inflammatory response[J]. Shock, 2005, 24(4):332-335.
15 Heled Y, Fleischmann C, Epstein Y. Cytokines and their role in hyperthermia and heat stroke[J]. J Basic Clin Physiol Pharmacol, 2013, 24(2):85-96.
16 Asakura H, Suga Y, Yoshida T, et al. Pathophysiology of disseminated intravascular coagulation (DIC) progresses at a different rate in tissue factor-induced and lipopolysaccharide-induced DIC models in rats[J]. Blood Coagul Fibrinolysis, 2003, 14(3):221-228.
17 Page C. Heparin and related drugs: beyond anticoagulant activity[J/ OL]. ISRN Pharmacol, 2013: 910743.
18 Ceccarelli M, Bani D, Cinci L, et al. Anti-inflammatory effects of low molecular weight heparin derivative in a rat model of carrageenaninduced pleurisy[J]. J Cell Mol Med, 2009, 13(8B):2704-2712.
19 Li X, Zheng Z, Li X, et al. Unfractionated heparin inhibits lipopolysaccharide-induced inflammatory response through blocking p38 MAPK and NF-κB activation on endothelial cell[J]. Cytokine, 2012, 60(1):114-121.
20 王锋, 汪年松, 晏春根. 肝素对内皮细胞黏附功能的影响[J].中国急救医学, 2005, 25(11): 813-815.
21 Rao NV, Argyle B, Xu X, et al. Low anticoagulant heparin targets multiple sites of inflammation, suppresses heparin-induced thrombocytopenia, and inhibits interaction of RAGE with its ligands[J]. Am J Physiol Cell Physiol, 2010, 299(1):C97-C110.
22 Salas A, Sans M, Soriano A, et al. Heparin attenuates TNF-alpha induced inflammatory response through a CD11b dependent mechanism[J]. Gut, 2000, 47(1):88-96.
23 Hagiwara S, Iwasaka H, Shingu C, et al. High-dose antithrombin III prevents heat stroke by attenuating systemic inflammation in rats[J]. Inflamm Res, 2010, 59(7):511-518.

